看CRISPR/Cas9基因编辑技术如何玩转药物靶点(二)——激酶特辑


蛋白激酶研究思路
构建出ROCK1敲除/PAK敲除/LIMK敲除Jurkat细胞系研究细胞凋亡膜泡形成机制
构建出ROR1敲除MDA-MB-231细胞系研究乳腺癌侵袭的信号通路
构建PKM1-KO敲除、PKM2敲除、PKM敲除4T1细胞系研究细胞葡萄糖代谢机制
看CRISPR/Cas9基因编辑技术如何玩转药物靶点(二)——激酶特辑
现代生物学把蛋白质视作一切细胞、生物的基础,是生命活动的主要承担者。但是,要想让生命活动有序进行,那就必须让蛋白质们在合适的时候“工作”,在工作之后及时“休息”。因此,蛋白激酶和磷酸酶作为蛋白们的分子开关,控制着蛋白的活化和失活,是所有生物学反应中必不可少的一份子。那么,调控蛋白激酶的表达往往能比控制下游的功能蛋白更有效干预某种生命活动。
蛋白激酶研究思路
起初人们研究蛋白激酶十分艰难,大多数科学家一般需要确定了某种蛋白在一个生命活动中起决定性作用之后,才会通过进一步的检测,证实其为蛋白激酶。例如著名的致癌基因Src,人们一开始发现Rous肉瘤病毒感染的鸡细胞后,将基因整合入细胞基因组中,成为肿瘤细胞,通过src基因促使感染细胞不断地增殖。在发现Src是癌基因后,人们进一步确定它编码的蛋白产物为蛋白激酶。
随着上世纪80年代DNA测序技术的开发,各种蛋白激酶特征性序列被解析出来,这一突破大大加速了对蛋白激酶的挖掘。到如今的基因组时代,我们已经拥有了生物体完整的激酶组信息。我们可以通过其磷酸化的位点,筛选出潜在的磷酸化靶点。这为我们研究生命过程的机制、癌症的发展、各种信号通路的探索提供了莫大的帮助。[1]自第一个蛋白激酶的抑制剂药物伊马替尼(Imatinib)获得FDA上市批准以来,已经过了21年。目前FDA批准的药物已经将近100种,此外还有更多的蛋白激酶相关药物正在开发和临床测试。蛋白激酶相关药物的问世,为治疗免疫系统疾病和恶性肿瘤提供了有力的帮助。许多研究者也对蛋白激酶的研究充满热情,目前研究蛋白激酶的主要套路可以归结如下:
1、找到目标蛋白激酶:蛋白激酶作为分子开关,在大多生命活动的过程中,都起着较为重要的作用,在整个信号转导中往往起着“四两拨千斤”的作用。因此,在通过meta分析或NGS测序获得的组学结果中,可以优先选择其中的某些具有显著性差异的蛋白激酶作为干预靶点。
2、抑制剂初步验证假设:大多数蛋白激酶都有对应的小分子抑制剂。为了能够快速验证自己的假设,我们可以前期利用蛋白激酶相应的抑制剂,快速干预蛋白激酶的活性或者表达情况,来探究蛋白激酶在信号传导通路中是否起重要作用。但在观察到小分子抑制剂能够明显干预信号传导后,为了得到更可靠的数据,我们可以进一步通过基因编辑,准确地敲除或过表达目的基因,观察相应的结果。这样得到的数据可能会更加可靠。
3、进一步寻找下游磷酸化靶标:在研究蛋白激酶的信号通路时,往往需要寻找蛋白激酶的下游磷酸化靶标。在如果没有任何线索的情况下,我们可以尝试使用磷酸化组学,进行高通量筛选。随后选择理想的目的靶点,进行蛋白水平的检测,以及与蛋白激酶的蛋白互作的验证。也可以通过基因编辑,敲除下游靶蛋白,来验证蛋白激酶的功能。
4、进行体内实验:对于研究蛋白激酶在疾病中的影响时,我们可以先选择合适的细胞系进行体外实验。体外实验完成之后,可以考虑进一步在体内验证结论的可靠性。我们可以通过构建cas9-gRNA的AAV,进步病毒靶点干预;也可以通过构建稳定的CKO或KO动物模型进行实验。
虽然蛋白激酶的研究热度不减,但目前仍有大量的蛋白激酶的作用并不明确,许多较为熟悉的蛋白激酶仍在许多未知信号通路中起着重要的作用。不过,随着CRISPR/Cas9的技术日渐成熟,精准敲除某个基因已经不再困难,研究某些蛋白激酶时可以不再把时间花在特异性抑制剂的寻找上。这为研究蛋白激酶提供了莫大的便利。下面给就大家分享几篇近期利用CRISPR/Cas9研究蛋白激酶作用的文章,供大家参考!
应用案例
1、细胞凋亡膜泡形成机制的研究
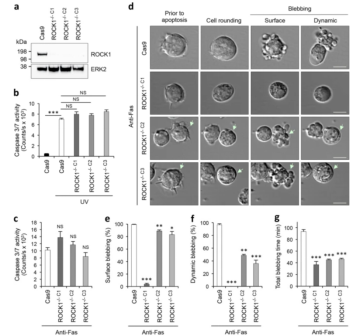
凋亡膜泡的形成是凋亡细胞解体过程中最具特征的步骤,并且人们认为ROCK1、PAK2 和 LIMK1这三个激酶在调控凋亡膜泡中起重要作用。而2020年Ivan Poon团队在Cell Death & Differentiation 发表的“ROCK1 but not LIMK1 or PAK2 is a key regulator of apoptotic membrane blebbing and cell disassembly”一文,通过基因编辑的手段,详细阐述了其中只有ROCK1是凋亡膜泡形成的关键激酶。[2]
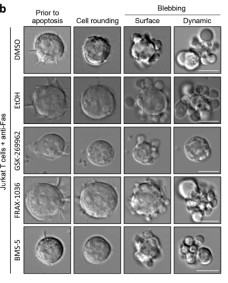
Poon团队在Jurkat细胞上诱导凋亡,然后分别利用小分子化合物GSK-269962抑制ROCK1,FRAX-1036抑制PAK2,BMS-5抑制LIMK1进行抗凋亡干预。
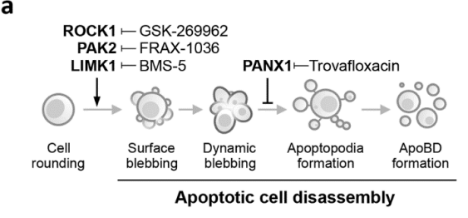
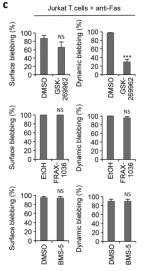
结果发现,加入GSK-269962这个ROCK1抑制剂之后,凋亡膜泡的形成明显减少了,而加入其他两个激酶的抑制剂之后,凋亡膜泡仍然产生。这表明,原先人们认为的3个激酶中,只有ROCK1是产生凋亡膜泡所必要的蛋白激酶。
由于目前大多数小分子抑制剂都存在靶向不特异的局限性。就拿GSK-269962为例,在抑制ROCK1(IC50为1.6nM)的同时,其还对ROCK2有部分抑制效果(IC50为4nM),此外,目前已知的GSK-269962抑制靶点还包括RSK1,MSK1,AKT1,AKT2,AKT3。这无疑是给机制探究工作造成了很大的难度。
因此,Poon团队进一步利用CRISPR/Cas9技术,成功构建出ROCK1-/-Jurkat细胞系。并且测试了敲除ROCK1之后,细胞系在面对Fas诱导的细胞凋亡时,凋亡膜泡的形成情况。其中克隆1的在细胞凋亡过程中表现出明显的表面和动态凋亡膜泡发生减少。
同时,该团队还构建了PAK2-/-以及LIMK-/-的细胞系,同样进行了凋亡膜泡形成的观察。结果表明,与敲除ROCK1不同的是,敲除PAK和LIMK并没有阻止细胞凋亡是细胞膜起泡的发生。总而言之,该研究通过抑制剂和基因编辑手段,表明 ROCK1,是凋亡膜泡形成的必要调节因子,而在此过程中,PAK和LIMK并非必要的蛋白激酶。
源井已成功推出超3000种KO细胞现货,涵盖27个信号通路、26种疾病类型及5大类药物靶点,上述提及的ROCK1基因已有相关敲除细胞在库,优质纯合速递仅需1周,现更享¥8000好价,购即送千元好礼!可点击入库搜索心仪细胞>>
2、乳腺癌侵袭的信号通路研究
在乳腺癌,以及所有的癌症发生发展过程中,都伴随着蛋白激酶的表达异常。研究清楚这些蛋白激酶在信号通路中发挥作用的信号通路是寻找治疗抗癌靶点的重要手段。Wei-zhou Zhang团队在Cells发表的”ROR1 Potentiates FGFR Signaling in Basal-Like Breast Cancer“一文中,总结过去的工作结果,发现受体酪氨酸激酶样孤儿受体1 (ROR1) 在基底样乳腺癌,以及其他类型的癌症中均过度表达,并且其过表达的程度与患者预后有着明显的相关性。[3]
Zhang团队首先利用流式分选,将患者来源的肿瘤团块中分选出ROR1阳性和ROR1阴性的肿瘤细胞群,分别移植到NSG小鼠中。8个月后,发现移植了ROR1阳性细胞的小鼠已经形成了明显的肿瘤团块,而移植了ROR1阴性细胞群的小鼠未形成任何肿瘤。
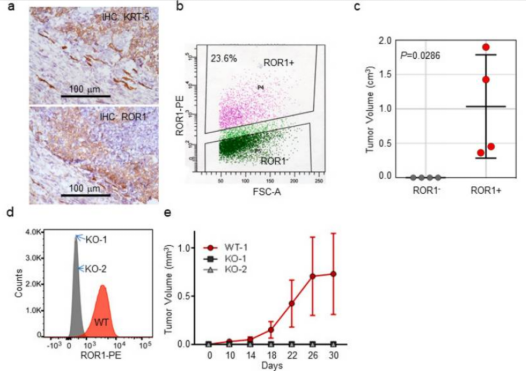
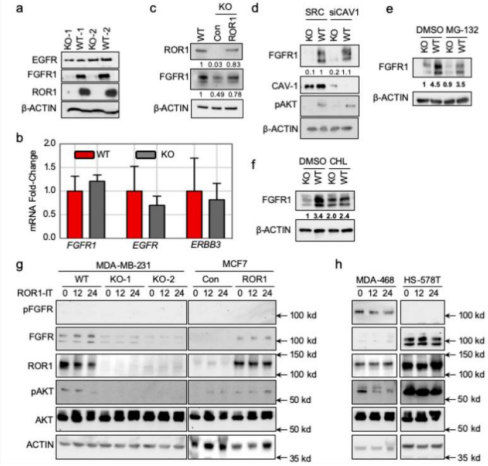
随后,Zhang团队利用CRISPR/Cas9技术,成功构建出ROR1敲除的MDA-MB-231细胞系,利用KO的细胞系与WT细胞系进行了后续的蛋白水平分析。结果表明,ROR1能够调控下游FGFR的表达水平。而在CRISPR/Cas9构建出的ROR1敲除的细胞系中,敲除细胞失去了上调FGFR蛋白水平的能力,FGFR 蛋白处于较低水平,下游的pAKT也有明显的降低,并且癌细胞侵袭能力明显减弱。由此蛋白激酶ROR1在基底样乳腺癌中的作用机制得以证实,同时ROR1将是癌症治疗的一个潜在靶点,并且能够作为一种肿瘤标记物用于乳腺癌的筛查。
3、细胞葡萄糖代谢机制的研究
蛋白激酶的磷酸化作用在糖代谢中起着关键性的作用。丙酮酸激酶M (PKM)是葡萄糖代谢的关键蛋白。PKM能够使得肿瘤细胞进行有氧糖酵解反应,即所谓的Warburg效应。然而PKM促进有氧糖酵解的机制尚不明确。近期Bing-hui Li团队在Cancer Biology and Medicine发表的“PKM2 promotes reductive glutamine metabolism”一文中详细阐述了PKM调控的代谢途径。[4]
Li团队利用CRISPR-Cas9技术,针对PKM的两种亚型,成功构建出PKM1-KO, PKM2-KO 的4T1细胞系,以及PKM-KO的4T1细胞系。利用同位素标记的葡萄糖和谷氨酰胺,观察糖代谢后续产物的生成量,发现PKM降低了为细胞内的葡萄糖存量水平,因而提高了α-酮戊二酸/柠檬酸的比值,以此促进通过还原途径产生谷氨酰胺衍生的乙酰辅酶A。
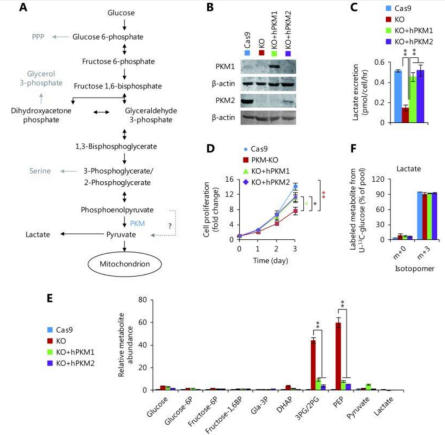
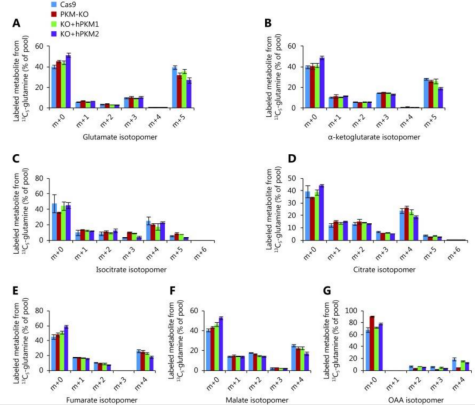
随后通过后续的在体实验,证实了PKM2 在促进还原性谷氨酰胺代谢和维持质子稳态中起关键作用,阐述了PKM2对正常细胞生理功能的重要性,提示抑制 PKM2 不是治疗癌症的优先策略。
源井可提供ROR1、PKM敲除细胞现货,也可提供快至4周KO细胞极速定制服务满足你不一样的科研需求,定制服务低至¥1.28万,现订购立享千元好礼,可点击了解服务详情>>
从上述的三个研究案例中可以发现,CRISPR/Cas9技术在其中成为了一种精准控制变量的高效手段,这都有赖于CRISPR/Cas9技术的独特优势。源井生物一直致力于CRISPR/Cas9基因编辑细胞,同时拥有CRISPR-U™技术专利,其编辑效率是传统技术的10-20倍,目前已拥有超3000种KO细胞现货库,欢迎点击右方咨询按钮与我们联系!
1 Manning, G., Whyte, D. B., Martinez, R., Hunter, T. & Sudarsanam, S. The protein kinase complement of the human genome. Science 298, 1912-1934, doi:10.1126/science.1075762 (2002).
2 Tixeira, R. et al. ROCK1 but not LIMK1 or PAK2 is a key regulator of apoptotic membrane blebbing and cell disassembly. Cell Death Differ 27, 102-116, doi:10.1038/s41418-019-0342-5 (2020).
3 Pandey, G. et al. ROR1 Potentiates FGFR Signaling in Basal-Like Breast Cancer. Cancers (Basel) 11, doi:10.3390/cancers11050718 (2019).
4 Liu, M. et al. PKM2 promotes reductive glutamine metabolism. Cancer Biol Med 15, 389-399, doi:10.20892/j.issn.2095-3941.2018.0122 (2018).










