细胞转染效率总是提不上来,方法选对了吗?

细胞转染效率总是提不上来,方法选对了吗?

转染是细胞实验中广泛使用的技术,通过转染可将外源核酸(DNA、RNA等)引入真核细胞,从而对基因的产物或其功能进行研究,是基因编辑细胞构建必不可少的步骤。然而转染效率不高的问题,总是困扰着许多新手小白,时常也会令颇有经验的细胞培养达人感到头秃。
细胞转染的效率跟哪些因素有关呢?总的来说可以概括为三个方面:
- 1) 细胞本身:包括细胞的种类、来源和代次等,这些信息基本决定了该细胞是否容易被转染。
- 2) 转染载体:转染载体的大小、质量和用量也对转染效率有影响,对于不同大小的载体需要优化不同的实验参数或用量,在质量方面需要对质粒的浓度、纯度和构象、RNA是否降解等进行严格的把控。
- 3) 转染方法和试剂:没有一种转染方法适用所有细胞,对于不同的细胞,选择合适的转染方法和试剂至关重要。其中细胞和载体大家相对来说比较熟悉,今天小源主要从第3点转染方法和试剂着手,给大家进行总结和分享。
首先,我们来盘点一下细胞转染都有哪些方法?按照转染的原理,大致可分为物理介导(如电穿孔法、显微注射法、基因枪法)、化学介导(如磷酸钙共沉淀法、脂质体转染法、阳离子聚合物介导法等)和生物介导(主要是各种病毒)三类。其中实验室最常用的主要有物理介导的电穿孔法、化学介导的脂质体法和生物介导的慢病毒法。
脂质体法
脂质体通过表面的正电荷与核酸磷酸基团的负电荷相互作用形成内包DNA分子的复合物,复合物表面带正电,会被带负电的细胞膜所吸附,进而通过融合或细胞内吞完成外源DNA分子的导入,是目前实验室最方便的转染方式之一。
具体过程分为几步:
- 1) 转染试剂与核酸在体外孵育时形成带正电荷的复合物。
- 2) 复合物被添加到细胞中,通过静电相互作用与带负电的细胞表面结合。
- 3) 细胞通过内吞作用将复合物内化到称为内体的膜囊泡中。
- 4) 转染试剂使内体膜不稳定。
- 5) 复合物从内体中逸出并在细胞质中释放核酸(siRNA、miRNA 或大RNA通常在细胞质中具有活性)。
- 6) DNA 必须定位于基因表达盒转录的细胞核。
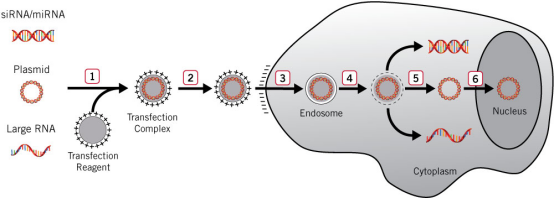
图1.脂质体法转染过程示意图[1]
电穿孔转染法
电穿孔法通过高强度电场引起细胞膜电位变化,瞬时提高细胞膜通透性,使细胞膜上产生可逆性小孔便于外源核酸的进入(图2),适用于几乎所有类型的细胞,是目前一种较为强大的转染方式。目前市面上比较常用的电转仪品牌有Thermo的Neon、Lonza的Nucleofector系列、Bio-rad电转系统,还有后起之秀Celetrix等
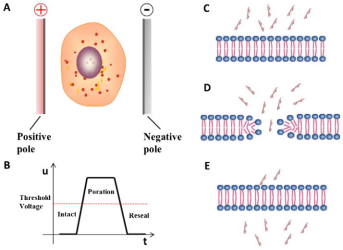
图2.电穿孔原理[2]
慢病毒转导法
慢病毒属于逆转录病毒科,能够转导非分裂细胞和分裂细胞。人类免疫缺陷病毒1型 (HIV-1) 是研究得最多的慢病毒。具体过程为:
- 1)通过将基因工程改造的目的质粒与病毒包装所需的辅助质粒共转到293T工具细胞,生产细胞转导所需的慢病毒颗粒。
- 2)将慢病毒颗粒转染靶细胞,慢病毒表面包膜蛋白与细胞受体结合进入细胞。
- 3)慢病毒RNA被逆转录成双链DNA。
- 4)双链DNA与整合酶形成预整合复合物,再通过核孔复合物进入细胞核内。
- 5)整合酶将慢病毒LTR之间的部分整合到细胞基因组上。
- 6)整合的外源DNA开始转录,表达目的基因。
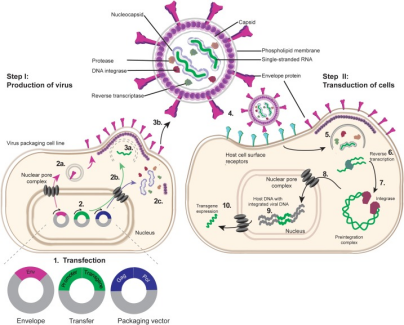
图3.慢病毒生产和转导过程[3]
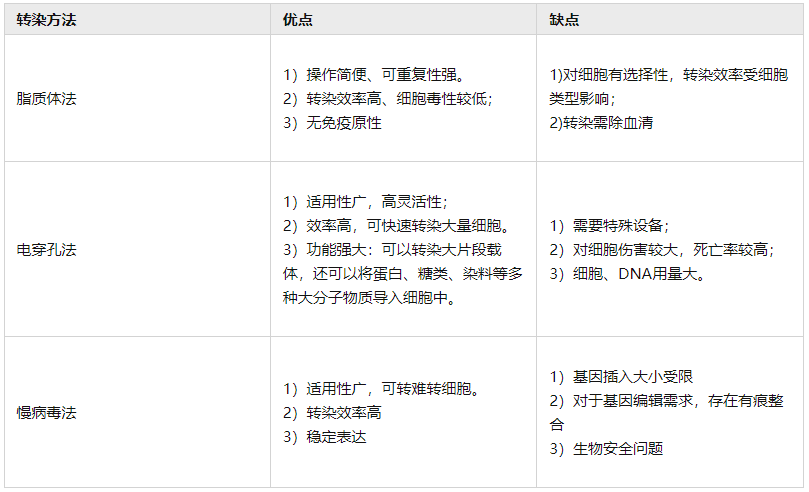
三种转染方法比较
了解了三种转染方法的基本原理,接下来小源还帮大家归纳了它们各自的优缺点。
如何选择转染方法?
那么问题来了,如果你刚拿到一种新的细胞,怎么确定使用哪种转染方法呢?
1.了解细胞:首先,要从细胞供应商或网上查询细胞背景,了解细胞的来源、特性、培养条件、代次和增殖时间等信息,对细胞有个初步的了解。
2.参考转染案例:找到成功的转染案例做参考可以让你少走弯路!一方面可以跟转染试剂供应商或电转仪器供应商沟通,询问对方是否有做过该细胞转染测试,效率和参数是怎么样的。另一方面可以在网上检索文献资料,看是否有人对该细胞进行过转染操作,使用的什么方法,操作流程是怎样的,转染效率如何。最后结合实验室的具体情况,优先选择现有仪器和试剂可满足的转染方法进行效率测试。
3.预实验:做好以上准备,我们就可以开始预实验摸索最佳转染参数了,一般使用带荧光标记的载体进行转染率的验证。按照事先查好的资料或者供应商提供的转染protocol对细胞进行转染测试,测试时一般测多组实验参数(比如脂质体法测DNA与转染试剂不同用量比例、电穿孔测试不同的电转参数,慢病毒法测试不同的MOI),转染24h-48h后观察转染率,选择效率最高且细胞状态良好的一组进行后续正式实验。如果最高的一组转染效率都不足30%,排除操作问题的情况下,可能是该方法不适用于这株细胞,建议更换其他转染方法。
看完是不是觉得自己又行了呢!源井有1周达慢病毒现货、慢病毒包装服务及超百种KO细胞专用培养基可以助你转染一臂之力!
如果觉得预实验摸索转染参数费时又费力,也可以选择将繁琐重复的细胞构建工作交给有丰富细胞培养和基因编辑经验的源井生物!
经多年磨练,源井对转染已炉火纯青,不仅能轻松驾驭上述三种转染方法,还建立了一套完善的预实验流程及超200种常用细胞系的预实验数据库,不仅对常用细胞系的转染参数、单克隆形成参数、药筛参数了如指掌,还能对接收的新细胞系进行快速解密!更在精研的转染专用培养基的加持下,实现THP-1、RAW264.7、MDA-MB-231、iPS/ES等较难转染细胞的高效转染,为细胞构建的后续工作打好基础!
优质敲除/点突变/敲入/稳转纯合克隆交付快至4周,助你实验快人一步,点击进行咨询了解服务详情>>
[1] https://www.mirusbio.com/transfection
[2] Du X, Wang J, Zhou Q, Zhang L, Wang S, Zhang Z, Yao C. Advanced physical techniques for gene delivery based on membrane perforation. Drug Deliv. 2018 Nov;25(1):1516-1525. doi: 10.1080/10717544.2018.1480674. PMID: 29968512; PMCID: PMC6058615.
[3] Maes M E, Colombo G, Schulz R, et al. Targeting microglia with lentivirus and AAV: Recent advances and remaining challenges[J]. Neuroscience letters, 2019, 707: 134310.










