iPSC精准基因编辑技术概述
源井生物的iPSC基因编辑技术是通过基于CRISPR/Cas9体系的基因编辑技术,对iPSCs进行基因敲除、敲入、修复或点突变等编辑操作,可应用于疾病模型构建、基因治疗,以及病理学和发育生物学的机制研究。源井生物提供全方位的基因编辑服务,具备自主研发的CRISPR-U和EZ-HRex等基因编辑技术平台和优势,确保编辑结果的准确性和稳定性。

源井独家优势
300+干细胞成功案例
包含干性检测报告
CRIPSR-U™专利技术
EZ-editor™单克隆鉴定技术
干细胞培养体系
丰富案例
iPS细胞基因编辑服务
我们提供一系列基因编辑服务,帮助您精准实现iPSC细胞株的基因编辑,进行相关的遗传研究和疾病模型开发
技术服务路线
基因信息分析与方案制定

细胞验证

sgRNA/Donor设计与构建
细胞转染

pool效率检测

单克隆筛选

基因型鉴定

细胞质控

iPSC数据展示
iPS细胞形态
iPS细胞转染效率
iPS细胞干性检测
iPS细胞
iPS单克隆

iPSC基因编辑技术的应用领域

病理机制研究与药效评估
利用基因编辑技术在iPSCs引入致病突变或病理遗传特性,模拟疾病表型,可用于病理机制的探索与高通量药物筛选;

组织器官的再生与修复
iPSCs具有分化为功能性细胞(如胰岛β细胞、多巴胺神经元、视网膜细胞等)的潜能,可用于修复相对应的组织损伤;

发育生物学基础研究
iPSCs可模拟人体早期胚胎发育过程,结合基因编辑技术,可应用于相关基因在人体特定发育过程中的功能和机制研究;

免疫疗法与癌症研究
利用基因编辑对hiPS细胞的HLA等基因进行工程化改造,生成“通用型”CAR-T细胞,降低免疫排斥,用于癌症治疗。

个性化细胞治疗
利用基因编辑纠正患者hiPS细胞中的致病突变后,分化为功能细胞(如多巴胺神经元、胰岛β细胞),移植治疗帕金森病、糖尿病等。
应用案例
目前,CRISPR基因编辑与iPS联合用于疾病模型构建和细胞治疗的案例已经有很多了,包括神经退行性疾病、代谢性疾病和心脏遗传病
表1:CRISPR基因编辑与iPS结合研究案例
| 基因编辑方法 | 疾病名称 | 突变基因 | 疾病模型研究 | 细胞治疗应用 |
|---|---|---|---|---|
| CRISPR-KO构建疾病模型 | 免疫缺陷,着丝粒的不稳定,和面部异常(ICF)综合征 | DNMT3B | √ | |
| 显性营养不良性大疱表皮松解症(DDEB) | COL7A1 | √ | ||
| 丹吉尔病(TD) | ABCA1 | √ | ||
| 心房颤动(AF) | KCNA5 | √ | ||
| CRISPR-KO恢复正常功能 | 脆性X综合征(FXS) | FMR1 | √ | |
| 杜氏肌营养不良(DMD) | dystrophin | √ | √ | |
| CRISPR-KI同源重组基因矫正 | 进行性骨化性肌炎(FOP) | ALK-2 | √ | |
| 慢性肉芽肿性疾病(CGD) | CYBB | √ | √ | |
| 肌萎缩侧索硬化症(ALS) | SOD1 and FUS | √ | ||
| 额颞叶痴呆 | CHMP2B | √ | ||
| 无β脂蛋白血症 | MTTP | √ | ||
| 肥厚性心肌病(HCM) | PRKAG2 | √ | ||
| CRISPR与piggyBAC结合 | β地中海贫血 | HBB | √ | √ |
| 布鲁格达氏综合症 | SCN5A | √ | ||
| 亨廷顿病(HD) | HTT | √ | ||
| 遗传性运动感觉神经病(HMSN) | TFG | √ | ||
| 四氢生物蝶呤(BH4)缺乏症 | PTPS and DHPR | √ | ||
| HIV | CCR5 | √ | √ | |
| 真性红细胞增多症(PV)和α1-抗胰蛋白酶(AAT)缺乏症 | JAK2-V617F 和 SERPINA1 | √ | ||
| CRISPRi抑制基因表达 | 长QT综合征(LQTS) | CALM2 | √ |
疾病建模:常染色体显性多囊肾病iPS模型构建
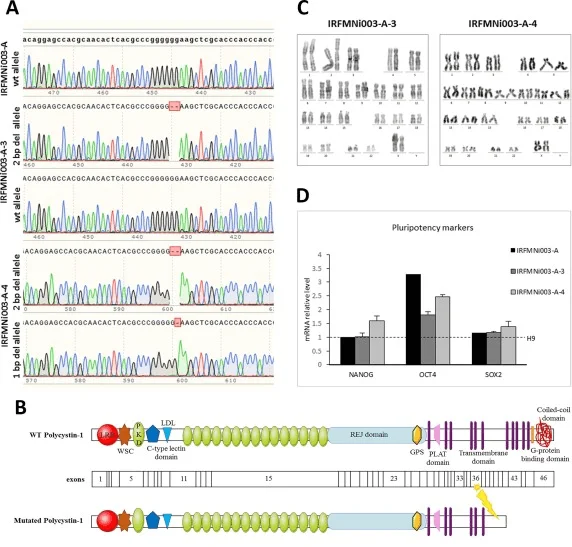
常染色体显性多囊肾病 (ADPKD) 是最常见的遗传性肾病,发病率大约为1/400人-1/1000人。常染色体显性多囊肾和两个基因缺陷有关,其中85%的患者是由位于16号染色体的基因PKD1(TRPP1)发生突变所致。Romano等通过使用CRISPR-Cas9技术在PKD1基因中产生了杂合敲除与纯合敲除的等基因iPS细胞系。并验证了敲除后的iPS细胞在三个胚层中保持干细胞样形态、正常核型、多能性和分化能力。可以作为研究 ADPKD致病机制以及药物筛选的模型资源。
基因矫正:患者iPS基因矫正后恢复了β-珠蛋白(HBB)表达
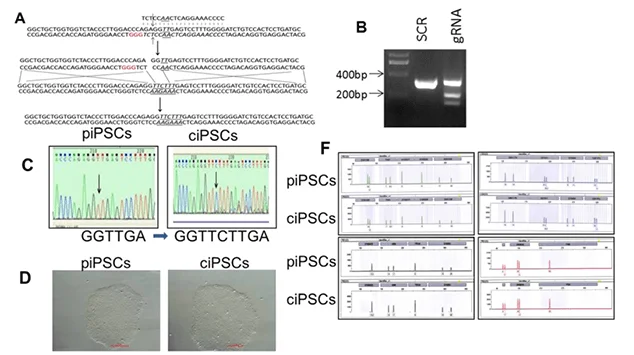
β-地中海贫血是一种单基因疾病,由β-珠蛋白 ( HBB ) 基因点突变或片段缺失导致正常β珠蛋白肽链缺失或合成量不足引起的。β-地中海贫血携带者在中国南方的患病率为 2.54%,目前造血干细胞移植是重度β-地中海贫血患者唯一可用的根治性治疗方法。然而,造血干细胞移植受限于大多数患者缺乏HLA匹配的健康供体。研究人员通过CRISPR/Cas9系统对患者来源的iPS细胞(基因型为homozygous 41/42 deletion)进行基因编辑,主要设计了靶向HBB突变位置的gRNA,同时以包含正常序列(WT)的PCR产物作为Donor模板进行重组,筛选到基因矫正成功的细胞。将矫正成功的iPS细胞重新分化为造血干细胞HSCs,最终发现移植了矫正iPS后的NSI免疫缺陷鼠体内可以正常造血,并产生正常的HBB蛋白,这项研究为β-地中海贫血的治疗带来新的希望。
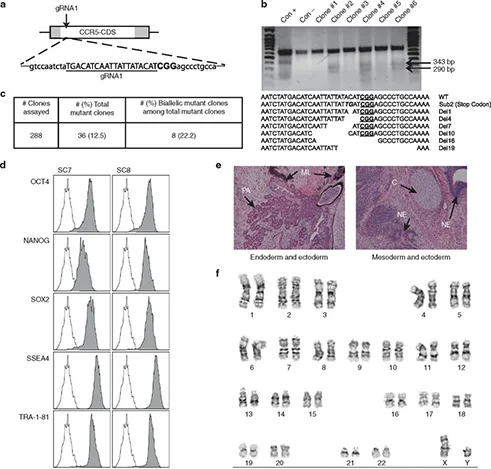
抗病毒治疗:iPS及其衍生血细胞敲除CCR5后具有HIV抗性
趋化因子受体5(CCR5)作为HIV病毒的共同受体,对于CCR5嗜性病毒的细胞感染至关重要,研究表明,CCR5功能性丧失可防止HIV感染。通过对病人体内的免疫细胞进行基因编辑,有望对HIV感染的患者进行治疗,但由于免疫细胞转染效率低,培养及扩增难度较大,难以直接对其进行基因编辑。Kang等通过使用CRISPR/Cas9技术,在iPS上进行了基因编辑,分别设计靶向CCR5的单gRNA敲除方案和双gRNA敲除方案,成功筛选到CCR5敲除纯合克隆。纯合CCR5突变的iPS细胞系仍然显示出多能干细胞的典型特性,并有效分化为造血细胞,巨噬细胞,体外HIV感染实验表明其对CCR5嗜性病毒的攻击产生了独特的抗性。这项研究表明将iPS技术与CRISPR/Cas9技术结合,在HIV感染的治疗中有应用前景。