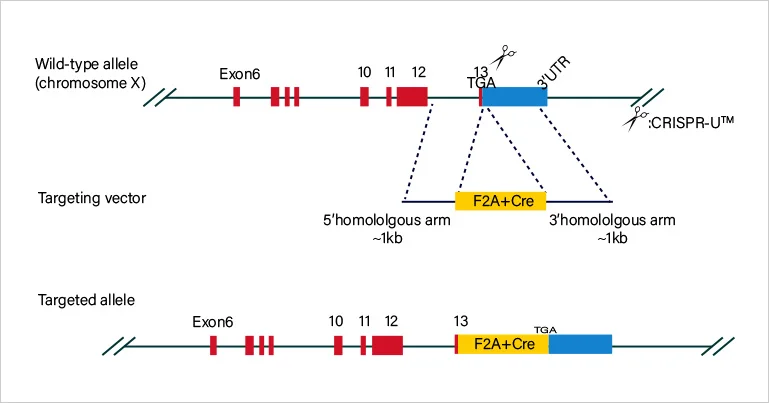
原理介绍
源井生物提供一站式的CRISPR/Cas9载体构建与慢病毒包装服务,满足科研人员基因编辑的多种需求。CRISPR/Cas9系统原为细菌的免疫防御机制,利用特异性gRNA靶向DNA序列并引导Cas9核酸酶切割靶点DNA,引发双链断裂后经非同源末端连接(NHEJ)或同源重组(HDR)修复,实现基因敲除/敲入/突变。而慢病毒载体则基于HIV-1伪型体系,可用VSVG包膜感染分裂和非分裂细胞,将外源RNA逆转录并整合入宿主基因组,实现长效稳定表达,且免疫原性低,适用于体外细胞和活体动物实验。

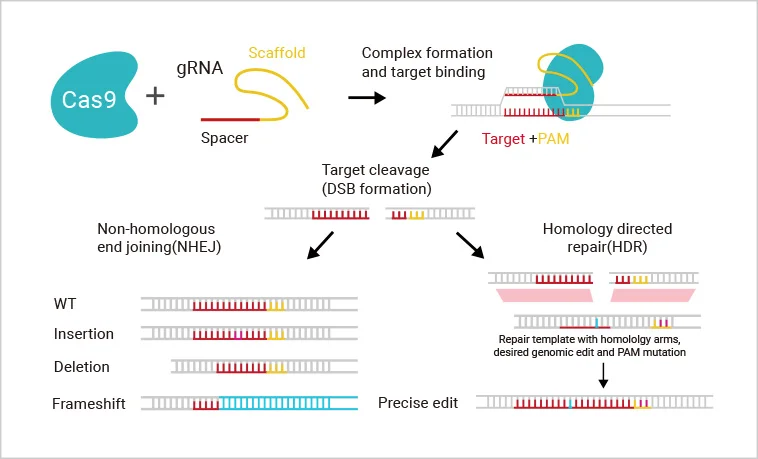
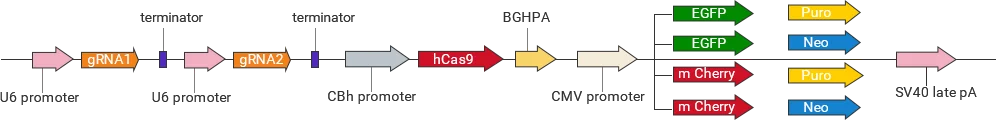
技术原理

CRISPR/Cas9载体构建
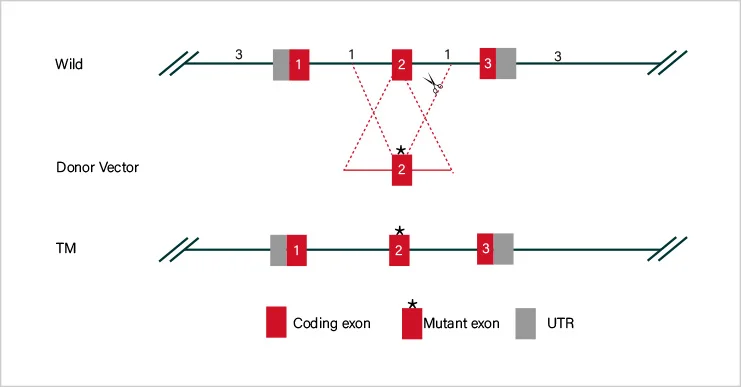
在靶基因序列上设计2–3个gRNA,引导Cas9识别并切割靶序列(PAM上游),诱导基因组DNA双链断裂。细胞利用NHEJ或HDR修复断裂,可造成移码突变或外源序列 插入,达到敲除、敲入或点突变效果。
点击了解详情
慢病毒转导原理
慢病毒载体去除了致病基因,将目的基因置入病毒基因组,通过体外包装(第三代系统)获得高滴度病毒。感染宿主细胞后,慢病毒RNA经逆转录酶转录为双链DNA,并整合到宿主染色体,实现目的基因长期稳定表达。由于慢病毒感染谱广,可以感染非分裂细胞,且其免疫原性低,不易激发强烈免疫反应,常用于基因 敲除/敲入、过表达、RNA干扰、microRNA研究以及体内基因治疗 等实验。
点击了解详情服务流程
基因敲除载体
基因敲除载体
方案设计:
源井生物根据客户需求,结合靶基因的情况进行敲除方案设计。源井生物研发的基因敲除系列YKO载体,包括慢病毒载体、普通载体等,可广泛应用于体外或体内研究。
小片段 敲除方案
gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
01
移码 敲除方案
gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
02
大片段 敲除方案
将整个基因的编码序列敲除,达到大片段敲除的效果。
03
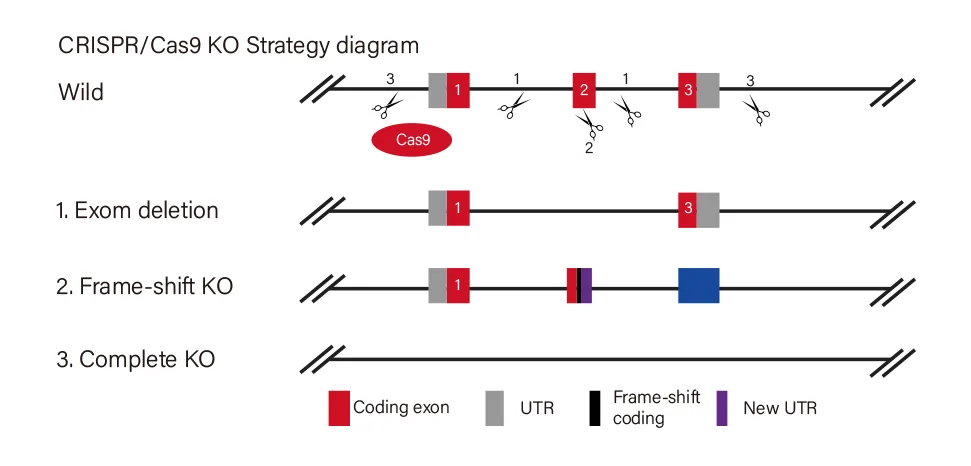
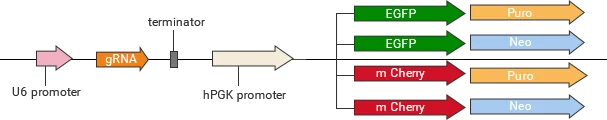
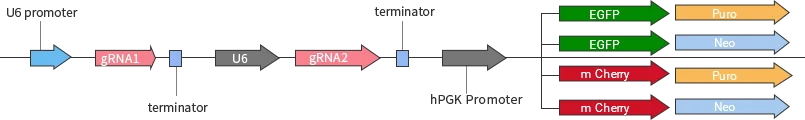
基因敲除载体分类
源井生物研发的基因敲除系列YKO载体,包括慢病毒载体、普通载体、腺相关病毒载体等,可广泛应用于体外或体内研究。
| YKO系列载体 | 载体名称 | 荧光抗性 |
|---|---|---|
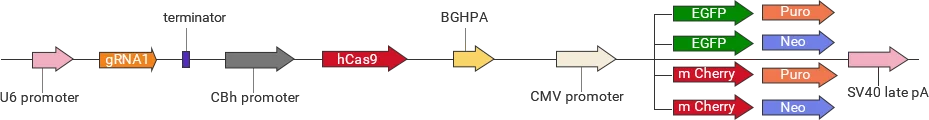
| 慢病毒 | YKO-LV001-single-gRNA | EGFP/mCherry可选,Puro/Neo可选 |
| YKO-LV001-dual-gRNA | EGFP/mCherry可选,Puro/Neo可选 | |
| 普通 | YKO-RP001-single-gRNA | EGFP/mCherry可选,Puro/Neo |
| YKO-RP001-dual-gRNA | EGFP/mCherry可选,Puro/Neo可选 | |
| 腺相关病毒 | YKO-AAV001-single-gRNA | EGFP/mCherry可选 |
| YKO-AAV001-dual-gRNA | EGFP/mCherry可选 |
质量控制标准:提供载体酶切和测序验证报告。
基因编辑载体应用:针对不同基因编辑对象的应用:不同类型细胞系,及大小鼠等。
服务流程及质量控制
提供载体酶切测序报告
载体构建

质粒大提

病毒包装

感染验证

qPCR检测 病毒滴度
载体构建
质粒大提
病毒包装
感染验证
qPCR检测 病毒滴度
FAQs
1. 病毒转导至细胞后多久才会表达?
Lentivirus表达时间较长,但在一般代谢较旺盛的细胞(如293T,HEK293等)上,病毒转导24小时后可以观察到荧光;代谢比较缓慢的细胞(如原代培养细胞,神经干细胞,胚胎干细胞等)荧光蛋白表达时间较长,转导后72-96小时甚至更长时间才可以观察到荧光。转导后的细胞可以连续培养一周,通过观察荧光的表达时间和表达强度来确定病毒对目的细胞的转导情况。
2. 慢病毒对目的细胞的转导效率很低,如何提高病毒的转导效率?
确保转导之前细胞处于良好的生长状态;可以使用易感细胞如293T进行滴度测试,验证病毒液滴度是否出现大幅下降;适当提高病毒转导的MOI值和延长转导时间。
3. 慢病毒转导后,细胞状态很差甚至出现大量死亡,如何解决?
转导前细胞状态不佳,加入病毒量太大,病毒携带的目的基因含有细胞毒性均有可能导致目的细胞状态异常,解决方法主要有:
- (1)稳定转导前细胞状态;
- (2)降低病毒加入量,降低MOI值, 验证目的基因的细胞毒性;
- (3)转导6小时后观察细胞,如细胞状态出现异常时更换新鲜培养基,若无则24小时后更换。