《Cell Stem Cell》进展:源井生物赋能血管畸形新模型构建与药物研发
静脉畸形(Venous malformations, VM)是最常见的血管畸形类型,由静脉内皮细胞(VECs)的体细胞突变引起,发病率约为万分之一到万分之二。患者常表现为血管结构异常,伴随局部疼痛、肿胀、出血,甚至影响器官功能,严重影响生活质量。目前临床主要依赖硬化治疗和手术切除来控制病情,但这些方法存在手术风险高、费用昂贵、难以根治等局限性。更棘手的是,针对VM的药物疗法仍是一片空白,迄今尚无FDA批准的相关药物。造成这一困境的关键原因之一,是缺乏理想的疾病模型。传统的转基因动物育种方法并不适用,因为VM的突变属于不可遗传、局部发病。虽然研究人员尝试过通过AAV病毒在小鼠体内递送致病突变基因来构建模型,但这种方式存在成本高、稳定性差、人鼠差异大等问题,难以广泛应用。因此,开发一种既能复现疾病特征,又具备成本可控、可规模化复制的新型疾病模型,对深入理解VM的发病机制、推动新药研发具有重要意义。
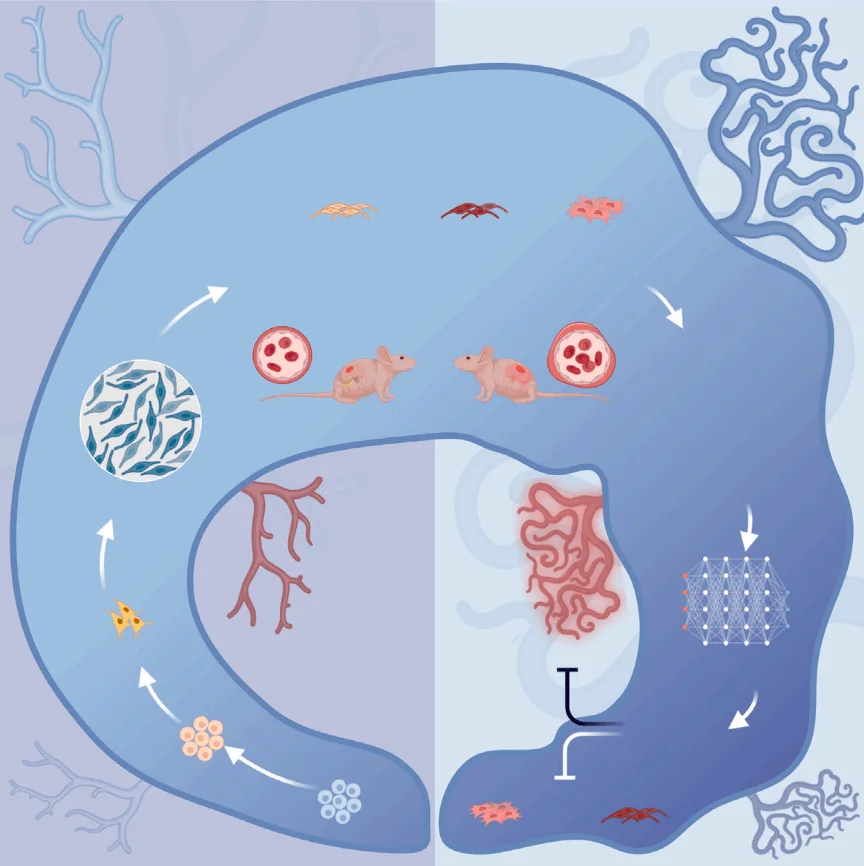
北京大学基础医学院血管稳态与重构全国重点实验室王凯研究员、孔炜教授,北京大学第三医院临床干细胞研究中心王茜研究员,以及北京大学国际癌症研究院谢正伟研究员团队,在《Cell Stem Cell》 发表重要研究成果。在本项研究中,源井生物提供的 THP-1-EGFP 细胞模型为项目的顺利推进提供了关键技术支持。论文题为“Generation of iPSC-derived human venous endothelial cells for the modeling of vascular malformations and drug discovery”,研究团队开发了一种高效的人 iPSC 向静脉内皮细胞(iVEC)分化方案。进一步地,他们利用携带 TIE2-L914F 杂合突变的 iPSC 衍生 iVEC 成功复现了静脉畸形的病理特征。依托 AI 辅助的药物预测与 Drug-seq 技术,团队发现 FDA 已批准、原本用于白血病治疗的药物 博舒替尼(Bosutinib) 能有效改善血管畸形表型,展现出潜在的临床应用价值。
本研究聚焦于 静脉畸形(VMs)中最常见的致病突变 TIE2 p.L914F (c.2740 C>T)。
TIE2(又称 TEK)属于受体酪氨酸激酶家族,主要在内皮细胞中表达,在血管生成、重塑、成熟及维持完整性过程中发挥关键作用。目前,研究血管畸形最常用的细胞模型是 在 HUVECs(脐静脉内皮细胞)中过表达 TIE2 突变体。然而,这类模型存在明显局限:
-
· 静脉特性缺失:体外长期扩增的 HUVECs 已部分丧失静脉内皮的特征;
-
· 基因拷贝数失真:过表达策略导致突变基因的拷贝数远高于患者体内的杂合状态,难以真实反映疾病机制。
为解决这些问题,研究团队建立了一套 稳健的人诱导多能干细胞(iPSCs)向静脉内皮细胞(iVECs)分化的方案。该方案通过调控 视黄酸信号通路影响细胞周期,从而促进细胞向静脉内皮方向的特异性分化。与此同时,研究人员利用 基因编辑技术,在 iPSCs 的 TIE2 基因中精准引入 L914F 杂合点突变,成功复现了患者的致病背景。
在前人工作的基础上,研究团队通过不断优化分化条件,最终建立了一套稳定且高效的静脉内皮细胞(iVECs)分化方案。该方案以血管内皮生长因子 VEGFA、成纤维生长因子FGF2、NOTCH 抑制剂DAPT和视黄酸(RA)为核心组成。进一步研究发现,RA 能够使细胞在 G1 早期发生阻滞,从而促进其向静脉谱系分化。单细胞测序对比 iVECs 和 iAECs(动脉内皮细胞)后,研究者发现 转录因子 MEF2C 可能在促进静脉内皮分化中发挥作用。而值得注意的是,MEF2C 过去从未被报道与动静脉内皮分化直接相关。为了验证其作用,团队进一步过表达 MEF2C 基因,结果发现静脉内皮细胞比例显著提升。功能层面上,作者通过源井生物提供的THP-1-EGFP细胞进一步验证了iVECs和iAECs的典型静脉内皮特征:
-
· 一氧化氮(NO)生成水平较低;
-
· 剪切应力响应较弱;
-
· 具有更强的免疫细胞招募能力。
在 体内移植实验 中,iVECs 不仅能持续表达静脉标记物,还能形成可灌注的血管管腔,进一步证明了其稳定的静脉功能属性。
研究团队利用 CRISPR-Cas9 技术 在 iPSCs 中精准引入 TIE2-L914F 杂合突变,并获得了携带该突变的 iVECs。突变型 iVECs 成功复现了 静脉畸形(VM)典型病理特征:
-
· 细胞骨架异常—— F-actin 结构紊乱;
-
· 细胞行为异常—— 增殖能力增强、抗凋亡能力上升、成管腔能力减弱。
Bulk RNA-seq 分析 进一步证实了突变细胞中相关信号通路及基因表达水平的异常。将突变型 iVECs 移植至小鼠肾包囊下后,形成了 结构畸形且功能异常的血管,从而在体内层面验证了该模型的病理真实性。为寻找潜在的治疗方案,研究者结合 深度学习驱动的 DLEPS 药物预测方法 与 DRUG-seq 分析,锁定了 博舒替尼(Bosutinib) 这一候选药物。实验结果显示,在突变型 iVECs 中给予博舒替尼后,其 VM 异常表型得到显著改善,表明该药物具备治疗潜力。进一步机制研究发现,博舒替尼能够通过 抑制内皮-间质转化(EndMT),降低细胞异常增殖水平,从而缓解由 TIE2-L914F 突变引发的病理表现。
综上所述,本研究揭示了视黄酸(RA)通过诱导细胞在 G1 期阻滞,激活静脉内皮分化相关基因的作用机制。研究团队在 iPSCs 中精准引入 TIE2-L914F 杂合突变,并成功构建了可复现静脉畸形病理特征的 iVECs 模型。在此基础上,结合深度学习与高通量 DRUG-Seq 筛选,发现 FDA 已批准的药物 博舒替尼(Bosutinib) 能在体内外显著改善异常表型。该成果不仅为静脉畸形的发病机制研究提供了新模型,也为血管畸形相关疾病的药物研发和临床干预开辟了新的方向。
源井生物提供的支持
在本研究过程中,THP-1-EGFP细胞模型为项目的顺利推进提供了关键技术支持。 源井生物现拥有超2000+稳转细胞产品(“单克隆”级,稳定高表达),包括Luc细胞、EGFP细胞、Cas9细胞、OVAL细胞等常用工具细胞,以及涵盖多种热门基因和多种细胞系的基因过表达稳转株。这些稳转细胞株代次低、活性高、状态好,采用慢病毒或自主研发的EZ-OE™技术构建,能稳定表达目的基因,可以满足不同研究领域的需求。点击了解更多稳转株定制服务>>
获取文献同款细胞株
源井生物所提供的EGFP稳转细胞株代次低、活性高、状态好,采用慢病毒法构建,能稳定表达EGFP荧光蛋白,可用来完成药物的高通量筛选及体内荧光示踪,稳转细胞株构建等实验。点击进入细胞库,查看更多 EGFP 稳转细胞株>>
参考文献
[1] Behravesh, S., Yakes, W., Gupta, N., Naidu, S., Chong, B. W., Khademhosseini, A., & Oklu, R. (2016). Venous malformations: clinical diagnosis and treatment. Cardiovascular diagnosis and therapy, 6(6), 557–569. https://doi.org/10.21037/cdt.2016.11.10
[2] Uebelhoer, M., Nätynki, M., Kangas, J., Mendola, A., Nguyen, H. L., Soblet, J., Godfraind, C., Boon, L. M., Eklund, L., Limaye, N., & Vikkula, M. (2013). Venous malformation-causative TIE2 mutations mediate an AKT-dependent decrease in PDGFB. Human molecular genetics, 22(17), 3438–3448. https://doi.org/10.1093/hmg/ddt198
[3] Kangas, J., Nätynki, M., & Eklund, L. (2018). Development of Molecular Therapies for Venous Malformations. Basic & clinical pharmacology & toxicology, 123 Suppl 5, 6–19. https://doi.org/10.1111/bcpt.13027
[4] Cooke-Barber, J., Kreimer, S., Patel, M., Dasgupta, R., & Jeng, M. (2020). Venous malformations. Seminars in pediatric surgery, 29(5), 150976. https://doi.org/10.1016/j.sempedsurg.2020.150976
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
























 联系电话
联系电话
 投诉电话
投诉电话
