《Nature》系列进展:源井生物助力抗癌新靶点发现!——体内外实验实证:显著降低肿瘤恶性程度
双皮质素样激酶1(DCLK1)作为一种新兴的癌症干细胞标志物,在肿瘤发生过程中被激活,从而赋予细胞癌症干细胞特性并促进转移。然而,其在肿瘤中被激活的分子机制,以及为何选择性采用特定的可变启动子(AP)模式,仍然尚不清楚。
8月7日,首都医科大学研究团队在《Nature》子刊《Cell Death & Disease》上发表了重要研究成果。此次研究中,源井生物为课题组提供了关键载体模型,成为推动项目顺利开展的重要技术支撑。论文题为“Hypoxic stimulation of DCLK1 transcription and alternative-promoter switching fuels tumor malignancy in clear cell renal cell carcinoma”。该研究首次揭示,在透明细胞肾细胞癌(ccRCC)中,DCLK1 被显著激活,并伴随启动子模式的切换,从而偏向长变体(DCLK1-L)的表达。机制上,这一过程由 低氧–HIF2α–PLOD2 轴介导,并进一步激活 β-连环蛋白(β-catenin),促使其选择性结合并激活 α 启动子。研究结果显示,PLOD2–DCLK1-L 轴的过度激活与更高水平的上皮–间质转化(EMT)特征密切相关,并提示 ccRCC 患者的不良预后。值得注意的是,通过药物靶向 DCLK1-L 干预该信号通路,在体内外实验中均显著缓解了肿瘤的恶性进展。

研究背景
肾细胞癌(renal cell carcinoma,RCC)是成人最常见的泌尿系统恶性肿瘤之一。根据全球癌症流行病学统计,2020 年因 RCC 导致的死亡人数高达 179,368 例,其中大多数死亡归因于肿瘤的远处转移。透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)是 RCC 最常见的组织学亚型,占所有病例的 70%–90%,并在转移性 RCC 中约占 83%–88%。绝大多数 ccRCC 与 VHL 抑癌基因功能失活及其所引发的缺氧信号通路异常密切相关。
针对 DCLK1 的靶向治疗在体外和体内均能减轻低氧 PLOD2 丰富的透明细胞肾细胞癌的恶性程度
为评估抑制该信号通路的潜在临床价值,研究人员将 DCLK1 作为药物可靶向的关键分子,并选择了能够有效抑制 DCLK1 表达及其磷酸化的特异性抑制剂 DCLK1-IN-1。结果显示,DCLK1-IN-1 在低氧条件或 PLOD2 过表达的情况下均显著降低了 DCLK1-L 的诱导水平,从而有效阻断了低氧和 PLOD2 所驱动的体外上皮–间质转化(EMT)、迁移、侵袭及干细胞样特性的获得。
进一步地,研究人员通过全身给药 DCLK1-IN-1,验证了其在富含 PLOD2 的 ccRCC 异种移植瘤中的体内作用。实验中,研究人员将 ccRCC 细胞皮下接种于 NOD/Scid 小鼠体内以建立富含 PLOD2 的异种移植瘤,并将形成的大体积移植瘤再次皮下移植至 BALB/c 裸鼠体内。携瘤小鼠随后随机分为 DMSO 对照组和 DCLK1-IN-1 治疗组(n=8/组)。经 16 天隔日灌胃给药(25 mg/kg)后,DCLK1-IN-1 组的肿瘤体积、重量及生长速率均显著下降,抑瘤率达 85.1%。
此外,RT-qPCR 与 IHC 分析结果显示,DCLK1-IN-1 治疗可明显抑制富含 PLOD2 的 ccRCC 异种移植瘤中 EMT 表型和干细胞样特征:表现为上皮标志物 E-钙黏蛋白显著上调,间质标志物波形蛋白(vimentin)下调,以及癌症干细胞标志物 Nanog 的减少。
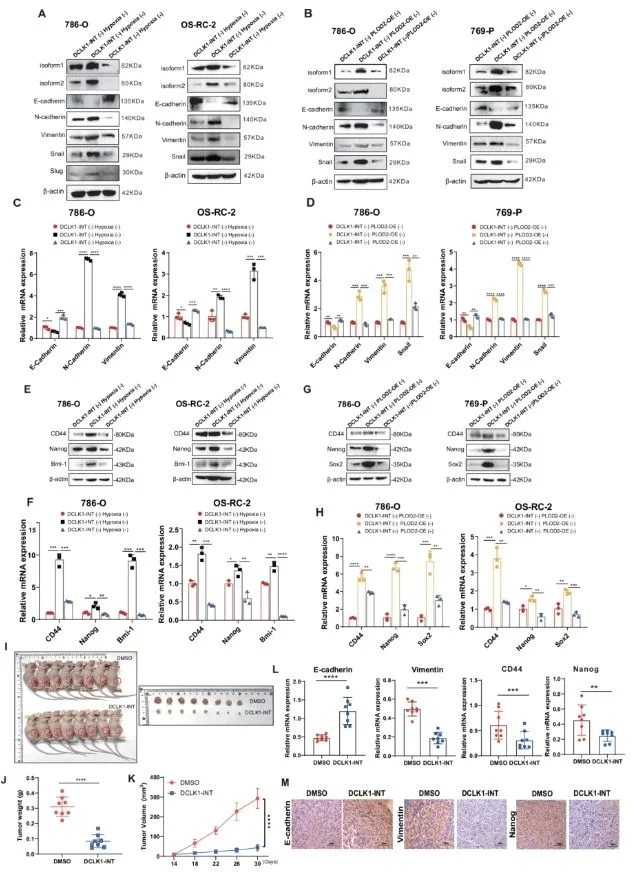
针对 DCLK1 进行靶向治疗可减轻体内外低氧 PLOD2 丰富的透明细胞肾细胞癌的恶性程度
针对 DCLK1 进行靶向治疗可减轻体内外低氧 PLOD2 丰富的透明细胞肾细胞癌的恶性程度
综上所述,这些结果表明,低氧且 PLOD2 高表达的 ccRCC 患者可能从 DCLK1 靶向抑制中获益,提示 DCLK1 在该亚群患者中具有潜在的临床治疗价值。
源井生物提供的支持
在本研究过程中,源井生物为实验设计与实施提供了重要的技术支持。源井生物在基因编辑技术领域具备丰富的研发与应用经验,能够根据不同研究需求提供定制化解决方案,涵盖从载体构建、细胞模型构建、CRISPR文库体内外筛选,到后续功能验证的全流程支持。
欢迎联系源井生物,获取更多专业化的基因编辑解决方案与科研支持!>>
参考:
Yao J, Huang X, Sun Q, Zhao W, Weygant N, Fan X, Liu H, Xiao Z, Yan R, Ge Y, An G, Liu J. Hypoxic stimulation of DCLK1 transcription and alternative-promoter switching fuels tumor malignancy in clear cell renal cell carcinoma. Cell Death Dis. 2025 Aug 7;16(1):594. doi: 10.1038/s41419-025-07916-2. PMID: 40775208; PMCID: PMC12332081.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划

























 联系电话
联系电话
 投诉电话
投诉电话
