【文献解读】源井CRISPR-B™技术助力解密沙门氏菌与Fe的爱恨情仇
沙门氏菌病是指由各种类型沙门氏菌所引起的对人类、家畜以及野生禽兽不同形式的总称。感染的人或其他动物粪便中的沙门氏菌会污染食品,可使人发生食物中毒。据统计在世界各国的细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首,我国内陆地区也以沙门氏菌为首位 。因此对沙门氏菌在宿主内生存适应机制进行研究,对沙门氏菌感染后治疗十分重要。
和其他肠杆菌科细菌相同,沙门氏菌也需要辅因子Fe来参与其固氮、DNA合成和损伤修复等多个重要生命过程。然而在自然界中的Fe,很难被沙门氏菌直接利用,所以沙门氏菌从宿主细胞中获得足够的Fe对其定植及生存至关重要。但宿主可通过营养免疫来限制其对Fe的吸收,因此沙门氏菌进化出一种具有高铁亲和力的儿茶酚铁载体——肠菌素(Ent)来对抗宿主的营养免疫。可矛盾的是,高浓度Fe会产生Fenton反应,从而产生大量羟自由基,导致沙门氏菌的死亡。最终在与宿主的相爱相杀过程中,沙门氏菌进化出铁稳态机制,可使其在获取所需铁的同时,又避免过量铁引起的毒害反应。
针对这一铁稳态机制,山东第一医科大学基础医学院(基础医学研究所)李冰清团队在蛋白质翻译后修饰水平对其进行研究,发现沙门氏菌可通过与Fe代谢有关的基因——YdiU,直接使高度保守的铁稳态主要调节剂fur 被UMP化修饰(UMPylation),从而消除Fur的Fe吸收抑制能力,最终促进沙门氏菌缺Fe时对Fe的吸收。并且还发现H118位点是Fur的主要UMP化位点,这对有效调控沙门氏菌的铁稳态机制具有重大意义。
研究第一步,作者模拟了其缺Fe环境,通过qPCR和western
blot测定了不同浓度联吡啶培养条件下以及600μM联吡啶培养不同时间下的沙门氏菌YdiU在mRNA和蛋白水平上的表达量(图1A-D)。结果表明YdiU能被联吡啶有效诱导表达,说明YdiU可以响应金属缺乏信号。且用联吡啶或正常LB培养基同时处理YdiU敲除菌株(ΔydiU)与野生型菌株(WT)时(图1E-G),通过细菌存活率进一步表明YdiU能被金属缺乏信号有效诱导,而Fe的回补实验(图1H)可以说明YdiU参与Fe的代谢途径。
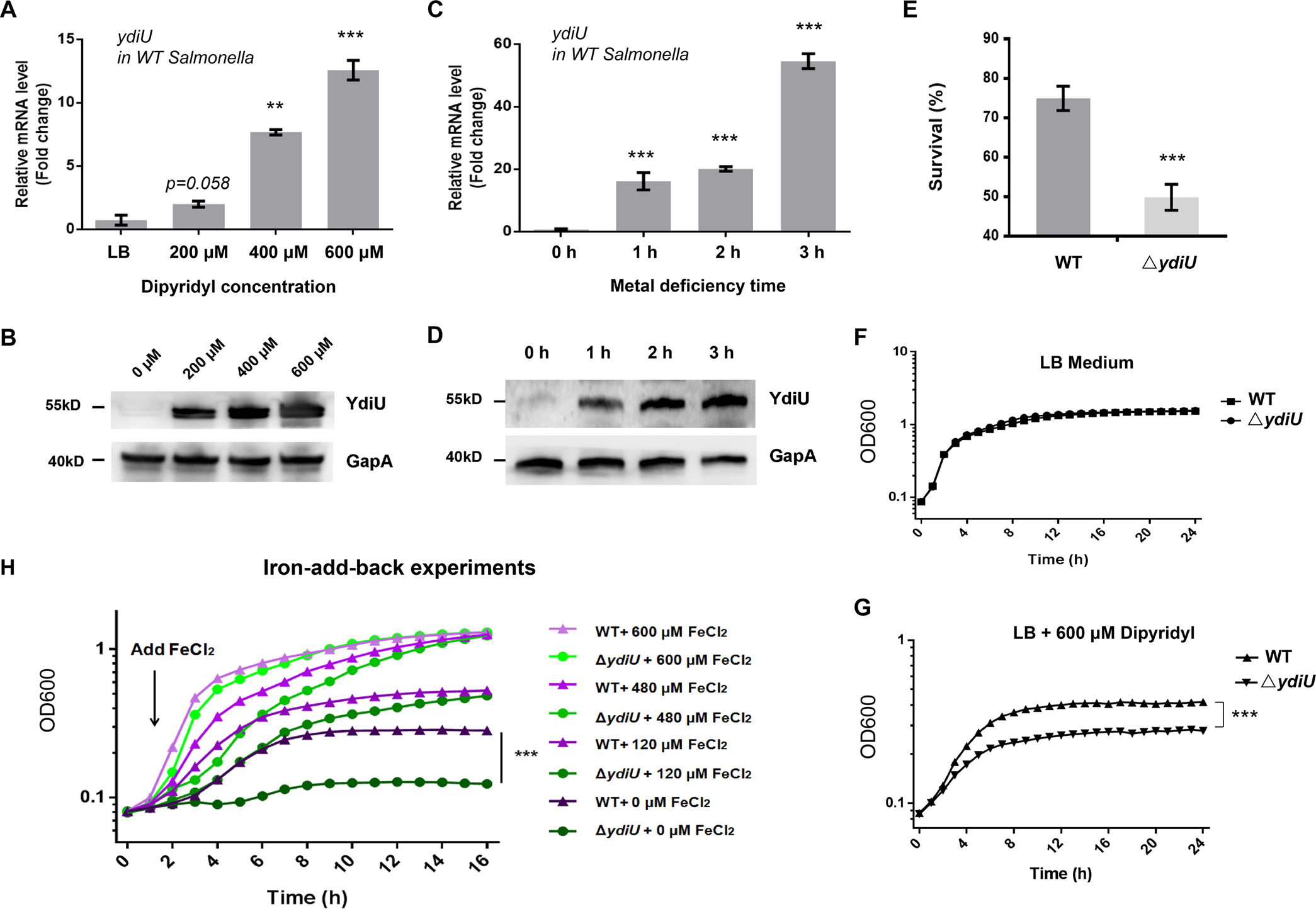
图1
YdiU被金属缺乏信号有效诱导
有研究表明,为了对抗宿主的营养免疫,肠杆菌科细菌体内合成的肠菌素(Ent)被分泌到体外来捕获铁原子,随后结合了Fe的Ents被一系列铁肠杆菌吸收蛋白(FepABCDEG)识别并运输到体内,以此提升细菌在缺铁条件下的生存率(图2D)。因此作者借助基于质谱的蛋白质组学,找到了WT和 ΔydiU沙门氏菌在金属缺乏条件下的251个差异表达蛋白(图2C)。其中一些Fe吸收相关蛋白在ΔydiU菌株中被显著抑制(图2B)。随后结合qPCR(图2E-F)以及ICP-MS(图2G)的结果推测,YdiU是作为一个吸收Fe的激活子,通过上调Fe吸收相关基因转录本,增加参与肠杆菌素生物合成和铁-肠杆菌素吸收的蛋白质水平,来促进沙门氏菌在缺铁条件下的铁摄取。
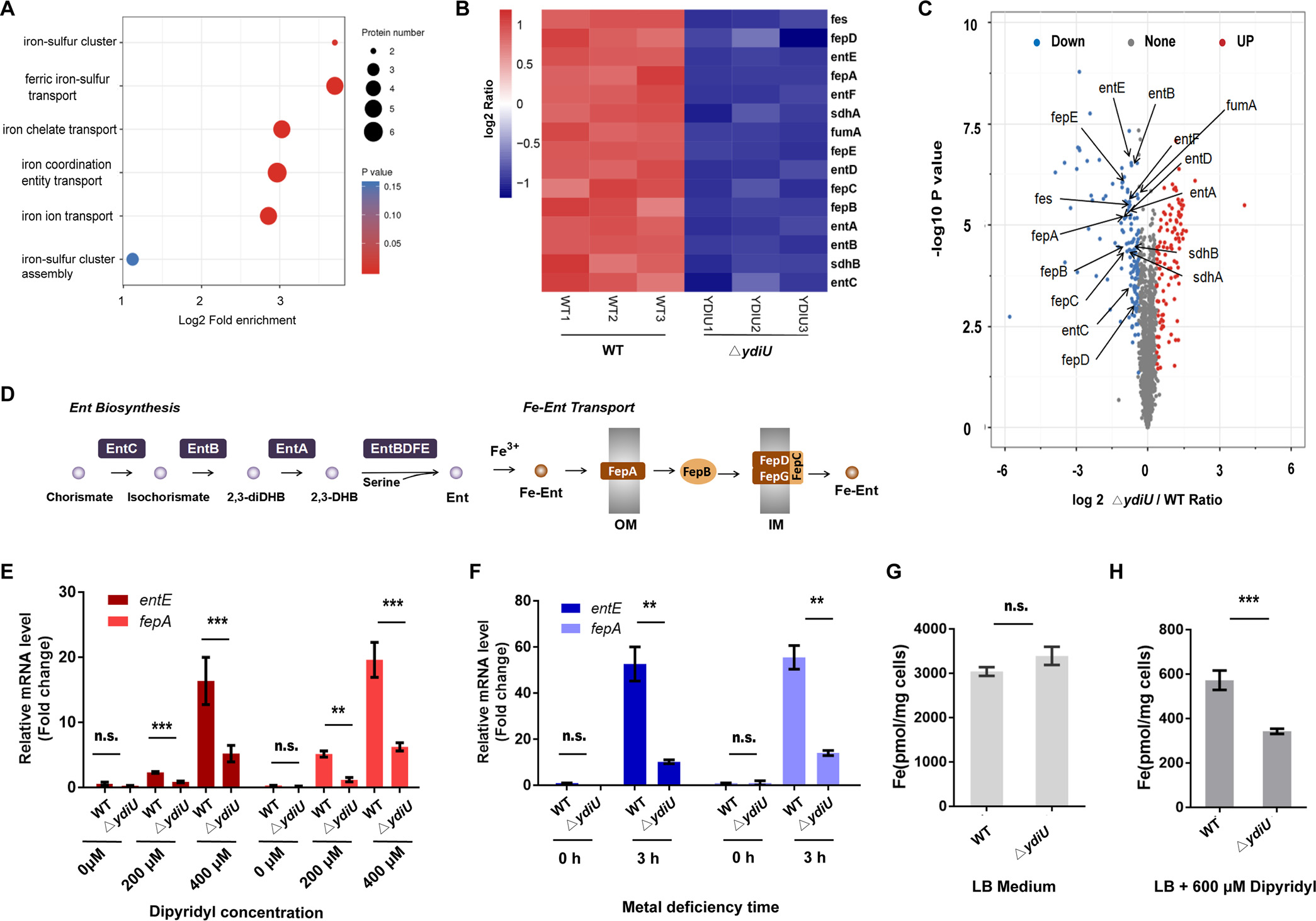
图2 金属缺乏条件下WT和 ΔydiU沙门氏菌的蛋白组学及ICP-MS分析结果
和之前的研究相比,作者在蛋白质组学数据中还发现,在缺Fe条件下,沙门氏菌铁摄取途径的主要调控基因Fur的蛋白水平在WT和 ΔydiU菌株中无明显差异,同等条件下通过qPCR检测其mRNA水平,同样显示出两者无明显差异。由此说明,YdiU对铁摄取途径的调节必须发生在Fur转录后一步。随后查阅文献可知,YdiU是一种催化蛋白翻译后修饰的酶。之前的蛋白质组学结果表明,在表达YdiU的沙门氏菌中存在46个UMP化蛋白,其中包括Fur,且它在H33位发生UMP化。由于Fur是铁摄取的主要调节器,这表明YdiU通过直接对Fur进行UMP化来发挥其功能,另外还发现YdiU是在Fur的H118位点对其进行UMP化。
为进一步研究Fur被UMP化后的功能,作者分析了UMP化的H33和H118位点的空间结构,H33位于Fe结合位点附近,H118位于Fur同源二聚体的表面。通过序列比对发现,UMP化的残基(H33和H118)在Fur的直系同源物中高度保守,表明YdiU介导的UMP化对Fur的调节被广泛采用。通过建立H118A突变体(由广州源井生物构建),发现Fur不能被YdiU
UMP化,从而证明H118是Fur的主要UMP化位点。为了进一步研究UMP化对Fur特性的影响,作者使用体积排除色谱法分析了YdiU敲除的Fur(FurdYdiU)和YdiU表达的Fur(FurpYdiU),两者不同的洗脱峰说明YdiU介导UMP化后,Fur的聚集状态发生了改变。随后用天然凝胶法和动态光散射法(DLS),对沙门氏菌内源Fur与体外UMP化的Fur(FurUMP)进行了比较,与内源Fur相比,FurUMP的条带发生了偏移。总体结果表明Fur经过UMP化后,稳定性更低且更易聚集。随后又通过凝胶迁移实验(EMSA)验证了YdiU通过使Fur
UMP化影响Fur的DNA结合活性。
最终根据研究结果,作者提出了以下机械模型(图3):当沙门氏菌在富铁环境中生长时,Fur蛋白与铁摄取基因的启动子区结合,抑制RNA聚合酶的招募并减少铁的吸收;当沙门氏菌进入宿主细胞时,缺铁、高活性氧和低pH均会激活YdiU蛋白的表达;然后YdiU通过UTP将一个UMP基团转移到Fur的H118位点,防止Fur的二聚化;Fur从铁摄取基因的启动子区被取代;通过这种机制,沙门氏菌获得足够的铁在宿主细胞内生存。鉴定的修饰位点在同源蛋白中高度保守,表明Fur的这种调控机制普遍存在。UMP到组氨酸的共价连接模式与磷酸化组氨酸(pHis)的共价连接模式相似,这在原核信号转导中起关键作用。
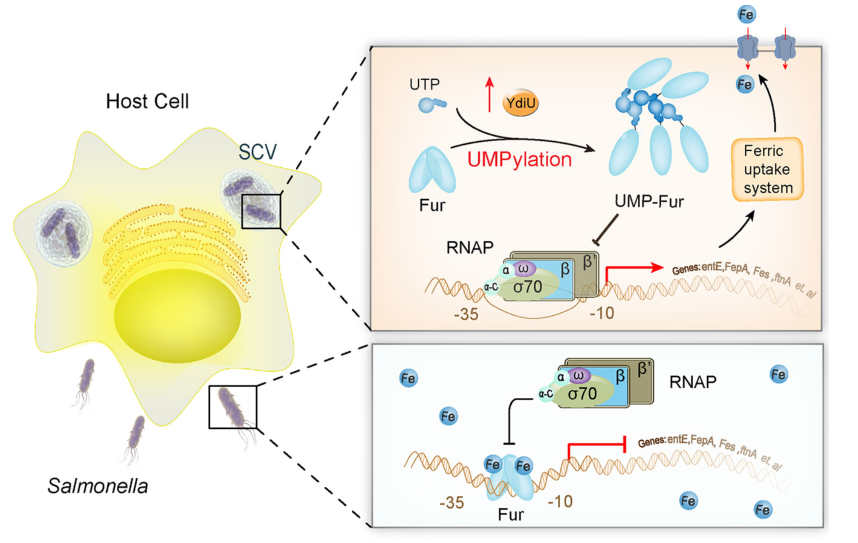
图3 沙门氏菌感染过程中YdiU介导的铁摄取调节模型
源井生物在该研究中利用了独家CRISPR-B™技术构建了沙门氏菌的H118A突变体,有效验证了铁稳态主要调节剂fur的主要UMP化位点。CRISPR-B™技术是源井基于Red/ET重组系统和CRISPR/Cas9基因编辑系统,通过优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可实现大肠杆菌/沙门氏菌/铜绿假单胞菌的无痕基因编辑,且应用范围广泛,包括基因敲除,基因点突变和基因敲入;现在低至6880即可实现定制服务,更多详情欢迎点击了解>>
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划



























