CRISPR基因编辑乳腺癌治疗可能改变现代医学的面貌

CRISPR基因编辑乳腺癌治疗可能改变现代医学的面貌
小鼠乳腺癌细胞系4T1被广泛用作人乳腺癌的同源肿瘤模型,而人乳腺癌是世界范围内发病率最高的肿瘤实体。4T1细胞很容易移植到乳腺中,它们免疫原性差,致瘤性高,侵袭性强,且可以自发转移到远处器官。因此,原发肿瘤的位置及其转移扩散与患者的临床病程非常相似。此外,4T1细胞常用于研究雌激素受体(ER),孕激素受体(PgR)和表皮生长因子受体2(ErbB2)蛋白表达缺陷的三阴性乳腺癌(TNBC)。据估计,这种三阴性表型在每年确诊的乳腺癌患者中占比超过17%。早期的研究报道称,接种EMT6疫苗的小鼠显然比接种4T1疫苗的小鼠表现出更高的保护免疫力。混合疫苗接种研究显示,4T1疫苗接种引起局部和全身免疫损伤,因此在评估新的治疗方法时,4T1是最受欢迎的同源肿瘤模型之一。
乳腺癌是美国女性的第二大常见死因。大多数乳腺癌死亡是由于乳腺癌从原发部位复发并转移到身体其他部位。乳腺癌通常转移到肺,肝,脑,淋巴结和骨骼。由于一个模型不能适用于所有的研究,根据研究性质,不同类型的小鼠模型会被用来模拟乳腺癌的自然过程。这些模型包括组织或细胞接种、异位移植、异种移植、皮下移植、原位移植和心脏内移植
研究人员选择4T1细胞系是因为其具有的几个特点能使其适用于细胞模型以及人类癌症动物模型的实验。与其他癌细胞系相比,它的优点是与人乳腺癌中的肿瘤生长和转移非常相似。迄今为止,大多数基因组编辑研究旨在通过培养细胞和动物模型更好地了解疾病,而科学家们则努力衡量这些方法用于人类的安全性和有效性。基因组编辑和生物标志物测试开启了患者量身定制疗法的大门,这些疗法将带来不一样的结果并挽救生命。这是乳腺癌治疗的未来。CRISPR/Cas9基因组编辑技术为乳腺癌基因/细胞治疗领域带来了宝贵的机会,可能在乳腺癌治疗中发挥关键作用。
应用
1. 多组学研究:基因组学,转录组学,蛋白质组学和免疫组学。
2. 癌症复发:确定癌症复发相关基因,相互作用网络,下游研究和肿瘤复发的预防措施。
3. 基因发现:识别新的癌症驱动基因,发现癌症特异性弱点。
4. 癌症疫苗:自体肿瘤细胞疫苗(ATCV),肿瘤来源细胞因子,ATCV免疫原性,免疫抑制细胞因子,基于癌细胞的疫苗等。用于治疗用癌症疫苗或预防性癌症疫苗的基因编辑肿瘤细胞的研究。
5. 药物发现:新的治疗弱点和更有效治疗的发展
6. 疾病建模:同种异体移植和异种移植疾病建模,疾病进展和机制研究。
CRISPR/Cas9基因编辑4T1细胞
基因组编辑是精确修饰基因内的核苷酸序列以加入或删除特定DNA片段的过程。CRISPR/Cas9可以纠正基因组中的错误,并且快速,廉价且相对容易地启动或终止细胞和生物体中的某些基因。4T1细胞是小鼠癌细胞系模型,广泛用作人乳腺癌研究的同基因肿瘤模型(耐药基因,化疗耐药基因,药物发现,疾病机制、发病、发展和治疗)。基因编辑可以在细胞中产生单个或多个基因敲除,校正突变或插入报告基因转基因。这些基因编辑4T1细胞系可以帮助研究人员研究乳腺癌标志,药物抗性机制揭示,以及癌症治疗,细胞死亡研究,功能基因组学,信号通路,药物发现,药物反应和细胞治疗。CRISPR/Cas9技术积极推动乳腺癌体内和体外基因编辑的进步,解决乳腺癌转移,耐药,化疗耐药的复杂性,对精准医学产生巨大影响。
案例分析:CRISPR/Cas9介导的乳腺癌研究显示内源性PAD4通过细胞外染色质形成促进肺转移
在美国,乳腺癌是最常见的癌症之一,也是美国女性中癌症死亡的第二大原因。随着原发肿瘤的侵袭性增长,乳腺癌死亡的主要原因是乳腺癌转移到身体其他部位。由于异质性和缺乏明确的分子靶点,转移性乳腺癌患者的5年生存率比较低,寻找限制转移的方法仍然是一个巨大的挑战。病理研究发现,PAD4在结肠、十二指肠、食管、输卵管、胆囊、肺、卵巢、腮腺、胰腺、前列腺、直肠、小肠、胃、甲状腺、子宫等多种肿瘤组织中均有显著表达。肽基精氨酸脱亚胺酶4(PAD4/PADI4)是一种翻译后修饰酶,可以将蛋白质精氨酸或单甲基精氨酸转化为瓜氨酸。
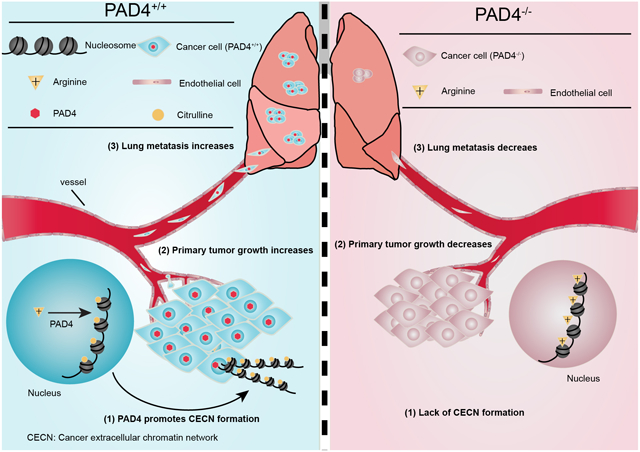
Overview of PAD4 mediated Lung metastasis
PAD4介导的肺转移概述
为了确定PAD4表达是否与人类乳腺癌相关,研究人员查找了TCGA癌症基因组图谱数据库和Oncomine数据库。在对基因表达谱进行meta分析后,他们发现与正常组相比,PAD4的表达量的升高与乳腺癌显著相关(图1A)。为了研究PAD4在乳腺癌中的功能作用,他们发现高转移性乳腺癌4T1细胞中PAD4的表达水平远高于其他癌细胞系(图1B)。他们量化了4T1细胞中PADI4的量,发现5 × 104 细胞中的PADI4蛋白与100ng的纯化PAD4蛋白大致相当,相当于每个细胞约有1600万个PAD4蛋白(图1C)。
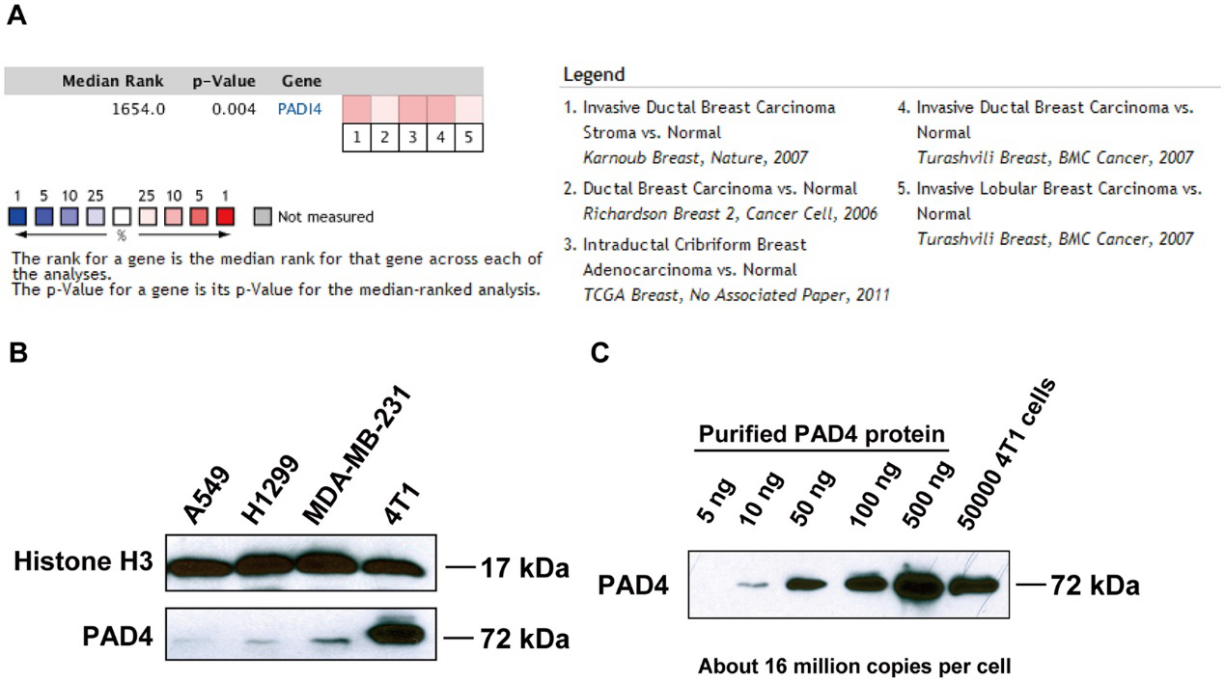
图1:PAD4在人和小鼠乳腺肿瘤中的表达
PAD4是一种钙依赖性酶。因此,他们在钙离子载体处理后进行蛋白质印迹 Western blot实验,发现钙离子载体处理后用H3Cit抗体(针对含有Cit2,Cit8和Cit17的组蛋白H3 N-末端肽制备)检测到的组蛋白H3瓜氨酸化显著增加(图2A)。为了测试组蛋白瓜氨酸化是如何影响染色质结构的,他们通过免疫染色分析了细胞形态,发现染色质高度解稠密区H3Cit染色显著增加(图2B)。他们分别用α-H3Cit26(图2C和2D)和α-H4Cit3抗体(图2E和2F)测试了两个位置的瓜氨酸化水平。为了进一步证实细胞外染色质结构的存在,将钙离子载体处理过和未处理的完整4T1细胞用MNase消化,MNase是一种切割染色质中核小体之间的核酸酶(图2G)。因此,组蛋白H3蛋白只能在钙离子载体处理过的4T1细胞的上清液中检测到(图2H)。同时,他们发现在4T1细胞暴露于HMGB1后,细胞外DNA和H3Cit染色轻度增加,表明HMGB1能够诱导4T1细胞的CECN(图2I和2J)。
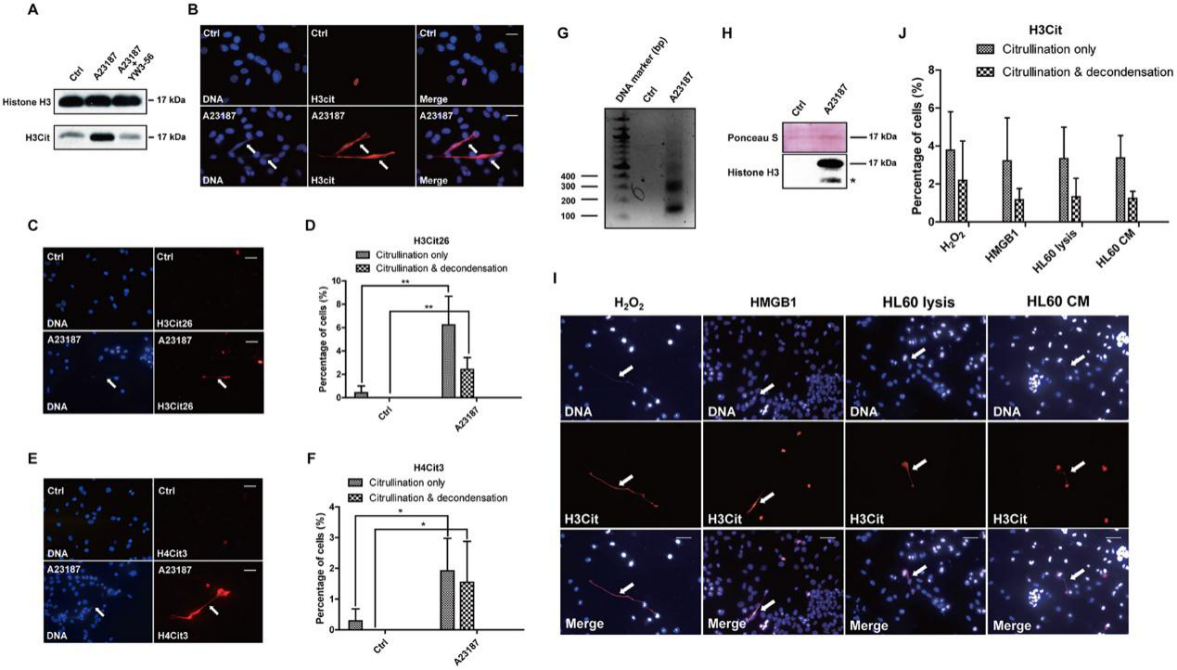
图2:PADI4的激活导致体外4T1细胞中的过度瓜氨酸化和CECN形成
研究人员发现抑制PAD降低了高瓜氨酸化的发生率和CECN的释放(图3A)(图3A)。他们使用CRISPR/Cas9方法敲除了肿瘤细胞中的Padi4,并选择了两个单细胞克隆,分别命名为Padi4 CRISPR-Ex1-1-C11和Padi4 CRISPR-Ex2-6-E2,其中Padi4缺失发生在1号和2号外显子上。通过Sanger测序和蛋白质印迹实验验证Padi4的缺失(图3B和3C)。钙离子载体刺激后未检测到瓜氨酸化和CECN的形成(图3D)。结果表明,组蛋白高瓜氨酸化和CECN形成依赖于PAD4活性。
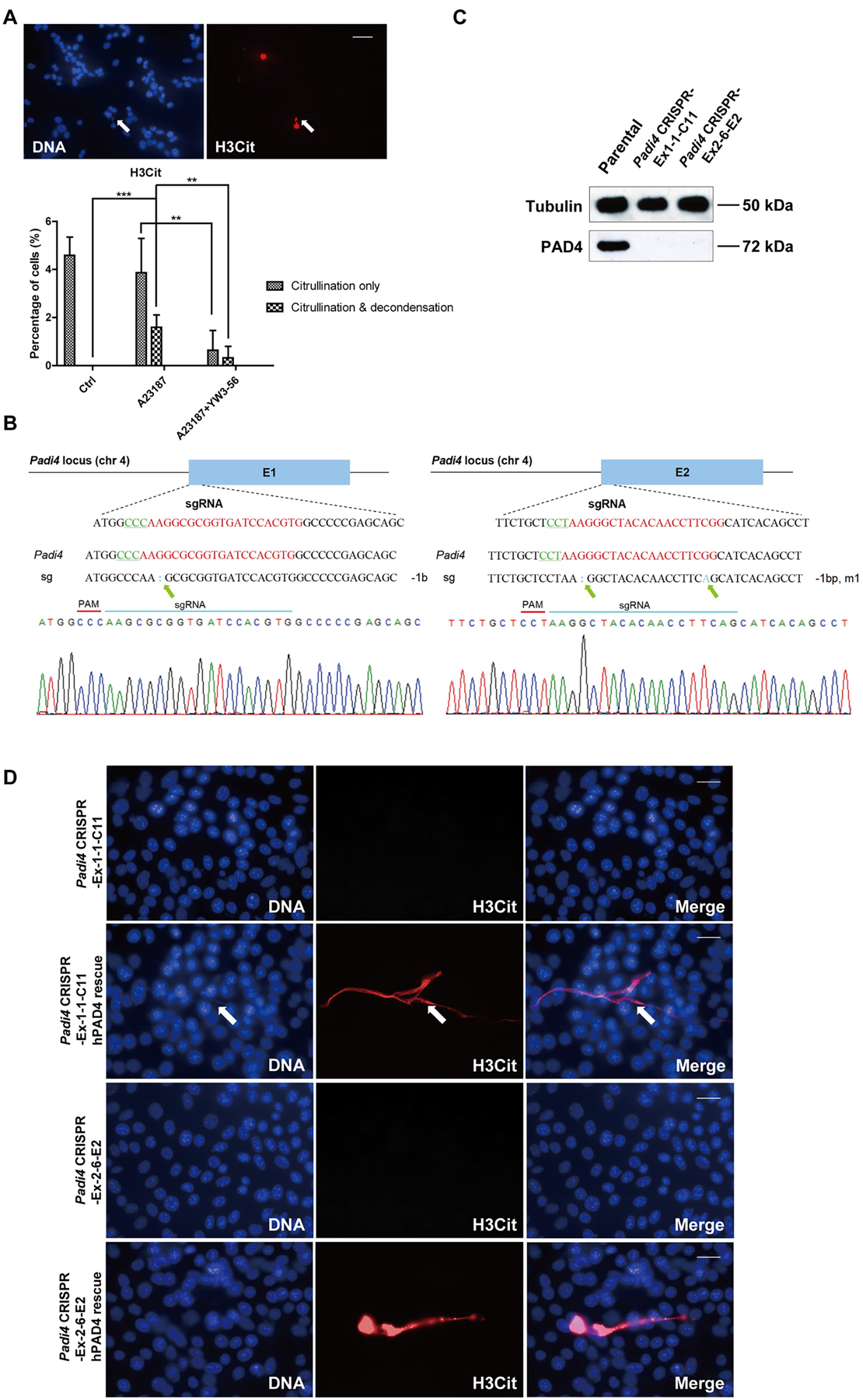
图3:CECN的形成取决于PAD4
为了研究4T1细胞是否可以在体内释放CECN,他们比较了原位移植且大小匹配的4T1野生型和Padi4敲除肿瘤的瓜氨酸化水平,仅在亲代细胞系和亲代肿瘤中检测到PAD4(图4A)。为了测试高瓜氨酸化是否导致染色质解浓缩(如图4B所示),研究人员通过免疫染色检测潜在的CECN结构(图4C)。BALB/c Padi4敲除小鼠移植肿瘤的H&E染色和免疫染色实验如图4 - 4F所示。原发肿瘤中的H3Cit染色是基于区域的并且具有不同的染色模式,其中一些区域为H3Cit染色阳性而另一些区域为阴性(图4G)。这可能是由于肿瘤微环境的异质性导致,存在不同水平的ROS或死亡细胞数量。
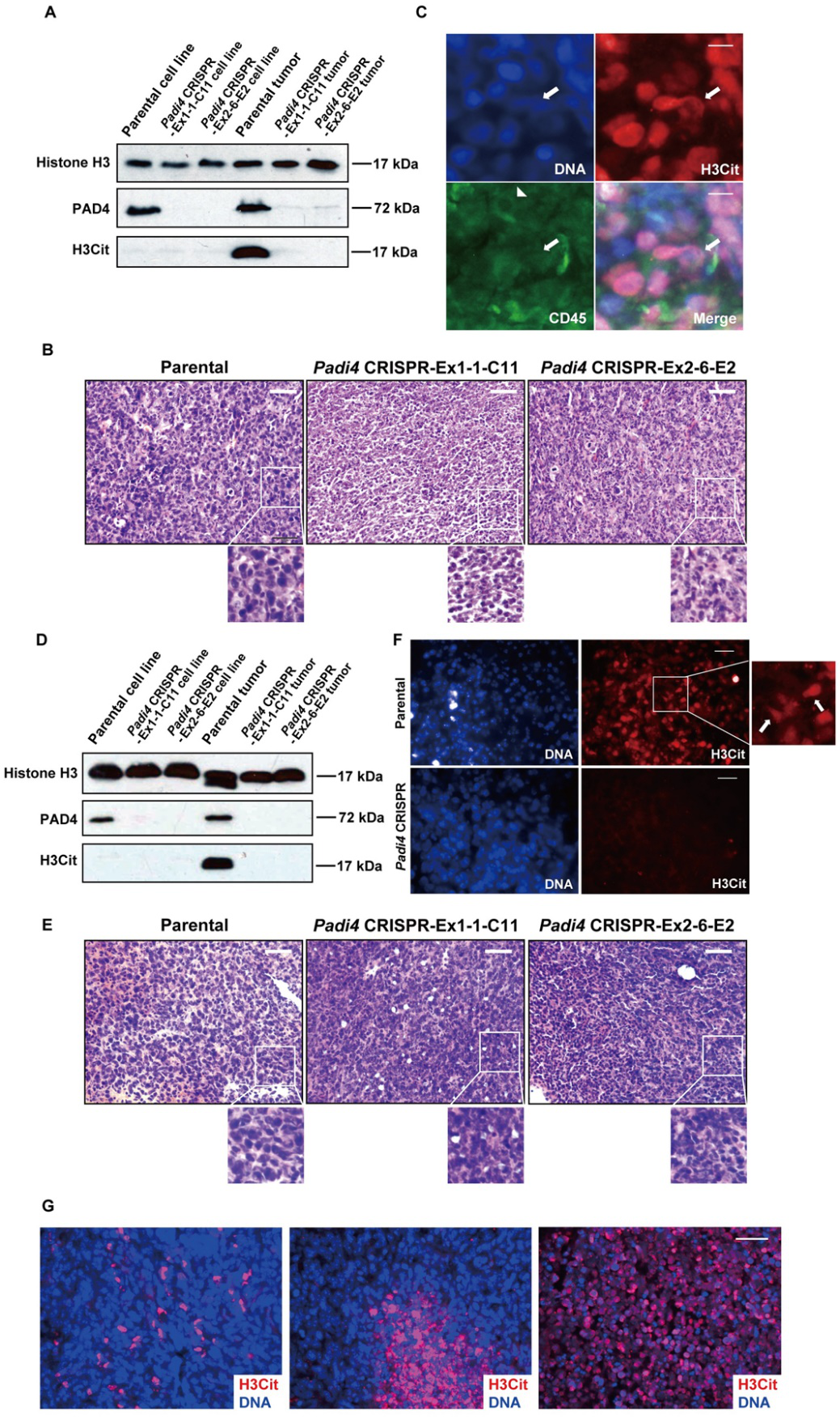
图4:CECN存在于同种异体移植肿瘤中
为了评估PAD4在肿瘤生长和转移中的细胞自主作用,研究人员将4T1野生型和Padi4敲除细胞分别移植到野生型雌性BALB/c小鼠的乳腺中。尽管所有4T1细胞类型显示出相似程度的体外生长速率(图5A),但在野生型BALB/c小鼠中,同种异体移植Padi4敲除肿瘤的生长明显比野生型4T1肿瘤更慢(图5B)。在Padi4敲除的BALB/c小鼠中也观察到Padi4敲除肿瘤的生长速率降低(图5C)。类似地,肿瘤内PAD4抑制剂治疗也降低了原发性肿瘤生长速率(图5D)。
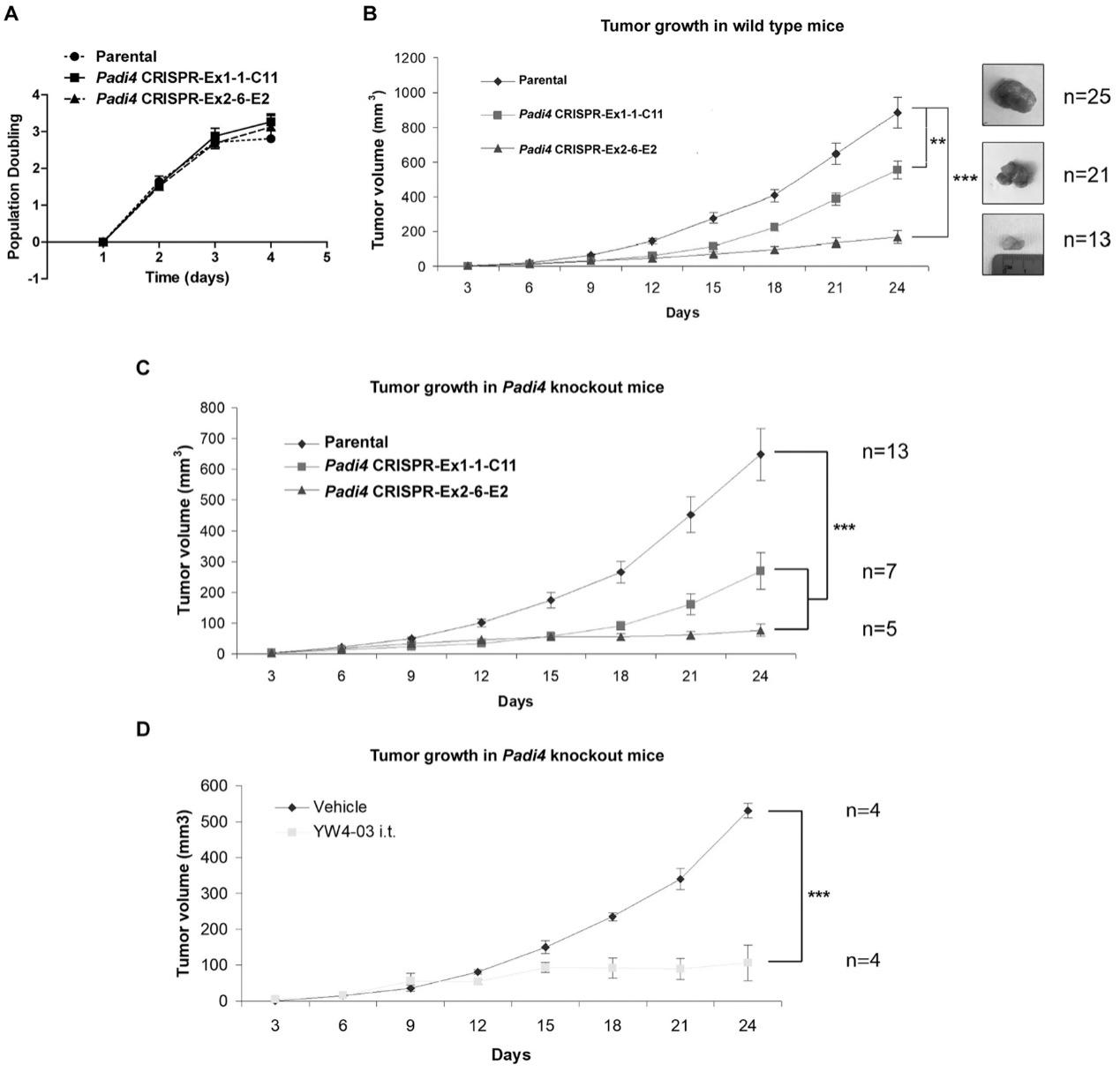
图5:不同Padi4基因型的4T1细胞或联合YW4-03治疗形成的原发性乳腺肿瘤的生长速度。
与来自相同小鼠肿瘤但不能转移的同胞细胞系67NR相比,4T1细胞具有更高的转移能力。如图6A所示,与67NR细胞相比,4T1细胞中的PAD4表达水平明显更高。同种异体移植后,携带野生型肿瘤的小鼠在肺表面形成的转移灶数量显着高于两种Padi4敲除细胞系(图6B和6C)。在携带Padi4 CRISPR基因编辑癌细胞的小鼠肿瘤中,即使在长时间生长后,肺转移仍显著减少(图6D-6F)。长时间生长之后,携带源自Padi4敲除癌细胞的肿瘤的小鼠的肺转移仍显着降低(图6D-6F)。为了检验PADI4抑制在群体水平上的影响,研究人员还使用PADI4基因敲除小鼠在YW4-03肿瘤内治疗模型中比较了肺转移(图6G和6H)。
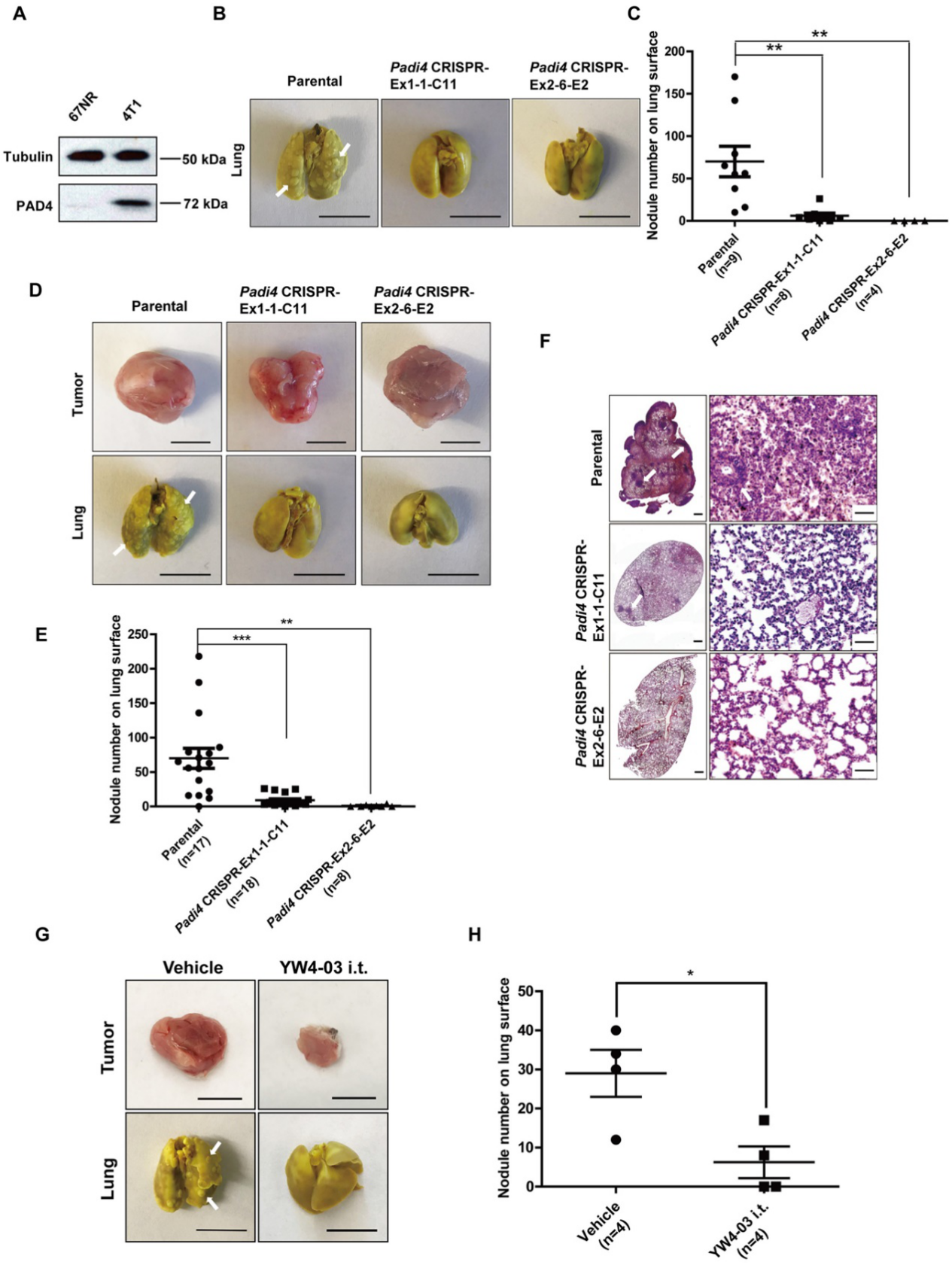
图6:肿瘤中缺乏PAD4导致肺转移减少
为了进一步验证CECNs参与转移的想法,他们使用DNase I破坏细胞外DNA,包括在Padi4敲除小鼠中生长的4T1野生型肿瘤中的CECN结构,发现肺转移显着减少(图7A和7B)。此外,通过用集落形成测定分析血液中的循环肿瘤细胞(CTC),测试在癌细胞中表达的PAD4是否影响血管内渗透。Padi4缺失和DNase I处理都不影响大小匹配的荷瘤小鼠的CTC数量,表明癌细胞内源性PAD4不通过内渗过程来促进转移(图7C-7F)。为了进一步测试PADI4是否在血管内渗透后的步骤中起作用,他们通过将相同数量的肿瘤细胞通过静脉注射到小鼠中来进行实验性转移测定。与Padi4野生型细胞相比,4T1细胞中Padi4的缺失并未显着减少累积的癌细胞数量(图7G和7H)。
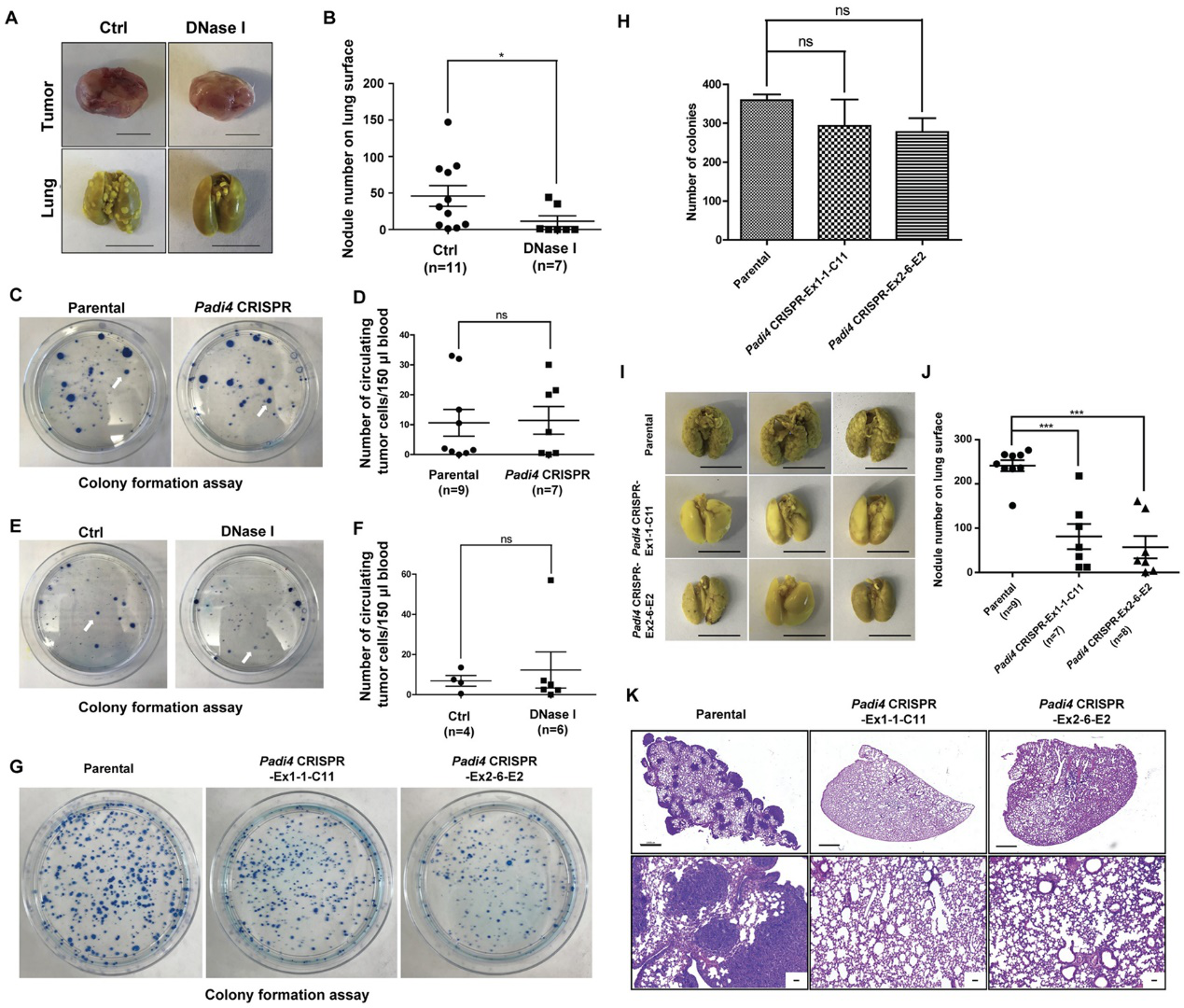
图7:癌细胞内源性PAD4通过血管内渗透后的步骤促进转移
综上所述,研究人员在体外和体内确定了4T1细胞中PADI4介导的CECN的发生。肿瘤微环境含有激活PADI4的信号,并且在4T1细胞中敲除PADI4或去除细胞外DNA(包括用DNase I去除CECN), 可以抑制转移性肺定植。PAD4在促进肿瘤生长和转移中的重要作用使其成为切实的治疗手段。
源井生物作为一家专注于细胞基因编辑的企业,目前已利用独家CRISPR技术——CRISPR-UTM对4T1细胞进行了基因编辑,构建了多种4T1细胞现货:基因敲除4T1细胞、4T1-Cas9细胞系、4T1-Luc细胞系、4T1-mCherry-EGFP等(见下表),可为乳腺癌研究提供丰沛的资源和服务,低至2560元,快至1周交付。还有近3000种KO细胞现货在库,覆盖8大信号通路和40种疾病,点击入库搜索KO细胞 >>
除此之外,我们还可在全球范围内提供优质的基因编辑细胞(敲除、敲入、点突变)、稳转细胞株、病毒包装等相关服务,了解更多详情欢迎咨询我们!










