【引文选集】看基因敲除细胞如何带你披荆斩“疾”!


【引文选集】看基因敲除细胞如何带你披荆斩“疾”!

源井生物专注于细胞基因编辑研发与生产,拥有近3000平方的基因编辑技术平台、细胞生物学平台以及抗体验证平台,目前已为全球超30个国家的科研单位和工业客户提供技术服务与产品。
凭借独家CRISPR-U™专利技术,源井生物将传统的CRISPR/Cas9编辑效率提高至10倍以上,并以此为基础开展了红棉基因敲除计划,建成拥有3500多例基因敲除细胞的基因编辑细胞库,并计划于2024年扩增至5000例。
源井基因敲除细胞库拥有覆盖26条信号通路、5大类药物靶点,27种疾病类型等3500+ko现货,1周交付纯合克隆,还可提供基因敲除细胞定制服务!如您需要基因敲除相关服务或产品,请联系我们>>>
KO细胞通常被应用于研究基因功能、疾病发生机制和药物筛选等方面。以下精选了9篇采用源井生物所提供的基因敲除细胞系助力疾病研究的相关文章,希望对您的研究有所启发。
目录
① Hep G2细胞敲除SNORD17基因——肝细胞癌IF=15.8
③ RAW264.7细胞敲除Pik3r1——骨质疏松IF=11.4
④ 小鼠MC38和CT26细胞敲除TNFR2——结肠癌IF=10.75
⑦ 293T敲除AM122A、PP5、DNA-PK——癌症治疗IF=5.0
⑧ RAW264.7敲除HIF-1α——骨质疏松IF=4.63
⑨ NIH-3T3敲除TSC2——结节性硬化症IF=2.99
期刊:cell death & differentiation,IF=15.8
标题:Non-coding small nucleolar RNA SNORD17 promotes the progression of hepatocellular carcinoma through a positive feedback loop upon p53 inactivation
单位:同济医院肝脏外科中心
摘要:该研究构揭示了小核仁RNA SNORD17和p53信号通路在肝细胞癌的中的调控作用,为肝细胞癌的治疗提供了一个新的潜在靶点。源井生物为本研究提供关键细胞模型:SNORD17基因敲除的Hep G2细胞,通过体外和体内实验表明,在HCC细胞系敲除SNORD17基因可显著抑制细胞增殖、克隆形成和G1/S期转变[1]。
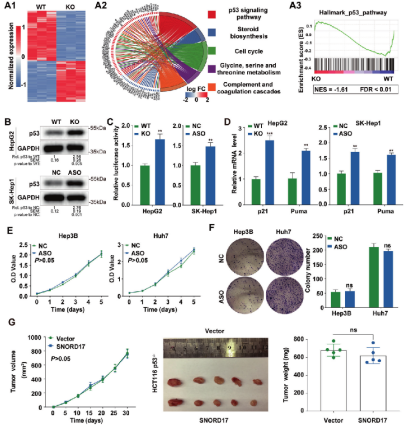
图1 p53介导SNORD17对HCC细胞生长的影响
期刊:Small,IF=13.30
标题:Silica Nanoparticles Trigger Chaperone HSPB8-Assisted Selective Autophagy via TFEB Activation in Hepatocytes
单位:首都医科大学
摘要:二氧化硅纳米颗粒(SiNPs)是最常见的无机纳米材料之一,自噬是对纳米颗粒的主要生物反应。该文章利用源井生物构建的TFEB敲除的L-02肝细胞系,验证TFEB参与SiNPs诱导的自噬,通过RNA测序比较野生型和TFEB 基因敲除细胞的转录组,证明(SiNPs) 是通过TFEB激活肝细胞触发Hspb8辅助的选择性自噬[2]。
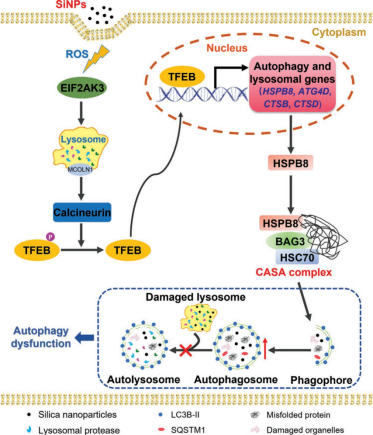
图2 SiNPs诱导CASA机制图解
期刊:Redox Biology,IF=11.4
标题:GSTP1-mediated S-glutathionylation of Pik3r1 is a redox hub that inhibits osteoclastogenesis through regulating autophagic flux
单位:浙江大学附属医院骨科研究中心
摘要:该文章通过源井生物构建的Pik3r1基因RAW264.7细胞敲除模型,结合大量的体内外实验探索了GSTP1重塑破骨细胞相关骨稳态的一种全新机制,第一次诠释了破骨细胞的细胞命运是由GSTP1介导的氧化还原相关的翻译后修饰-自噬流级联轴来决定的[3]。
期刊:Int. J. Biol. Sci.,IF=10.75
标题:TNFR2 deficiency impairs the growth of mouse colon cancer
单位:澳门大学
摘要:该研究采用由源井生物提供的TNFR2基因敲除的MC38和CT26结肠癌细胞,证明了TNFR2缺失会抑制AKT信号通路,提供了进一步的实验证据来支持阻断TNFR2可能代表癌症免疫治疗新策略的观点,为开发TNFR2拮抗剂治疗癌症提供了进一步的证据[4]。
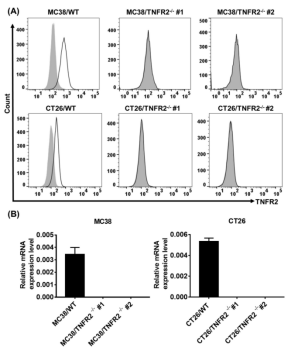
图3使用CRISPR/Cas9构建和鉴定TNFR2基因敲除的MC38和CT26结肠癌细胞。(A) 流式细胞术分析(B)实时荧光定量分析
期刊:Cell Reports,IF=8.8
标题:Delicate regulation of IL-1β-mediated inflammation by cyclophilin A
单位:中国科学院
摘要:该文章就CypA在炎症激活、消退以及组织修复过程中的作用及机制进行了深入探讨,实验采用源井生物构建的PPIA敲除的THP-1模型,通过LPS、免疫印迹,磷酸化等实验,证明在LPS诱导的炎症小鼠模型中,CypA主要通过调节IL-1β的表达量来控制其在炎症不同阶段中的作用[5]。
期刊:BMC Biology,IF=7.36
标题:CCHCR1-astrin interaction promotes centriole duplication through recruitment of CEP72
单位:深圳大学
摘要:为了验证HCR蛋白与中心体和有丝分裂相关蛋白互作之间的关系,该文章以HCR和astrin分别敲除的Hela细胞系作为研究材料(astrin敲除的Hela细胞系由源井生物提供),HCR或astrin的缺失将显著降低CEP72和随后的MCPH蛋白的中心体定位;而HCR的缺失将导致中心粒复制缺陷、有丝分裂错误,以及多极纺锤体形成、基因组不稳定和DNA损伤等。由此揭示出HCR通过与astrin互作,可确保有效的中心体复制和其他中心体相关功能稳定(见图4)。该发现为HCR的分子功能提供了更深入的了解,有助于更好地探索HCR在银屑病和其他疾病中的作用[6]。
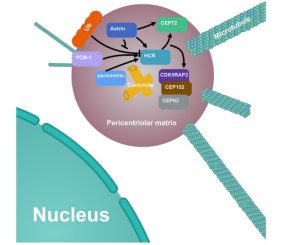
图4 HCR及其相关蛋白在中心体上的定位及调控关系
⑦ 293T敲除AM122A、PP5、DNA-PK——癌症治疗
期刊:Journal of Biological Chemistry,IF=5.0
标题:Phosphatases maintain low catalytic activity of SGK1: DNA damage resets the balance in favor of phosphorylation
单位:清华大学医学院Cecilia Canessa课题组
摘要:文章采用源井生物提供的FAM122A、PP5和DNA-PK基因敲除的293T细胞,实验发现SGK1的活性受到S/T磷酸酶PP5和PP2A的作用的抑制,PP5和PP2A不断使SGK1去磷酸化。该研究结果提供了一种分子途径,它使SGK1获得磷酸化和催化活性,并促进细胞存活,该发现可能对开发靶向SGK1的新型癌症疗法具有重要意义[7]。
期刊:Bone,IF=4.63
标题: HIF-1α mediates osteoclast-induced disuse osteoporosis via cytoophidia in the femur of mice
单位:同济大学附属口腔医院
摘要:研究采用源井生物构建的敲除HIF-1α基因的RAW264.7细胞,发现敲除该基因可以改善小梁骨中的破骨细胞骨吸收,揭示了HIF-1α基因在支持破骨细胞发生和骨吸收中的新作用,并为其参与骨质疏松症发病中的作用提供了直接证据[8]。
期刊:Cell Biochemistry and Biophysics,IF=2.99
标题: Construction of TSC2 knockout cell line using CRISPR/Cas9 system and demonstration of its effects on NIH-3T3 cells
单位:北京协和医院
摘要:TSC2基因在结节性硬化症(TSC)的发生发展中起重要作用,该研究利用源井生物构建的TSC2基因敲除的NIH-3T3现货细胞系,发现敲除TSC2可增强NIH-3T3细胞的增殖和侵袭。此外,基因敲除细胞系可以模拟TSC患者的药理学特征,可作为进一步研究TSC的有效工具[9]。
源井生物致力于为全球科研人员提供更多基因编辑细胞模型,助力疾病机制、疾病诊断、药物研发和基因治疗等研究,为人类医学发展添砖加瓦!
[1]Liang, J., Li, G., Liao, J. et al. Non-coding small nucleolar RNA SNORD17 promotes the progression of hepatocellular carcinoma through a positive feedback loop upon p53 inactivation. Cell Death Differ 29, 988–1003 (2022).
[2]Zhu Y, Zhang Y, Fan Z, et al. Silica Nanoparticles Trigger Chaperone HSPB8‐Assisted Selective Autophagy via TFEB Activation in Hepatocytes[J]. Small, 2023, 19(5): 2204310.
[3]Ji X, Hong J, Yang W, et al. GSTP1-mediated S-glutathionylation of Pik3r1 is a redox hub that inhibits osteoclastogenesis through regulating autophagic flux[J]. Redox Biology, 2023, 61: 102635.
[4]Li P, Yang Y, Yang X, et al. TNFR2 deficiency impairs the growth of mouse colon cancer[J]. International Journal of Biological Sciences, 2023, 19(4): 1024.
[5]Yang W, Bai X, Luan X, et al. Delicate regulation of IL-1β-mediated inflammation by cyclophilin A[J]. Cell reports, 2022, 38(11).
[6]Ying Z, Wang K, Wu J, et al. CCHCR1-astrin interaction promotes centriole duplication through recruitment of CEP72[J]. BMC biology, 2022, 20(1): 1-21.
[7]Gu W, Zheng H, Canessa C M. Phosphatases maintain low catalytic activity of SGK1: DNA damage resets the balance in favor of phosphorylation[J]. Journal of Biological Chemistry, 2023: 104941.
[8]Bie M, Tang Y, Xia Y, et al. HIF-1α mediates osteoclast-induced disuse osteoporosis via cytoophidia in the femur of mice[J]. Bone, 2023, 168: 116648.
[9]Wang X, Zhao Y, Wang Z, et al. Construction of TSC2 knockout cell line using CRISPR/Cas9 system and demonstration of its effects on NIH-3T3 cells[J]. Cell Biochemistry and Biophysics, 2022, 80(4): 681-687.










