IF=14.9,源井生物慢病毒,助力头颈部鳞状细胞癌(HNSCC)研究取得新突破!


IF=14.9,源井生物慢病毒,助力头颈部鳞状细胞癌(HNSCC)研究取得新突破!

头颈部鳞状细胞癌(Head and Neck Squamous Cell Carcinoma,HNSCC)是指发生在头颈部多个解剖部位的鳞状细胞癌,发病率高,中晚期预后较差,吸烟、酒精依赖、HPV感染等都是其致癌因素。癌症干细胞(CSCs)在HNSCC的异质性、转移和治疗耐药中发挥着不可或缺的作用。
近日,武汉大学口腔医学院附属医院在International Journal of Oral Science(IF=14.9)发表了题为LIMP-2 enhances cancer stem-like cell properties by promoting autophagy-induced GSK3β degradation in head and neck squamous cell carcinoma的新文章,使用源井独家高滴度,高活力且稳定表达的慢病毒,结合大量实验,确定了LIMP-2基因是HNSCC进展的潜在调节因子,全面描述了LIMP-2促进HNSCC癌症进展的机制,揭示了自噬、CSCs和免疫治疗耐药性之间的联系。
如您有慢病毒实验需求,或想解放双手get稳转细胞株,赶快联系我们吧>>>
作者首先基于自噬-溶酶体途径的生信分析筛选了LIMP-2作为HNSCC研究的潜在调节因子,HNSCC组织中的LIMP-2表达量更高,且观察到LIMP-2在23种癌症中显著上调。通过免疫组织化学(IHC)染色研究了LIMP-2在HNSCC组织微阵列(TMA)中的表达,发现LIMP-2的表达量明显升高,且与病理分级、淋巴结转移和肿瘤大小呈正相关。而且,其在女性中表达量更高。同时发现LIMP-2的表达是影响HNSCC患者OS的独立危险因素(图1)。在多种癌症中,LIMP-2普遍与自噬相关基因呈正相关。
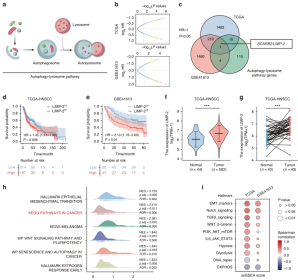
图1 生信分析表明LIMP-2是HNSCC的潜在调节因子
随后,作者构建了3个过表达/敲低的稳转小鼠细胞系,确定了LIMP-2在调控自噬、CSC中的潜在作用。
EZ-editor™系列产品—慢病毒包装试剂盒,采用第3代包装系统,独家质粒配比,操作简便,让基因编辑实验事半功倍!
为了研究LIMP-2调控自噬的具体机制,作者检测了自噬标志物LC3B-II和自噬底物p62/ SQSTM1的表达量。在LIMP-2敲低的4MOSC2细胞中,LC3B-II和p62的表达显著上调,而在LIMP-2过表达的4MOSC1细胞中,LC3B-II和p62的表达有所降低。然而,与阴性对照组相比,参与自噬体形成的关键分子ATG5和ATG7的表达水平没有显著改变。通过电子显微镜观察到在LIMP-2敲除后,癌细胞中自噬小体的积累增加。因此,推测这种现象可能是由于自噬通量受到抑制。为了进一步验证自噬通量是否被阻断,转染了mRFP-GFP-LC3质粒检测自噬通量。在LIMP-2敲低组中,自噬溶酶体和自噬小体的比率明显低于对照组,表明LIMP-2敲低后自噬通量受损。相反,在4MOSC1细胞中,异位的LIMP-2表达量增加了自噬溶酶体和自噬小体的比率。
之后,作者又探究了LIMP-2对HNSCC致瘤性的影响。与对照相比,敲低LIMP-2的HNSCC细胞的活力和克隆生成能力都明显降低,细胞数量明显下调,在4MOSC2和SCC7同种异体移植模型中,LIMP-2敲低显著抑制肿瘤生长(图2)。
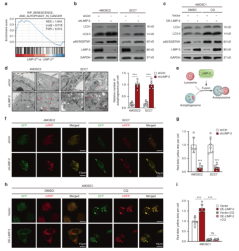
图2 LIMP-2通过参与自噬酶体的形成来促进HNSCC的自噬
体外和体内实验结果结合患者标本分析表明,LIMP-2可促进HNSCC的自噬、干细胞特性。靶向自噬可以有效地抑制CSCs在HNSCC中的侵袭性。LIMP-2过表达增加了CSCs相关标志物的表达,这些标志物在4MOSC1细胞中被氯喹(CQ)显著抑制,证实了CQ抑制过表达LIMP-2的4MOSC1细胞的肿瘤形成能力。这些结果表明自噬参与了LIMP-2驱动的HNSCC恶性表型。
接下来,作者在LIMP-2过表达的4MOSC1细胞中进一步敲低β-catenin,显著抑制了LIMP-2过表达诱导的CSCs相关标志物的表达增强。在集落形成和肿瘤球形成实验中也观察到类似的结果。在4MOSC2原位HNSCC小鼠模型中,LIMP-2的敲低导致β-catenin的表达降低,GSK3β的表达升高,且低表达LIMP-2的患者标本往往具有较低的β-catenin表达和较高的GSK3β表达(图3)。综上,LIMP-2通过激活GSK3β/β-catenin信号通路调节HNSCC细胞的干细胞潜能。
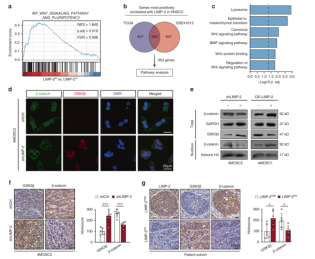
图3 LIMP-2通过激活GSK3β/β-catenin通路发挥致癌作用
在Wnt/β-catenin信号激活的情况下,GSK3β被隔离在晚期核内体的管腔内,并被溶酶体降解。最近的研究结果表明,自噬参与GSK3β的降解以维持β-catenin的高表达,这表明自噬可能与Wnt信号通路有关。考虑到LIMP-2在自噬-溶酶体途径中的功能作用,作者推断LIMP-2调节GSK3β降解。环己亚胺(CHX)实验表明,在LIMP-2敲低的情况下,GSK3β的降解被延迟。相反,过表达的LIMP-2显著降低了GSK3β的半衰期。这些结果表明,LIMP-2加速了GSK3β的降解。
最近的研究表明,靶向CSCs可提高免疫治疗的有效性,为了进一步评估LIMP-2对免疫治疗潜在疗效的影响,作者使用TIDE算法对TCGA数据库进行了评估。LIMP-2低表达组的TIDE评分明显低于LIMP-2高表达亚组,这表明LIMP-2低表达患者比LIMP-2高表达患者更容易受益于免疫检查点抑制剂(ICI)治疗。进一步使用4MOSC2模型来测试LIMP-2敲除与αPD-1治疗的潜在联合疗效发现,αPD-1治疗后,LIMP-2敲低株的肿瘤生长明显受到抑制。这些发现表明靶向LIMP-2可以克服αPD-1治疗耐药,提高免疫治疗效果(图4)。因此,LIMP-2可能是预测患者对PD-1阻断治疗反应的可靠生物标志物,可为临床干预提供精确指导。
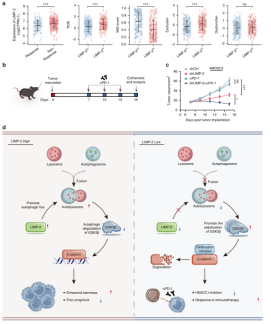
图4 敲低LIMP-2可改善免疫治疗反应
头颈部鳞状细胞癌的治疗仍然面临着高复发率和高死亡率的挑战,与癌症干细胞密切相关,作者发现了LIMP-2在促进HNSCC干细胞形成中的新作用。LIMP-2通过自噬降解GSK3β来促进HNSCC细胞的CSC特性。LIMP-2是HNSCC的一个独立的不良预后因素。LIMP-2表达量升高有利于维持CSC表型,这意味着HNSCC的免疫治疗耐药性增加。这项研究揭示了令人信服的证据,证明了LIMP-2作为HNSCC诊断和治疗的潜在关键作用。










