点突变细胞构建全攻略:4 种核心方法 + 应用场景深度解析


在基因编辑技术飞速发展的今天,点突变细胞构建已成为生命科学研究中不可或缺的核心技术。从解析单个碱基变异的分子机制,到模拟疾病病理状态、助力靶向药物研发与基因治疗转化,这项技术的应用贯穿基础科研与临床转化的全链条。小源今天就带你拆解点突变细胞的核心应用场景,详解 4 种常用构建方法的原理、实操关键与适用边界,帮你快速匹配最优实验方案
一、先了解:点突变细胞有哪些应用场景
点突变细胞 凭借精准模拟基因变异的特性,在多个研究领域发挥着不可替代的作用:
1.基础科研:解码基因功能的 “精准工具”
点突变细胞能精准且有针对性地呈现特定基因特定位点突变引发的分子和表型改变,可助力研究者明确基因功能与调控机制。
例如发表于《Cell》的一项研究,研究者建立了饱和诱变助力的功能方法 SMuRF,并用其对 α- 抗肌萎缩相关糖蛋白病的 FKRP 和 LARGE1 基因的所有单核苷酸突变进行功能打分。结果与临床遗传变异数据库匹配度高,还能反映疾病严重程度,为解析罕见病相关基因的突变功能提供了高效手段。
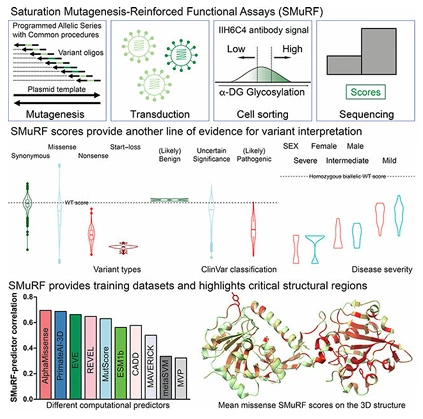
图1. 罕见病相关基因功能解析
2.疾病研究:复刻病理状态的 “细胞模型”
多数单基因病、肿瘤等疾病与特定基因点突变紧密相关。点突变细胞可高度模拟这类疾病对应的病理细胞状态,像模拟囊性纤维化 CFTR 基因点突变的细胞,能直观展现该突变导致的蛋白功能异常;而且像 PIK3CA、K - ras 等基因的点突变细胞,还能作为癌症相关标志物载体,为疾病致病机制解析、早期诊断指标筛选等提供稳定的细胞模型。
一项针对 CFTR 基因 L227R 和 N1303K 点突变的研究,利用先导编辑技术校正 HEK293T、16HBE 细胞系及患者来源直肠类器官的突变后,CFTR 蛋白的糖基化、定位和离子通道功能均显著恢复,为囊性纤维化病理研究提供了关键数据。
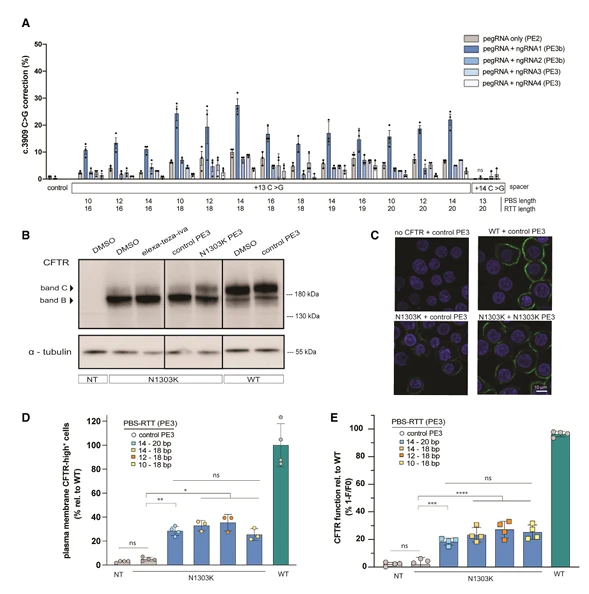
图2. 囊性纤维化致病突变特征研究
3.药物研发:筛选与验证的 “高效平台”
点突变细胞可快速验证药物靶点的有效性,比如构建特定靶点的点突变体,能筛选出对该靶点有高选择性的小分子抑制剂;同时它也能模拟患者体内耐药相关的基因突变,用于测试药物对突变型细胞的作用效果。
一项研究聚焦胰腺癌中 TP53 基因的常见耐药相关突变 R175H,在携带 KRAS 基因突变的永生化胰腺导管上皮细胞中,通过慢病毒系统构建并表达了 TP53 R175H 突变体,模拟患者体内该耐药基因突变的细胞环境。之后测试相关靶向药物对该突变细胞的抑制效果,发现突变蛋白可诱导热休克蛋白 HSP70 表达并与之结合,维持促癌通路激活以促进癌细胞增殖。同时通过药物干预实验,验证了针对 HSP70 等相关靶点的药物可减弱突变细胞的增殖能力,为胰腺癌耐药治疗提供了新靶点和实验依据。
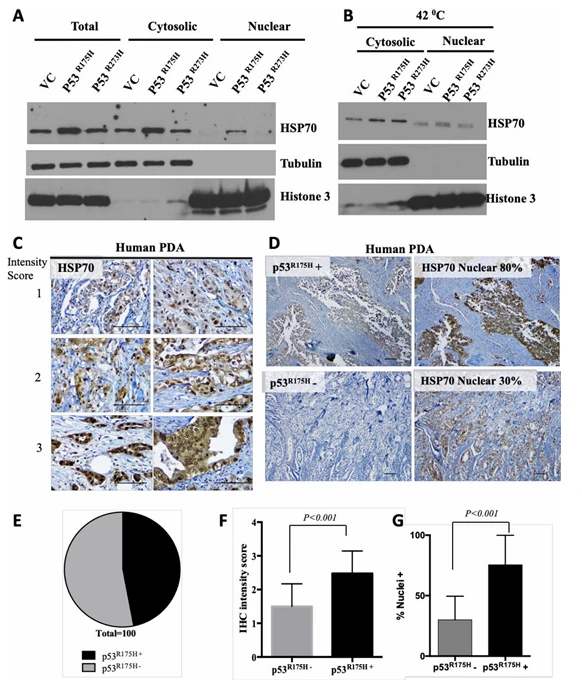
图3. 突变的 p53R175H 促进 HSP70 在细胞核中的积累并稳定其存在
4.基因治疗:临床转化的 “关键支撑”
众多遗传性疾病由基因点突变导致,点突变细胞既可为基因治疗提供验证模型,又能直接作为治疗相关的细胞材料。
通过先导编辑等技术校正囊性纤维化患者细胞中 CFTR 基因的点突变,可恢复相关蛋白功能;同时校正后的诱导多能干细胞还能分化为病变相关细胞,验证治疗方案的有效性与安全性,为基因治疗的临床转化提供关键支撑。

图4. 囊性纤维化无义突变校正
二、点突变常用四种构建策略
基于多年基因编辑实操经验,小源系统整理了四种核心点突变细胞构建策略,从原理解读、关键构建步骤到各策略的核心优势逐一拆解,最后通过对比明确不同策略的适配场景,助力你精准选择最适合的方案,高效完成点突变细胞构建。
1. RNP 法
如果你想要一个流程简洁、成本较低且快速灵活的方法,小源推荐你使用RNP法。
原理解读
RNP 的全称是 RNA-Protein Complex(核糖核蛋白复合物),简单说就是把 sgRNA(向导 RNA,负责找目标位点)和 Cas9 蛋白在体外提前组装好,直接送进细胞。就像给细胞递了一把 “精准剪刀”,找到目标 DNA 后咔嚓剪断,再用提前准备好的 “修复模板”(含有点突变)把缺口补上,实现精准突变。
关键步骤
- 准备sgRNA、 Cas9蛋白以及“修复模板”: 设计 sgRNA(推荐使用 源井红棉·CRISPR基因编辑系统 ),和 Cas9 蛋白按比例混合,室温孵育形成稳定的 RNP 复合物;同时准备 “修复模板”(ssODN 或 dsDNA,含要引入的点突变)。
- 送编辑工具进细胞: 用电穿孔或脂质体把RNP和修复模板送进细胞。
- 挑出 “成功编辑” 的细胞: 如果模板带荧光标签,用流式细胞术分选荧光阳性细胞;再把这些细胞稀释到 96 孔板,继续培养挑单克隆。
- 验证成果: 4.提取单克隆细胞的 DNA,通过 PCR 和测序确认点突变是否成功整合。
RNP法的优势
- 无外源 DNA 整合风险,脱靶率相对较低;
- 作用快,Cas9 蛋白直接干活,不用等细胞转录翻译,周期短;
- sgRNA设计灵活,成本较低。
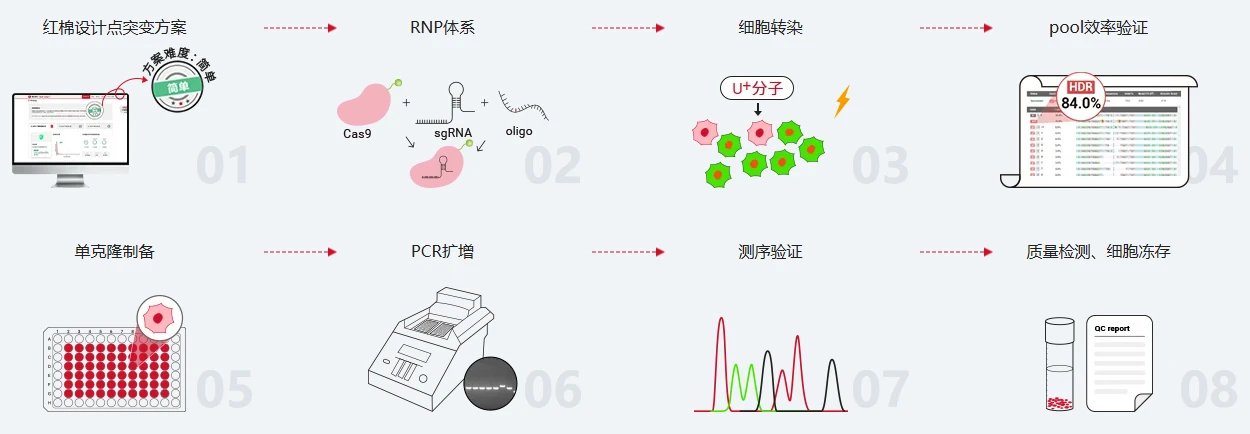
图5. RNP 法操作流程
2.单碱基编辑器Base Editing
如果你的实验目标是 “单碱基替换”(比如把 C 变成 T,或 A 变成 G),且担心双链 DNA 断裂带来的风险(比如细胞凋亡、随机插入缺失),那单碱基编辑器就是为你量身定制的工具。
原理解读
单碱基编辑器是个 “改造版工具”:把 Cas9 变成 “切口酶”(只能切一条链,不剪断双链),再融合一个 “脱氨酶”(负责修改碱基)。它不用剪断 DNA,而是让 sgRNA 带着编辑器找到目标碱基,脱氨酶直接把目标碱基 “涂改” 成想要的样子,全程没有双链断裂,精准度拉满。
关键步骤
- 选对编辑器 + 设计 sgRNA: 要改 C→T 就选 CBE(胞嘧啶碱基编辑器),改 A→G 就选 ABE(腺嘌呤碱基编辑器);sgRNA 要覆盖目标碱基,且目标碱基得在编辑器的 “编辑窗口”里。
- 转染与筛选: 把编辑器载体和 sgRNA 载体转进细胞(不用修复模板),通过荧光或抗性筛选阳性细胞。
- 单克隆与验证: 培养单克隆后,测序确认目标碱基是否成功替换。
单碱基编辑器法的优势
- 无双链断裂风险,对敏感细胞(如干细胞、神经细胞)友好;
- 编辑效率高,单碱基替换成功率比 HDR 法高;
- 不用准备修复模板,步骤更简单,尤其适合疾病相关的单核苷酸变异(SNV)模拟。
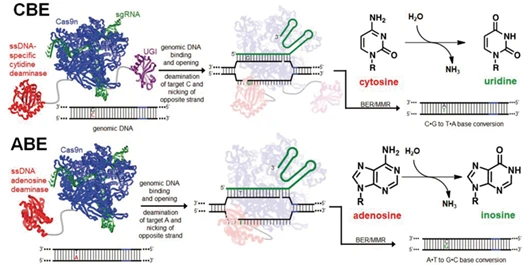
图6. CBE和ABE原理图
3.先导编辑器Prime Editing
如果你的实验需求更复杂 —— 比如不仅要改单碱基,还要插入小片段(≤40bp)或删除小片段(≤80bp),那先导编辑器就是目前最全能的选择,堪称基因编辑领域的 “瑞士军刀”。
原理解读
先导编辑器由 Cas9 切口酶和逆转录酶融合而成,核心靠 “pegRNA”(先导编辑向导 RNA)干活:pegRNA 不仅能找目标位点,还自带 “逆转录模板”(含有点突变或小片段序列)。找到目标后,Cas9 切一条链,逆转录酶根据模板合成含突变的序列,直接插入目标位点,全程没有双链断裂,且不用修复模板。
关键步骤
- 设计 pegRNA 和辅助 sgRNA: pegRNA 要包含 “引导序列”(找目标)和 “逆转录模板”(含突变);如果用 PE3 系统(效率更高),还要设计一个 “辅助 sgRNA”,切另一条链帮衬编辑。
- 转染细胞: 通常采用质粒转染(电转/脂质体)把载体送进细胞。
- 筛选与验证: 荧光或抗性筛选后养单克隆,测序确认突变 / 插入缺失是否精准。
先导编辑器的优势
- 编辑类型灵活,单碱基替换、小片段插入、小片段删除都能搞定;
- 精准度极高,脱靶率较低;
- 适用范围广,是基因治疗研究的热门工具。

图7. 先导编辑器的基本组成
4.质粒抗性法
如果你要突变的位点经是无法通过RNP或BE设计gRNA的复杂突变位点,小源推荐使用质粒抗性法。
原理解读
质粒抗性法是利用表达gRNA和Cas9的质粒 + 携带同源臂和抗性基因盒的供体质粒,实现同源重组,从而达到点突变的目的。供体中抗性基因通常嵌入内含子,由LoxP位点包裹,后期可通过Cre酶去除。最后通过抗生素筛选,大幅提升阳性克隆概率。
关键步骤
- 构建 “工具包” 质粒: 在目标基因内含子区域设计gRNA,设计左右同源臂(600–1000bp),再准备好Donor质粒。
- 转染细胞: 用脂质体把gRNA/Cas9质粒 + Donor质粒送进细胞。
- 抗生素筛选: 抗单克隆培养与验证生素筛选阳性克隆,再转染Cre表达质粒去除抗性基因盒。
- 单克隆培养与验证: 把存活的细胞稀释到 96 孔板养单克隆,最后通过PCR初筛和测序确认突变成功。
质粒抗性法的优势
- 筛选效率高,适用于低HDR背景细胞;
- 不依赖近端PAM位点设计,gRNA更灵活;
- 可构建复杂/低频点突变模型。
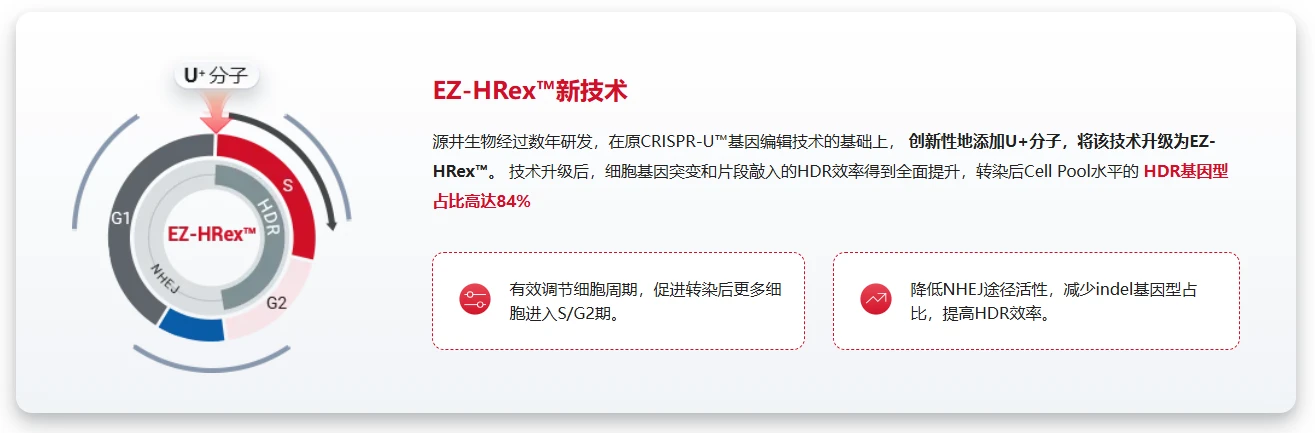
源井技术支持:EZ-HRex™技术
- 调节细胞周期,使转染后更多细胞停留在S/G2期
- 抑制NHEJ途径,HDR效率高达84%
- 适配所有四种构建策略
- 适合大规模突变模型构建/药筛/功能验证平台
4 种方法怎么选?一张表帮你快速决策
| 方法 | 核心优势 | 适合的编辑类型 | 推荐场景 |
| RNP 法 | 脱靶低、无 DNA 整合风险 | 常规点突变(如SNP) | 多数贴壁细胞、大多数突变 |
| 单碱基编辑器 | 无双链断裂、效率高 | 常规点突变(如SNP) | 单碱基突变、敏感细胞、SNV 模拟 |
| 先导编辑器 | 编辑灵活、精准度极高 | 碱基替换无法覆盖的突变(如插入/删除) | 复杂突变、基因治疗研究 |
| 质粒抗性法 | 适用于低HDR背景细胞 | 靶点无合适gRNA或效率低 | 构建复杂/低频点突变模型 |
其实点突变细胞构建没有 “最好” 的方法,只有 “最适合” 的方案。如果你是第一次做点突变细胞,建议先了解全面点突变细胞构建的方法,再根据实验目的选择最适合的方案。如果大家在实验中遇到具体问题 —— 比如某类细胞转染效率低、编辑后没找到纯合突变株,欢迎在评论区留言,我们可以一起探讨解决方案~
欢迎联系我们获取专业指导与服务。>>









