源井溶酶体靶点KO细胞库,主打一个“全”字!

源井溶酶体靶点KO细胞库,主打一个“全”字!

溶酶体(Lysosome)是细胞内含有多种水解酶的细胞器,是细胞内分解、降解细胞垃圾和细胞内过程中产生的废物的主要场所。它在细胞的代谢过程、免疫应答、信号传导等多个生理过程中发挥着关键作用。多项研究证实,人类的多种疾病发生可能与溶酶体相关机制有关,例如动脉粥样硬化、神经退行性疾病、胰腺炎、自身免疫性疾病、溶酶体贮积症和癌症等,对这些机制的深入了解有助于研究靶向溶酶体的治疗方法。
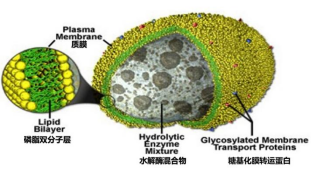
图1 溶酶体结构(来源百度词条)
为了研究溶酶体相关基因功能,通常需要借助CRISPR基因编辑技术。美国密歇根大学李明教授课题组利用CRISPR/Cas9 技术在全基因组水平筛选到可以通过影响溶酶体功能阻碍RNF152降解的基因TMEM251[1];Kivanc等通过CRISPR文库进行unbiased的代谢基因筛选,得到了与溶酶体pH环境相关的两个重要代谢通路——胆固醇合成以及铁摄取[2]。接下来,小源将以近期发表在Cell期刊的研究为例,带大家用CRISPR基因编辑技术打开溶酶体在帕金森症研究中的新思路。
【CRISPR/Cas9基因编辑TMEM175,探索其与帕金森症发病关联】
浙工大团队以Parkinson’s Disease-Risk Protein TMEM175 is a Proton-Activated Proton Channel in Lysosomes为题在Cell上发文,该研究发现帕金森症的风险基因TMEM175是定位于溶酶体的氢离子激活的氢离子通道,其突变可能是诱发帕金森症的关键因素之一[3]。
TMEM175被鉴定为一个K+通道,介导溶酶体和内体膜上的钾传导,从而调节RAW 246.7小鼠巨噬细胞中溶酶体膜电位和pH。为了确定TMEM175是否在神经元来源的细胞中具有类似的功能,研究者使用CRISPR/Cas9技术在SH-SY5Y神经母细胞瘤细胞系中做TMEM175的敲除(图2A)[4]。研究发现,在含有10%血清的培养基中,TMEM175 KO SH-SY5Y的溶酶体pH值略高于WT。在Earle平衡盐溶液(EBSS)中培养3小时后,溶酶体pH值显著增加,而WT SH-SY5Y细胞在两种培养条件下保持溶酶体pH值未显著变化(图2B)。考虑到TMEM175在溶酶体中会在多个组织中普遍表达。在营养培养和寡营养培养条件下,TMEM175 KO细胞中溶酶体天冬氨酸蛋白酶(CTSD)和半胱氨酸蛋白酶组织蛋白酶B (CTSB)的蛋白水平与WT相比均显著降低(图2D),溶酶体功能产生障碍。在TMEM175的 KO细胞中,也观察到溶酶体相关膜糖蛋白1 (LAMP1)的迁移速度比WT更快,这可能是通过去糖基化或蛋白水解裂解导致的(图2D)。TMEM175 KO没有改变LAMP1+溶酶体的数量(图2C)。对这些溶酶体酶活性的进一步评估显示,与WT相比,TMEM175 KO的CTSD、CTSB和另一种与帕金森症相关的溶酶体水解酶GBA显著减少20-30%(图2E-G)。寡营养培养没有进一步显示WT和KO之间酶活性的降低程度。与WT相比,KO中L-Homopropargylglycine (HPG)标记的蛋白质降解率降低(图2H)。
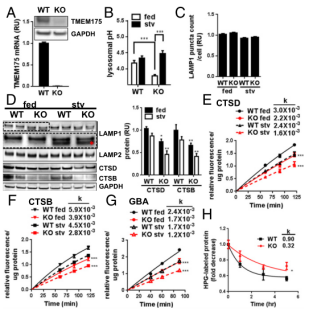
图2 TMEM175 KO细胞中溶酶体pH不稳定且酶活性降低
为了确定TMEM175是否在α-突触核蛋白聚集中发挥作用,研究者在大鼠海马神经元细胞中用shRNA 干扰TMEM175,再通过免疫细胞化学和WB评估它们磷酸化的α-突触核蛋白表达量(图2A)。在14d和21d培养时,TMEM175表达量降低了75-80%(图2B)。经PFF处理的TMEM175-KD神经元细胞中,磷酸化α-突触核蛋白染色显著增加 2-3倍(图2C和图2D),21d增加1.5倍(图2G和H)。PFF处理后14天,TMEM175-KD神经元的健康细胞核数量或代谢活性评估的细胞活力没有变化(图2E)。PFF后21天,存活细胞减少(图2I),可能导致磷酸化α-突触核蛋白比PFF后14天减少了1倍。重要的是,与对照神经元相比,TMEM175的敲低导致α-突触核蛋白聚集倾向增加,这是α-突触核蛋白病和帕金森症发展的关键因素。
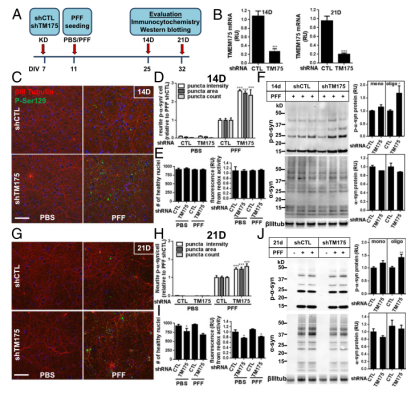
图3 TMEM175敲低增加大鼠海马神经元细胞磷酸化α-突触核蛋白聚集
研究人员在大鼠神经元模型系统中研究了TMEM175的功能。研究证实,TMEM175缺乏导致溶酶体pH不稳定,从而进一步导致溶酶体催化活性降低,葡萄糖脑苷酶活性降低,溶酶体对自噬体的清除受损,线粒体呼吸减少。此外,大鼠原代神经元TMEM175缺失导致外源性α-突触核蛋白原纤维易感性增加。在α-突触核蛋白原纤维处理后,发现缺乏TMEM175的神经元磷酸化和洗涤剂不溶性α-突触核蛋白沉积增加。综上所述,TMEM175在溶酶体和线粒体功能以及帕金森症发病机制中起着直接的关键作用,并突出了该离子通道作为治疗帕金森症的潜在治疗靶点。
参考文献:
[1] Zhang W, Yang X, Li Y, et al. GCAF (TMEM251) regulates lysosome biogenesis by activating the mannose-6-phosphate pathway[J]. Nature Communications, 2022, 13(1): 5351.
[2] Weber RA et al. Maintaining Iron Homeostasis Is the Key Role of LysosomalAcidity for Cell Proliferation. Molecular Cell. (2020) 7, 645-655.
[3] Hu M, Li P, Wang C, et al. Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes[J]. Cell, 2022, 185(13): 2292-2308. e20.
[4] Jinna S PE et al. TMEM175 deficiency impairs lysosomal and mitochondrial function and increases α-synuclein aggregation[J]. PANS. (2017)26: 114 (9) 2389-2394.










