从基因密码到细胞疗法:CRISPR筛选揭示iTreg 细胞疗法新思路
调节性 T 细胞(Treg)作为免疫系统的 “守护者”,通过特异性表达转录因子 FOXP3 维持免疫耐受,其功能缺陷会导致自身免疫病等多种疾病。然而,体外诱导的 iTreg 细胞因 FOXP3 表达不稳定,始终是细胞疗法临床转化的 “绊脚石”。2025 年发表于《Nature》的研究 “Genome-wide CRISPR screen in human T cells reveals regulators of FOXP3”,通过全基因组 CRISPR 筛选技术,系统性挖掘 FOXP3 调控基因,发现 RBPJ 是 iTreg 分化的关键负调控因子,为优化 iTreg 细胞疗法提供了全新靶点和机制解释。
一、研究背景:iTreg 细胞的 “稳定性困境”
自然调节性 T 细胞(nTreg)在胸腺中发育成熟,FOXP3 表达稳定;而体外通过 TGFβ 和 IL-2 诱导 naive CD4+T 细胞生成的 iTreg 细胞,常因 FOXP3 表达波动丧失功能。这种不稳定性源于 FOXP3 基因调控网络的复杂性 —— 已知 TGFβ-SMAD 通路、表观遗传修饰(如 CNS2 区域甲基化)参与调控,但全基因组范围内的关键调控因子仍不明确。
研究团队指出,传统研究多聚焦于 nTreg 的维持机制,而 iTreg 的分化调控尚未被系统解析。因此,通过无偏倚的全基因组筛选技术,挖掘影响 FOXP3 诱导的关键基因,成为突破 iTreg 稳定性难题的核心策略。
二、技术核心:全基因组 CRISPR 筛选的 “高精度搜索”
为系统性寻找 FOXP3 调控基因,研究团队建立了基于 SLICE(sgRNA 慢病毒感染结合 Cas9 电穿孔)的 CRISPR 筛选平台,其设计堪称 “基因层面的显微镜”。
1. 筛选设计:锁定 FOXP3 表达差异的细胞群体
研究采用覆盖 19113 个基因的 sgRNA 文库(77491 条 sgRNA,每个基因 4 条),转染人原代 naive CD4+T 细胞后,通过 TGFβ、IL-2 等诱导 iTreg 分化。72 小时后,通过流式细胞术将细胞分为 FOXP3high(高表达)和 FOXP3low(低表达)两组,利用 MAGeCK 软件分析两组 sgRNA 的富集差异,锁定调控基因。
筛选结果显示,已知调控因子(如 TGFBR1、SMAD3)的出现验证了方法可靠性,更重要的是发现了 SMARCB1、MIDN 等新候选基因。其中,RBPJ 作为负调控因子表现突出 —— 其 sgRNA 在 FOXP3high 细胞中显著富集,提示 RBPJ 缺失可促进 FOXP3 表达(图 1b,c)。
2. 验证策略:从筛选到单基因功能确认
为排除假阳性,团队通过 Cas9-gRNA 核糖核蛋白(RNP)进行单基因敲除验证。结果显示,RBPJ 敲除后,FOXP3 + 细胞比例和平均荧光强度(MFI)均显著升高,且在 5 名独立供体中趋势一致,证明其调控作用的稳健性(图 1e,g)。
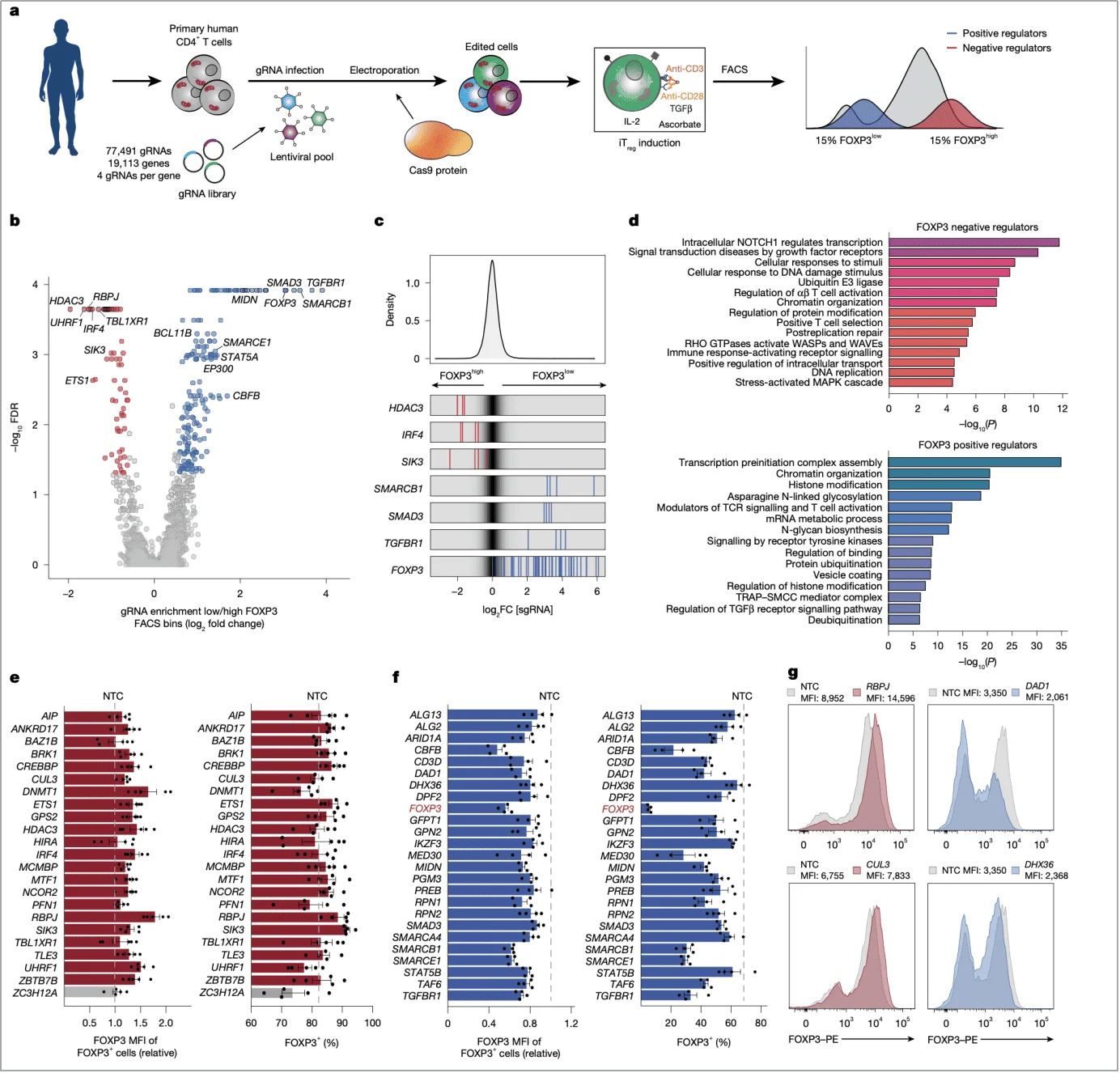
图 1. 在原代人T细胞中进行的全基因组CRISPR筛选揭示了调控FOXP3诱导的新型因子
三、机制解析:RBPJ 如何 “抑制” FOXP3 表达?
RBPJ 作为 Notch 通路的经典下游分子,其调控 FOXP3 的机制却独立于 Notch 信号,这一发现颠覆了传统认知。
1. 不依赖 Notch 的 “独立行动”
实验显示,干扰 Notch 通路关键分子(如 NOTCH1、MAML1)对 FOXP3 表达无显著影响,而 RBPJ 敲除仅在 iTreg 中增强 FOXP3 表达,对 nTreg 无明显作用。这提示 RBPJ 的调控具有 “细胞类型特异性”,且与 Notch 通路无关(图 3b)。
2. 与 NCOR-HDAC3 复合体的 “协同抑制”
进一步研究发现,RBPJ 通过 β- 三叶形 DNA 结合域与 NCOR(核受体共抑制因子)-HDAC3 复合体结合,直接作用于 FOXP3 启动子。ChIP-seq 实验证实,RBPJ 缺失后,FOXP3 基因区域的 H3ac、H3K9ac(激活型组蛋白修饰)水平升高,而 HDAC3 抑制剂可逆转 RBPJ 过表达对 FOXP3 的抑制,证明其通过组蛋白去乙酰化抑制转录(图 2f,g)。
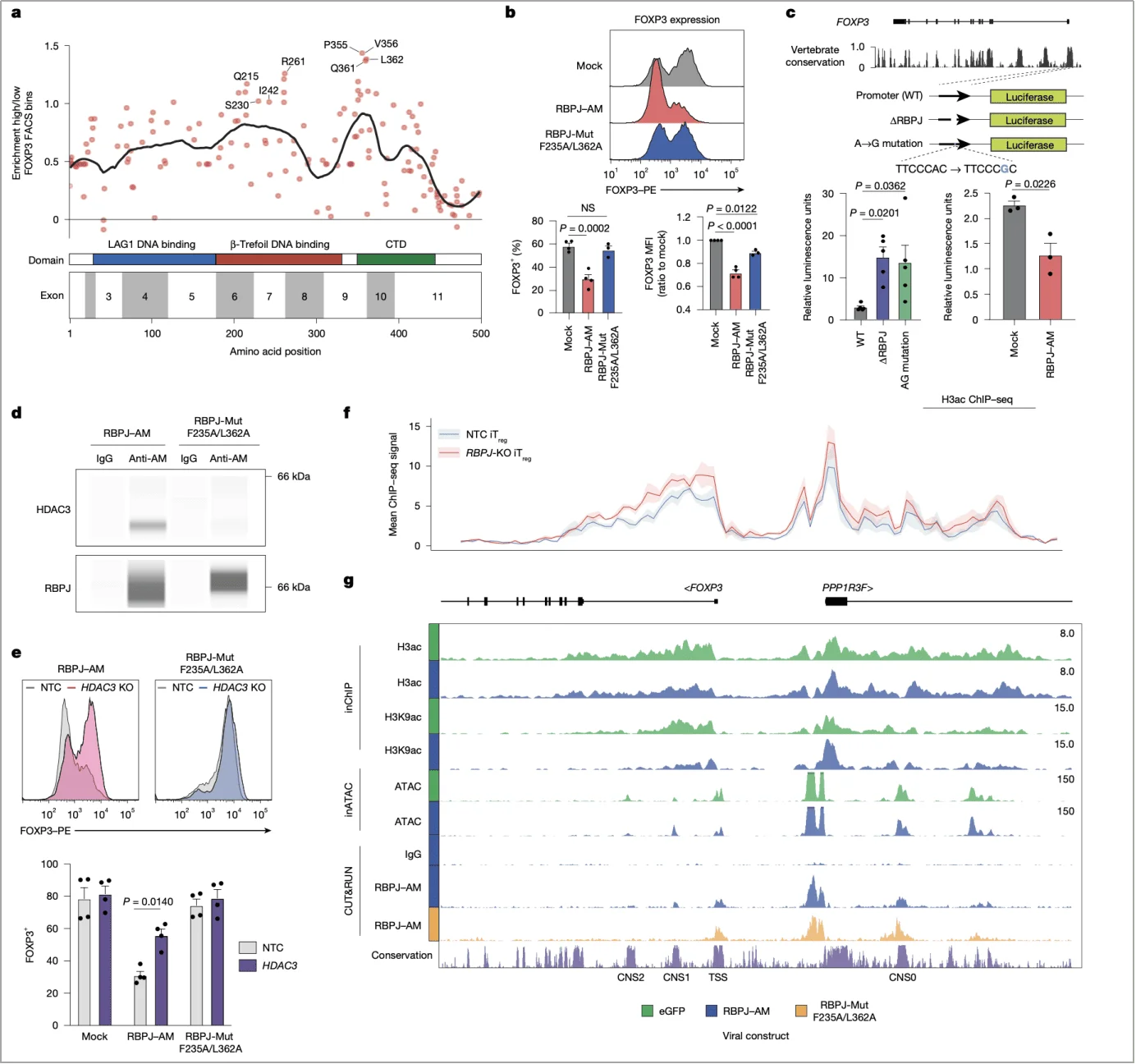
图 2. RBPJ–NCOR–HDAC3 复合体通过调控局部组蛋白乙酰化直接抑制 FOXP3 的表达
3. 表观遗传的 “双重调控”
除直接抑制转录,RBPJ 还影响 FOXP3 的表观遗传稳定性。RBPJ 敲除后,FOXP3 基因 CNS2 区域(与长期表达相关)的 CpG 甲基化水平显著降低,且这种去甲基化依赖抗坏血酸(维生素 C),提示 RBPJ 可能通过抑制去甲基化酶活性维持 CNS2 甲基化(图 3g)。
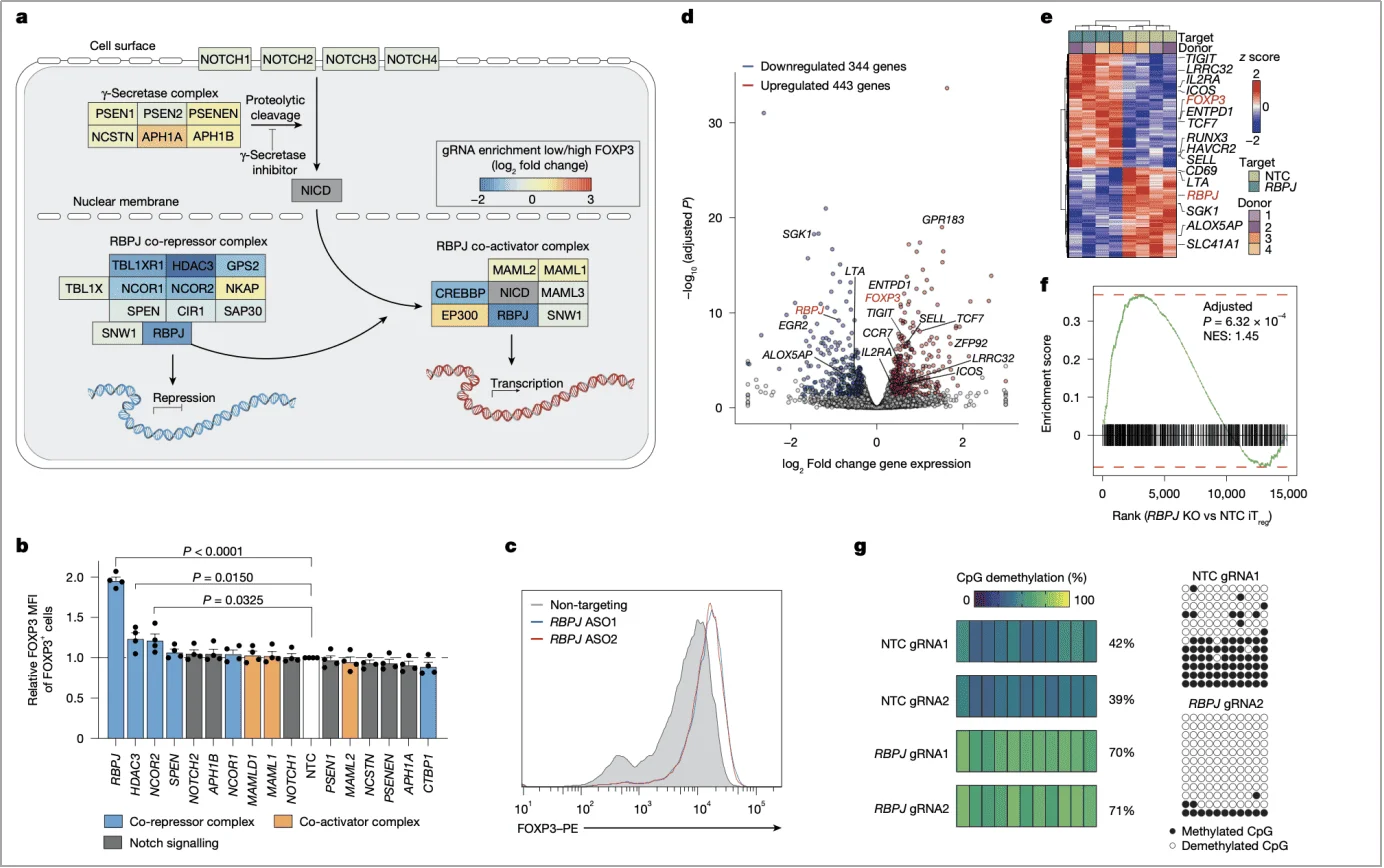
图 3. 敲除RBPJ可提升iTreg细胞中FOXP3的表达、功能与稳定性。
四、功能延伸:Perturb-icCITE-seq 揭示调控网络
为解析 RBPJ 的全局调控效应,团队采用 Perturb-icCITE-seq 技术 —— 结合 CRISPR 扰动与单细胞蛋白 - 转录组分析,同时检测 296 个候选基因敲除后的转录组和 300 多种蛋白表达变化。
结果显示,RBPJ 敲除后,iTreg 的核心功能基因(如 IL2RA、ENTPD1)表达上调,免疫抑制分子(CTLA4、CD39)蛋白水平升高,提示其功能增强。通过共功能模块分析,RBPJ 被归为模块 H,与 NCOR 复合体(模块 I)的调控特征不同,进一步支持其独立调控作用(图 4d,e)。
更关键的是,该技术验证了 FOXP3 蛋白与 sgRNA 富集的强相关性(r=-0.71),证明 RBPJ 对 FOXP3 的调控是直接且特异性的(图 4c)。
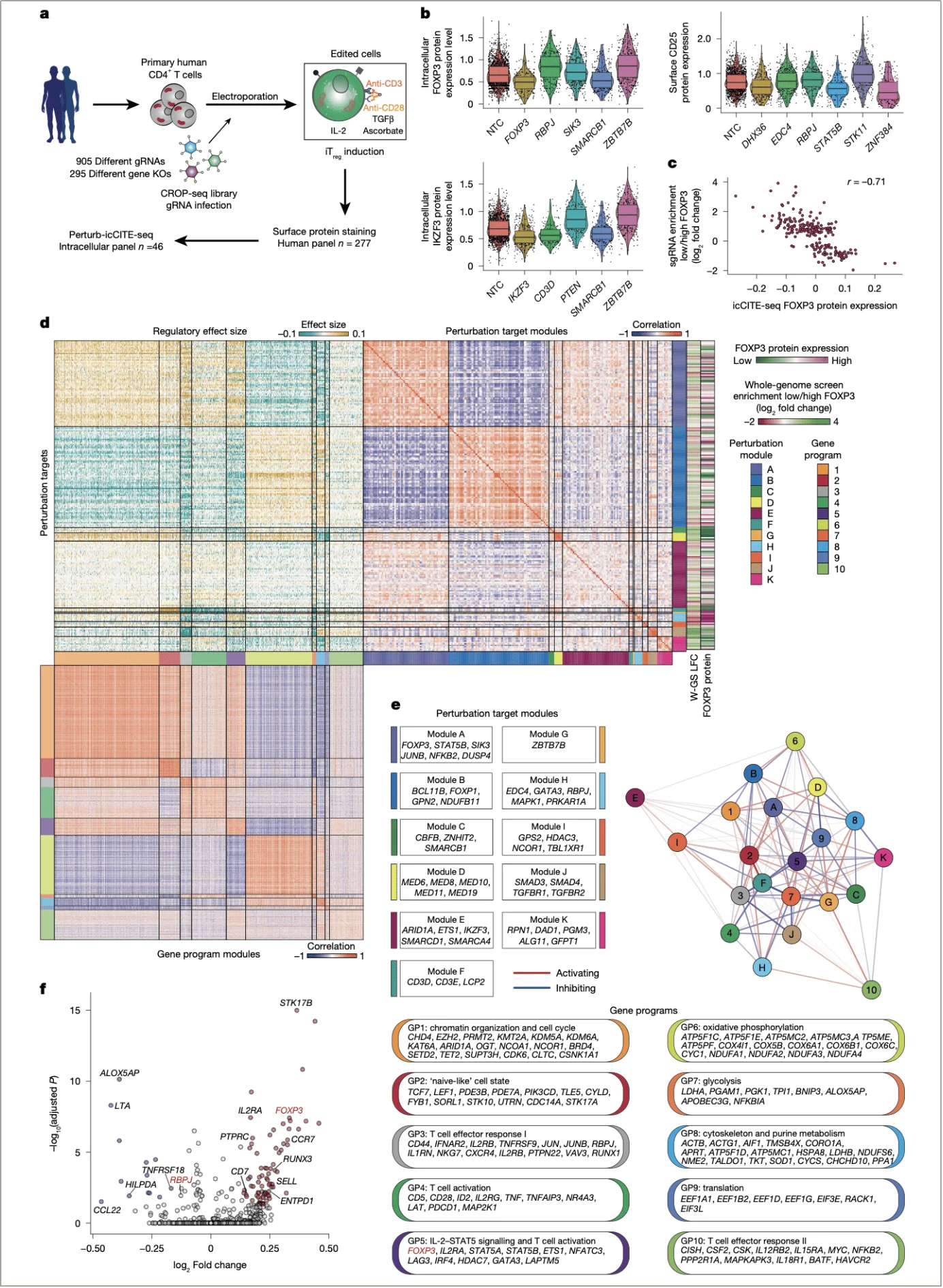
图 4. 利用 Perturb-icCITE-seq 技术对 FOXP3 调控因子进行验证
五、临床潜力:RBPJ 敲除 iTreg 的 “功能跃升”
从基础机制到临床前验证,研究团队通过系列实验证实 RBPJ 敲除可显著提升 iTreg 的治疗潜力。
1. 体外功能:稳定性与抑制能力双提升
在重复 TCR 刺激和 TNF(炎症因子)处理下,RBPJ 敲除 iTreg 的 FOXP3 + 细胞比例仍保持 70% 以上,显著高于对照组(约 40%)。抑制实验显示,其对 CD4+、CD8 + 效应 T 细胞的增殖抑制能力提升 2-3 倍,且在 1:16 的低比例下仍有效(图 5)
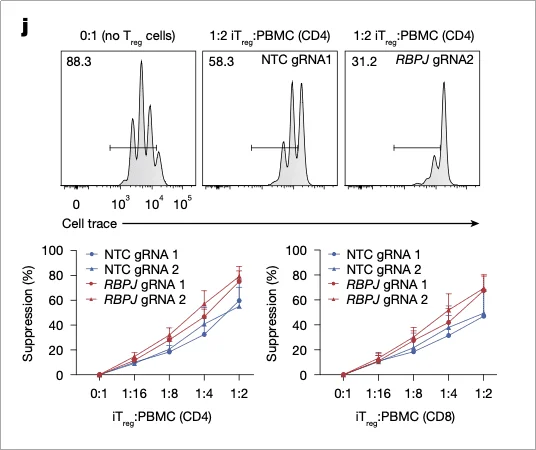
图 5. 抑制实验证实,RBPJ 缺失的 iTreg 细胞具有更强的抑制活性。
2. 体内验证:在 GvHD 模型中展现治疗优势
在人源化小鼠模型中,输注 RBPJ 敲除 iTreg 的小鼠生存率达 80%,显著高于对照组(输注 nTreg 的小鼠生存率约 70%,输注对照 iTreg 的小鼠仅 30%)。同时,体重下降幅度更小,5 天后仍有 91.5% 的细胞保持 FOXP3 高表达,证明其体内稳定性(图 6b,c,d)。
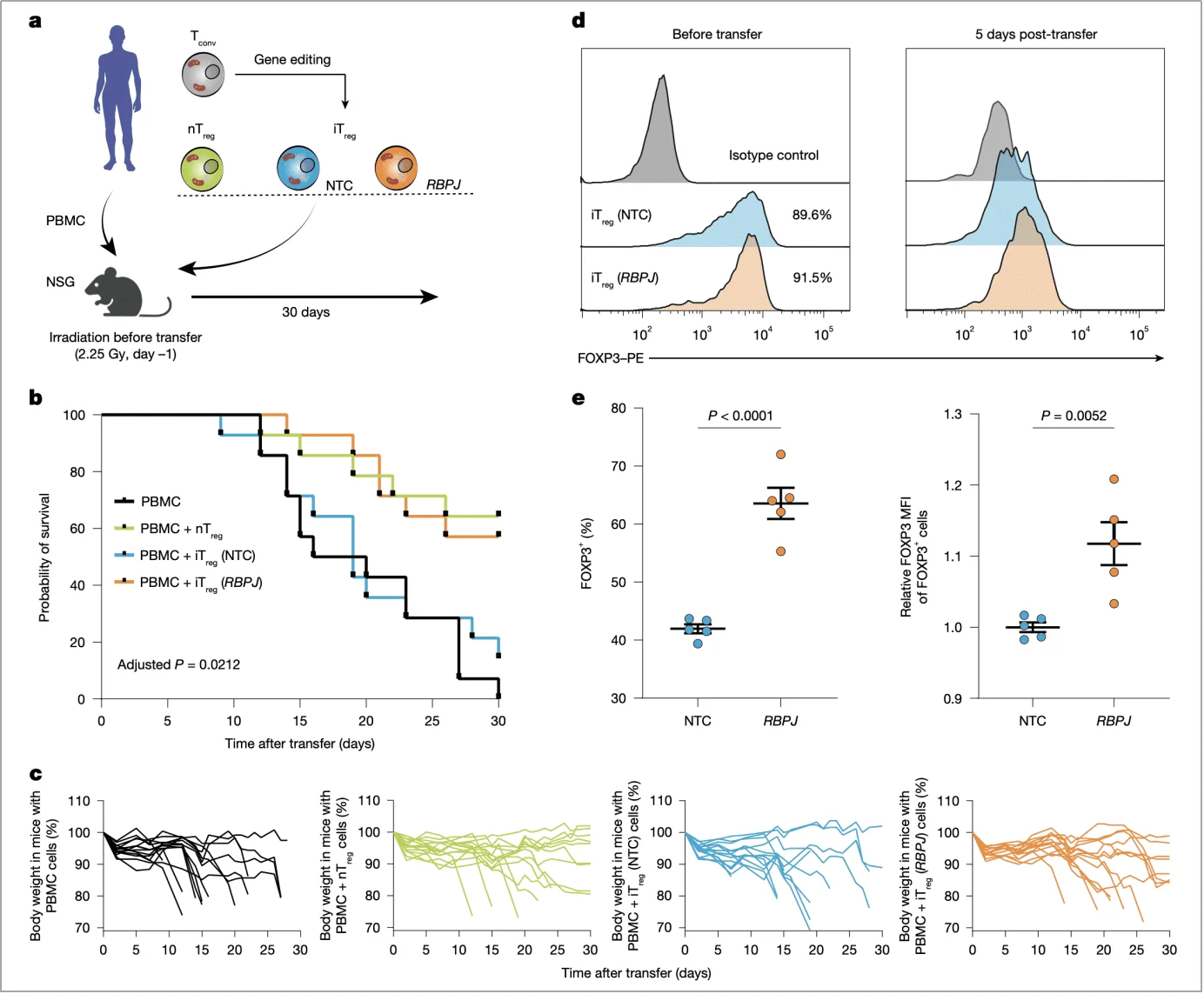
图 6. RBPJ 缺失可增强 iTreg 的体内稳定性及抑制功能
六、技术创新:聚焦 FOXP3 + 细胞的 “精准分析工具”
为克服传统方法难以聚焦特定细胞群体的局限,研究团队开发了三项新技术,为表观遗传和转录组分析提供 “靶向视角”:
-
· icRNA-seq: 通过流式分选 FOXP3 + 细胞后提取 RNA,精准分析其转录组,避免 FOXP3 - 细胞的干扰;
-
· inChIP-seq: 针对 FOXP3 + 细胞进行染色质免疫共沉淀,揭示 RBPJ 对 FOXP3 启动子组蛋白修饰的影响;
-
· inATAC-seq: 分析 FOXP3 + 细胞的染色质开放性,发现 RBPJ 缺失可增强 FOXP3 启动子和 CNS2 区域的开放性。
这些技术解决了 “混合细胞群体分析掩盖关键信号” 的难题,为其他转录因子的细胞特异性调控研究提供了范式。
七、意义与展望:从基础研究到细胞疗法的 “桥梁”
这项研究不仅揭示了 FOXP3 调控的新机制,更为 iTreg 细胞疗法提供了切实可行的优化策略:
-
· 理论突破:发现 RBPJ 这一新型调控因子,完善了 FOXP3 的表观遗传调控网络,解释了 iTreg 与 nTreg 在稳定性上的差异。
-
· 临床潜力:通过敲除 RBPJ 增强 iTreg 的稳定性和功能,为自身免疫病(如类风湿关节炎)、器官移植排斥等疾病的细胞疗法提供了新方案。
-
· 技术启发:全基因组 CRISPR 筛选结合单细胞多组学的策略,为其他细胞命运调控的研究提供了可借鉴的范式。
从基因层面的 “地毯式搜索” 到细胞功能的 “全面升级”,这项研究让我们离 “可控、稳定的 iTreg 疗法” 更近了一步。或许在不久的将来,经过 RBPJ 调控优化的 iTreg 细胞,能像训练有素的 “维和部队” 一样,精准守护我们的免疫系统,为无数患者带来希望。
源井生物依托自主研发的CRISPR-iScreen™ 技术平台,面向多种科研应用场景,构建了完善的表型筛选与数据分析体系,提供从实验设计到结果解析的精细化功能筛选服务,助力科研高效推进。无论是CRISPR 文库质粒、CRISPR 文库病毒、CRISPR 文库 Cell Pool,还是功能筛选体系搭建、NGS 测序,我们均可提供覆盖全流程的功能筛选与一站式 CRISPR 筛选服务,确保各环节无缝衔接,让科研更高效、更轻松。
源井生物即将推出全新文库自动分析平台,实现生信数据全自动化处理。科研人员无需依赖外部服务,轻松在实验室内自主完成CRISPR筛选数据分析与结果可视化,极大提升工作效率,节省人力和成本,真正做到数据“自己来”,科研更高效、更自由!
如果您感兴趣,可以联系我们获取更多技术支持>>
参考文献
Chen, K.Y., Kibayashi, T., Giguelay, A. et al. Genome-wide CRISPR screen in human T cells reveals regulators of FOXP3. Nature 642, 191–200 (2025).
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划































 联系电话
联系电话
 投诉电话
投诉电话
