CRISPR文库筛选:这些细节你知道吗?

作为筛选功能性基因的利器,CRISPR文库筛选已在众多研究领域展现出强大威力。借助此技术,研究者们成功挖掘了数千个新靶点,催生了数百篇顶级期刊(CNS)论文。许多科研工作者也期待利用CRISPR文库筛选找到心仪的靶点。然而,筛选过程中常出现结果不理想、靶点难觅的情况,不仅耗费宝贵的经费,更浪费了时间。实验细节是决定成败与结果可靠性的核心。那么,在CRISPR文库筛选中,哪些细节至关重要?
本文为您梳理了CRISPR文库筛选的关键注意事项,助您获得更理想的筛选数据!
严格控制细胞感染效率
保证筛选结果可靠的前提是每个细胞仅引入单基因突变。因此,构建文库细胞时,必须保证一个细胞只整合一条sgRNA。过高的病毒感染效率虽能提升sgRNA覆盖率,却大大增加单细胞整合多条sgRNA的风险。通常建议将病毒感染效率控制在30%左右,这样既能有效避免多重感染,又能保证文库细胞中sgRNA的覆盖率。
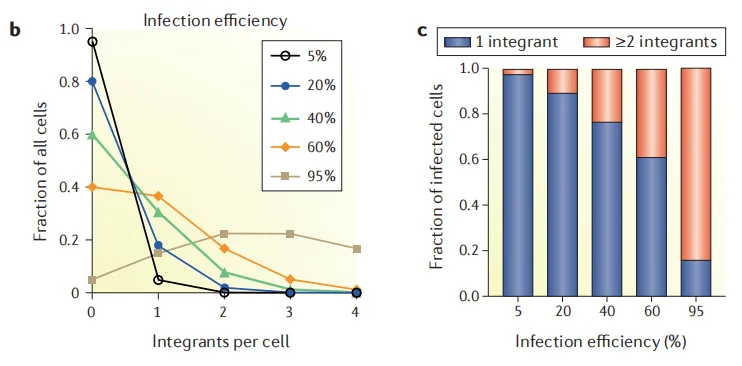
图1 感染效率越高,细胞进入多条sgRNA概率越高[1]
确保文库细胞sgRNA覆盖率
若功能筛选前文库细胞的sgRNA覆盖率不足,可能导致潜在靶基因(对应的sgRNA)在筛选前就已丢失,造成结果失真。提高初始感染细胞量,可有效增加sgRNA覆盖率,并减少传代过程中的随机丢失。一般推荐初始感染细胞量达到sgRNA数量的300倍以上(300x覆盖度)。所需野生型细胞量计算公式为:sgRNA数量 × 300 / 感染效率(例如0.3)。
![感染细胞量越多,sgRNA丢失比例越低[1]](/uploads/allimg/250630/36-250630160623a5.webp)
图2 感染细胞量越多,sgRNA丢失比例越低[1]
提高初始筛选细胞量
筛选本质上是目标细胞的富集过程。在富集过程中,尤其是筛选周期短或筛选压力小的项目中,非靶细胞被一同富集到目标群体的情况难以避免,这会稀释靶细胞的比例,增加识别难度。增加初始筛选细胞量,能显著提升靶细胞的富集程度,降低随机误差干扰,使后续生物信息学分析更容易识别出真正的靶基因。
增加靶向单个基因的sgRNA数量
RISPR文库细胞的异质性依赖于sgRNA的基因编辑效率,但并非所有设计的sgRNA都能有效编辑目标基因。在筛选中,每条有效sgRNA可视为一次独立重复实验.若针对单个基因设计的sgRNA过少,“无效”sgRNA对最终结果的影响就会被放大。为减少无效sgRNA干扰、提升结果可信度,建议为每个基因设计至少5条sgRNA。
关注细胞基因编辑效率的影响
CRISPR/Cas9系统的编辑效率受sgRNA序列、细胞类型、培养时间等多种因素影响。若文库细胞中仅10%被成功编辑,意味着90%的细胞相当于“野生型”。这些“野生型”细胞在后续筛选中不会被富集或丢失,将严重稀释靶细胞的富集信号或掩盖其丢失信号,对结果分析造成巨大干扰。筛选前,通过适当延长文库细胞培养时间(1-2周),可增加被编辑细胞的比例,降低此因素影响。
图3 细胞培养时长对基因编辑效率的影响[2]
源井生物拥有丰富细胞基因编辑经验,可协助筛选编辑效率更高的细胞株,进一步提升结果可靠性。点击了解更多>>>
理解筛选强度对筛选结果的影响
CRISPR文库筛选主要分为阳性筛选(Positive Selection)和阴性筛选(Negative Selection):
阳性筛选:施加强筛选压力(如药物处理、营养剥夺),绝大多数细胞死亡,仅极少数具有特定表型(如耐药)的细胞存活并被富集。通过分析富集细胞群中的sgRNA分布寻找靶基因(如耐药基因)。
阴性筛选:施加较弱筛选压力(如低剂量药物),仅少量对压力敏感的细胞死亡,大部分细胞存活。通过分析丢失的sgRNA分布寻找靶基因(如药物敏感基因)。
筛选强度直接影响结果特征与分析方式:
|
筛选类型 |
筛选强度 |
特征 |
生信分析方式 |
靶基因sgRNA变化特征 (实验组 vs 对照组) |
靶基因 |
结果可信度 |
|
阳性筛选 |
高 |
绝大多数细胞在筛选过程中丢失,收集剩余被富集的细胞用于 NGS 测序 |
正向筛选 |
显著富集 |
耐药基因 |
高 |
|
负向筛选 |
显著丢失 |
药物敏感基因 |
低 |
|
阴性筛选 |
低 |
少量细胞在筛选过程中丢失,收集大量未被丢失的细胞用于NGS测序 |
正向筛选 |
富集 |
耐药基因 |
低 |
|
负向筛选 |
显著丢失 |
药物敏感基因 |
较高 |
关键解读:
· 在阳性筛选中,正向分析(寻找富集的sgRNA) 针对存活细胞,富集的sgRNA数量少,靶基因信号集中且显著(如耐药基因),结果可信度高。
· 在阴性筛选中,负向分析(寻找丢失的sgRNA) 针对死亡细胞,差异基因数量相对较少且信号明确(如药物敏感基因),结果可信度较高。
相反,阳性筛选中的负向分析(分析丢失的sgRNA)差异基因数量庞大且信号弱;阴性筛选中的正向分析(分析富集的sgRNA)往往反映的是细胞增殖差异或随机误差,而非真正的耐药机制,这两种情况的结果可信度均较低。
正视正向与负向筛选结果的可靠性差异
如前所述,文库细胞池中必然存在部分携带sgRNA但未成功编辑的“野生型”细胞。这些细胞的存在对不同类型的筛选结果干扰程度不同:
· 在阴性筛选中,我们关注丢失的细胞。但携带靶基因sgRNA的细胞中,只有成功编辑的敏感细胞会丢失,未编辑的“野生型”细胞依然存活。这严重稀释了靶基因sgRNA的丢失信号,降低差异显著性,干扰靶基因识别。
· 在阳性筛选中, 我们关注存活/富集的细胞。强筛选压力下,只有成功编辑的靶细胞(如获得耐药性)才能存活并被富集(通常经历多轮筛选和增殖),未编辑的“野生型”细胞和非靶细胞均被清除。因此,“野生型”细胞的存在对阳性筛选的正向分析结果干扰极小。
因此,在CRISPR文库筛选中,阳性筛选的正向分析结果通常比阴性筛选的负向分析结果具有更高的可信度,尤其是经过多轮筛选富集后的阳性结果。
总结
CRISPR文库筛选结果的可靠性受到细胞基因编辑效率、sgRNA数量与设计、筛选压力强度以及数据分析策略等多重因素的共同影响。深刻理解并精细控制这些关键细节,是获得成功、可靠筛选数据的基础。
源井生物拥有专业的CRISPR文库筛选团队,助您获得更加可靠的筛选结果!点击咨询
参考文献
[1]Doench JG. Am I ready for CRISPR? A user's guide to genetic screens. Nat Rev Genet. 2018 Feb;19(2):67-80.
[2]Shalem O, Sanjana NE, Hartenian E, Shi X, Scott DA, Mikkelson T, Heckl D, Ebert BL, Root DE, Doench JG, Zhang F. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 2014 Jan 3;343(6166):84-87.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划







![感染细胞量越多,sgRNA丢失比例越低[1]](/uploads/allimg/250630/36-250630160623a5.webp)

















 联系电话
联系电话
 投诉电话
投诉电话
