《Cell》系列突破:源井助力揭秘α-酮戊二酸驱动间充质干细胞抗衰新机制
2025 年 7 月,中国中医科学院等单位的研究人员在《Cell》系列子刊《Cell Reports》发表重要研究成果。在该研究中,源井生物为科研团队提供了关键细胞模型,成为支撑研究顺利推进的重要力量。研究论文题为 “Identifying the target, mechanism, and agonist of α- ketoglutaric acid in delaying mesenchymal stem cell senescence” ,揭示了 α- 酮戊二酸(AKG)延缓间充质干细胞(MSC)衰老的全新机制——AKG 通过促进核糖体蛋白 S23(RPS23)羟基化、增强翻译保真度来延缓 MSC 衰老。研究指出,异柠檬酸脱氢酶 1(IDH1)驱动产生的 AKG 在这一过程中至关重要。此外,通过灯盏乙素(Scu)激活该过程,能够减轻小鼠的衰老表型。这项关键性研究,为抗衰老策略提供了全新方向和启发 。
亮点概述
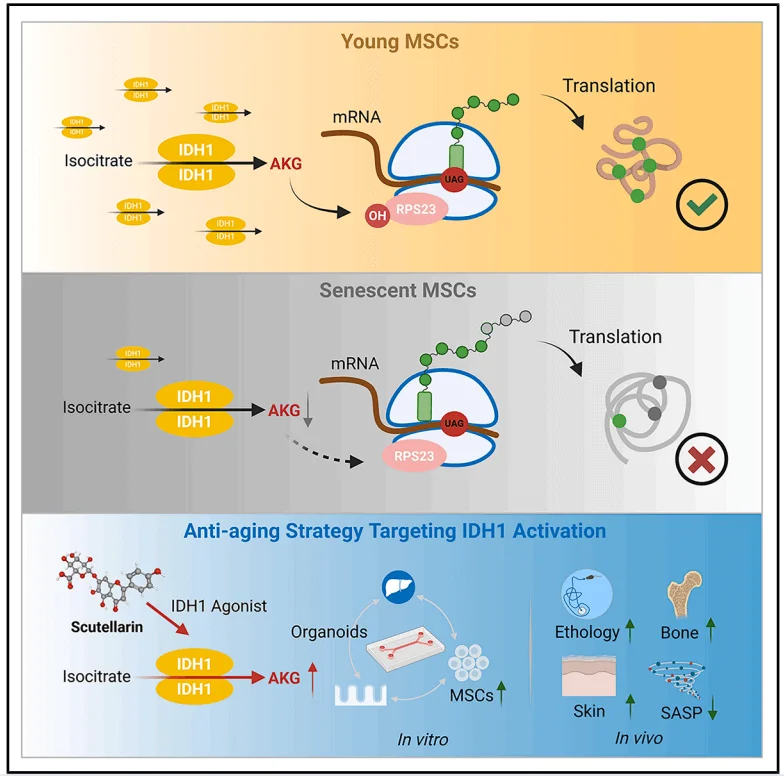
AKG通过铁依赖性氧化酶OGFOD1增强RPS23的羟基化作用来延缓MSC衰老,IDH1活性下降会降低AKG水平,驱动MSC衰老;重新激活可逆转这种衰老现象。Scu激活IDH1,提高AKG水平,并减轻小鼠的年龄相关表型,AKG可提高翻译保真度,平衡蛋白质合成和准确性。
研究背景
AKG是一种在多种代谢和细胞途径中的关键化合物。研究表明,AKG可以延缓衰老,被认为是一种无害的膳食补充剂,有助于延长健康寿命,并可能降低疾病发生率。IDH1是合成AKG的关键酶,且与人类年龄相关的疾病有关。尽管来自多项研究的间接证据提示了IDH1-AKG信号轴在衰老过程中的重要性,但该途径的具体分子机制及其抗衰老靶点仍不明确。
干细胞衰老被认为是机体衰老的重要标志和驱动力。因此,探索增加体内干细胞数量以延缓衰老的方法是一个活跃的研究领域。蛋白质稳态失衡在衰老过程中经常发生。机制缺陷或突变会损害翻译的准确性,导致产生形状异常的蛋白质。这反过来又会导致形成功能异常的蛋白质并积累有害的蛋白质聚集体。因此,识别既能提高蛋白质合成速率又能提高翻译准确性的抗衰老分子或组合,是解决干细胞衰老问题的一种可能途径。在本研究中,研究人员旨在探究IDH1和AKG在MSC衰老过程中调节蛋白质稳态的潜在作用及分子机制。
研究结果
三羧酸(TCA)循环是衰老网络中整合代谢与信号传导的核心枢纽,而AKG是该循环的中间产物。研究人员使用稳定同位素13C6标记的葡萄糖来研究MSCs衰老过程中TCA循环相关代谢小分子生成的变化。结果表明,与低代次MSCs相比,高代次MSCs产生的柠檬酸、乌头酸、AKG、延胡索酸、苹果酸和乙酰辅酶A的生成显著减少。细胞增殖实验结果显示,只有AKG及其衍生物二甲基α-酮戊二酸(DM-AKG)显著增强了MSCs的增殖。随后,研究人员分析了经历生理性衰老的MSCs和经受D-半乳糖(D-Gal)诱导的病理性复制衰老的MSCs中的AKG水平。结果显示,与正常MSCs相比,经历病理性和生理性衰老的MSCs中AKG水平均显著降低。接下来,研究人员探究了补充AKG及DM-AKG对MSCs衰老的影响,均导致细胞内AKG浓度升高,且DM-AKG在较低剂量下就显示出显著效果。总之,这些研究结果表明AKG可能作为MSCs衰老的代谢生物标志物,而AKG产量的下降可能是导致MSC衰老的因素之一。
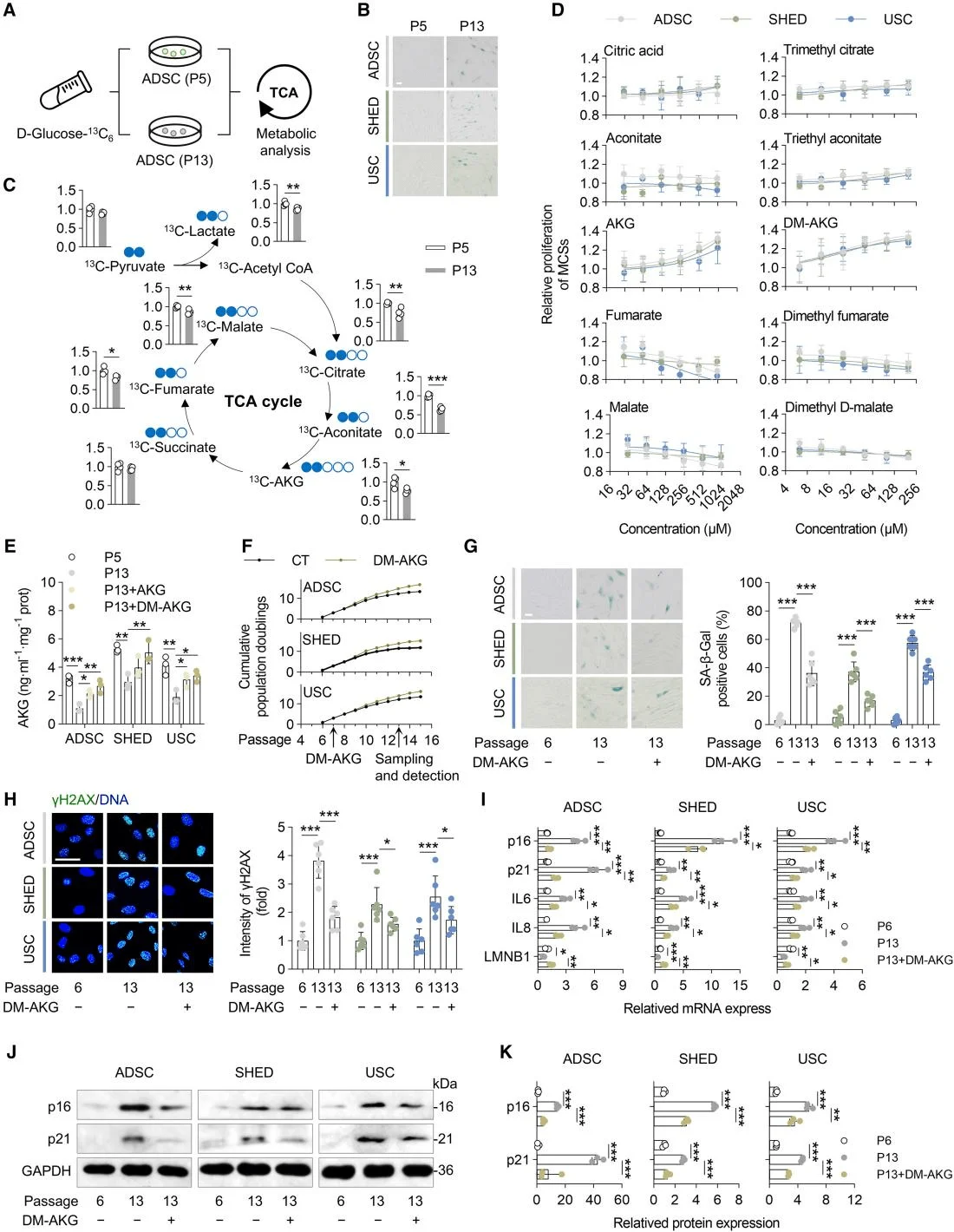
AKG是延缓MSCs衰老的关键代谢物质
为了探究AKG延缓MSC衰老的机制,研究人员采用了热蛋白质组分析-细胞环境热移位(TPP)实验来确定AKG的蛋白质靶点。结果显示AKG作用的靶点与核糖体功能密切相关,核糖体蛋白RPS23是受AKG影响变化最显著的靶点。鉴于RPS23蛋白存在羟基化修饰,研究人员探究了AKG对RPS23羟基化的影响,发现AKG显著增强了这一过程。先前的研究表明,OGFOD1在真核生物中催化RPS23的脯氨酸羟基化,AKG作为其关键辅因子。研究人员进一步明确了OGFOD1在RPS23羟基化过程中的关键作用,OGFOD1与AKG结合而非RPS23直接结合,并在MSC细胞实验中对OGFOD1进行了功能验证。这些结果表明,AKG通过RPS23的羟基化来延缓MSC衰老,OGFOD1成为AKG介导的RPS23羟基化的关键靶点。
研究人员通过免疫共沉淀实验和双分子荧光互补分析,发现DM-AKG增强了RPS23与OGFOD1蛋白之间的相互作用。进一步构建了RPS23-OGFOD1-AKG的分子对接模型,并构建RPS23-P62A突变体MSCs验证了分子动力学模拟中发现的结果,上述实验揭示了AKG通过稳定OGFOD1-RPS23复合物来抑制MSC衰老的分子机制,其中Pro62的羟基化状态是这一过程中的关键调节节点。
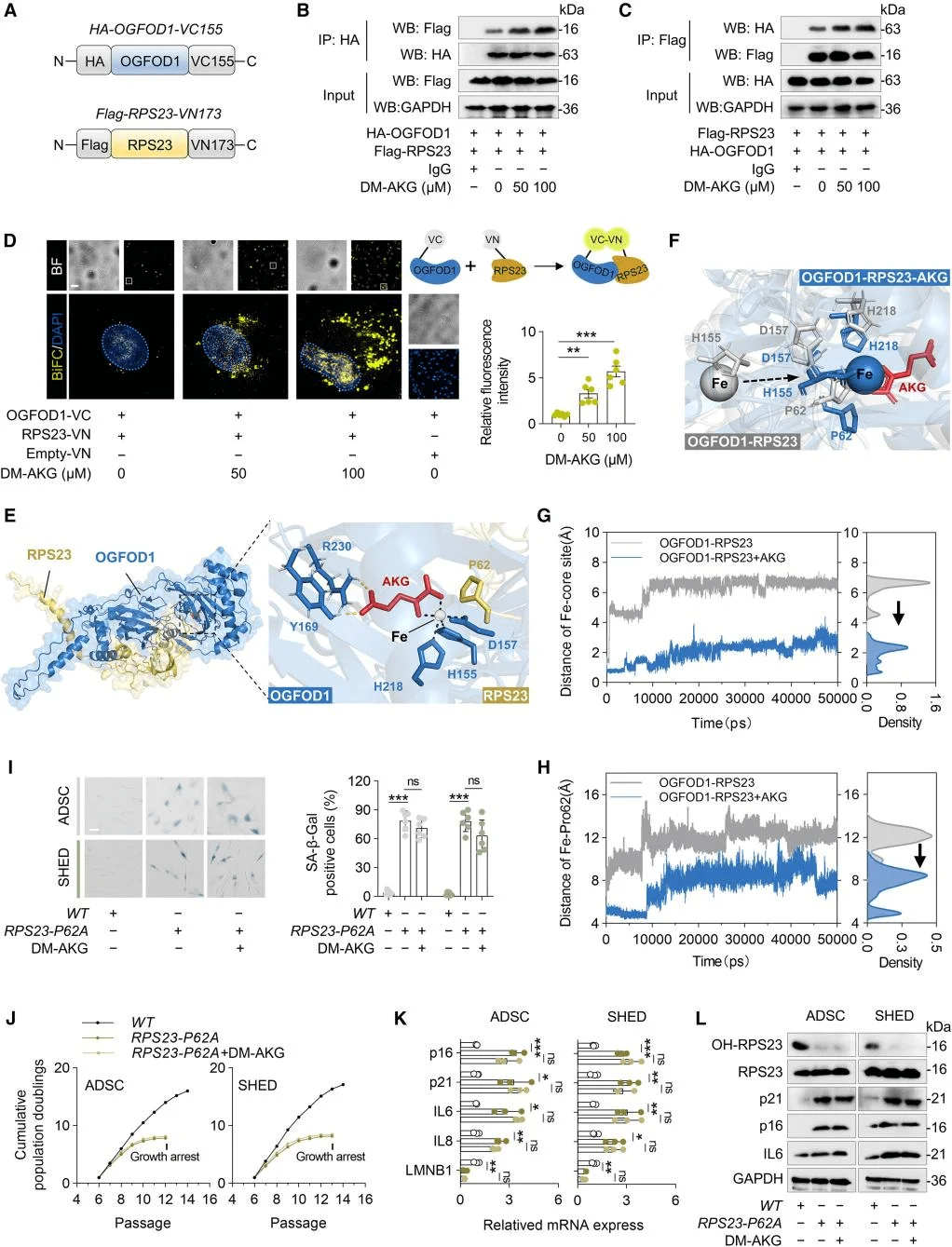
AKG通过促进OGFOD1-RPS23复合物的形成来提高RPS23-Pro62的羟基化水平
鉴于AKG能显著增强MSCs的增殖活性,研究人员研究了TCA循环中能够产生AKG的蛋白质。随着MSC传代次数的增加,衰老标志物p16和p21的表达显著上升。在TCA循环中参与AKG生成的蛋白质中,只有IDH1的表达量明显下降。随后,研究人员通过IDH1的表达探究了IDH1对AKG生成和MSC衰老的影响,并进一步观察了作为IDH1的同工酶IDH2和IDH3的作用。研究结果证实了IDH1在MSCs中发挥衰老保护因子的作用,并表明由于IDH1表达下降导致的AKG水平降低是MSCs衰老的关键诱因。
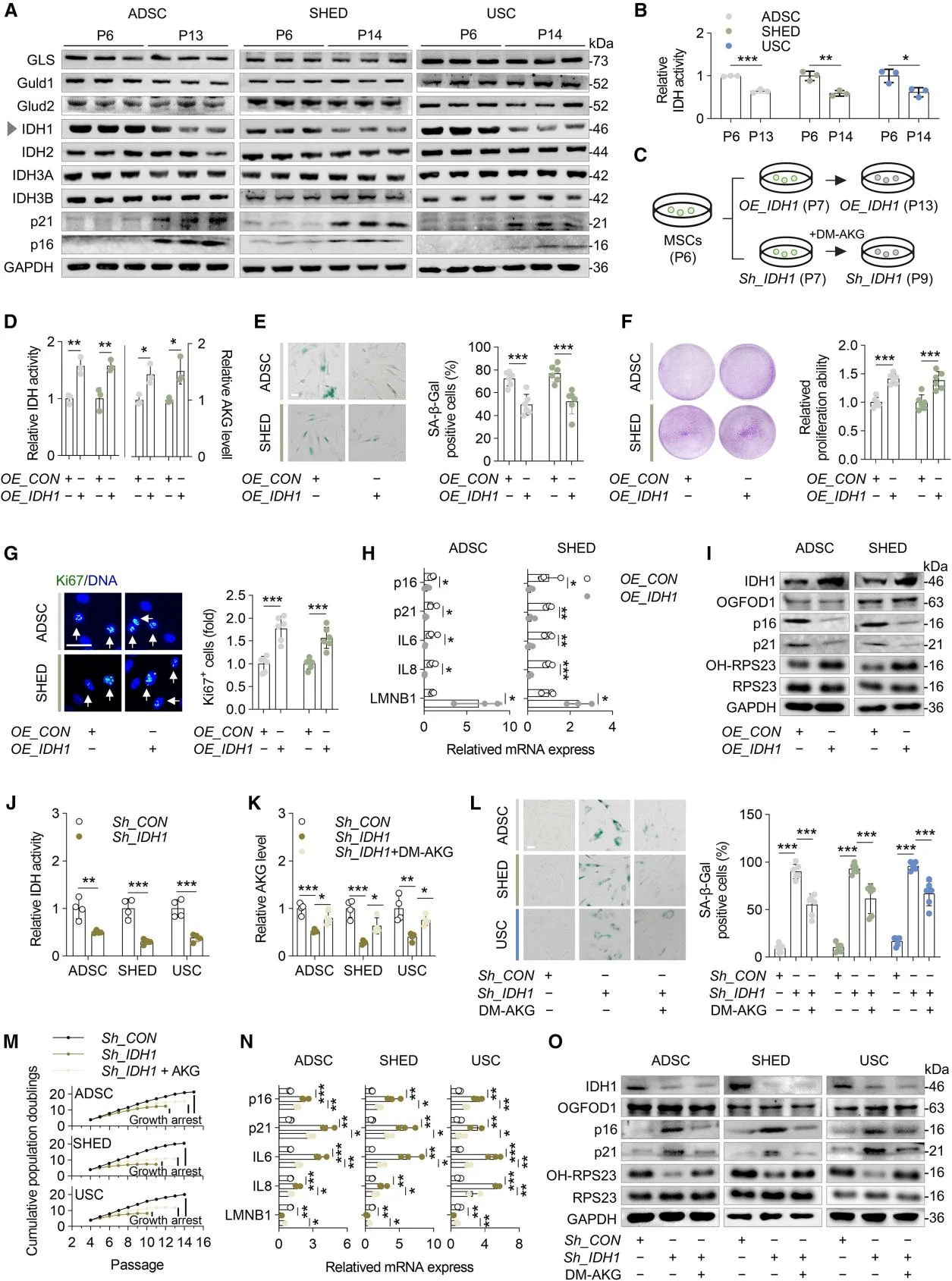
IDH1调节AKG的合成,影响MSC的衰老
细胞增殖的加速通常依赖于蛋白质合成速率的提升。特别是干细胞,它们高度依赖高水平的蛋白质合成来维持自我更新和分化潜能。研究结果显示,随着传代次数的增加,脂肪源性干细胞(ADSCs)的蛋白质合成速率显著下降,而AKG可以显著提高合成速率。此外,蛋白质合成的翻译保真度下降在衰老过程中扮演着关键角色,而不仅仅是减缓蛋白质合成的速度。衰老的MSCs中蛋白质聚集体的形成显著增加,而AKG能够有效缓解这一现象。有趣的是,尽管AKG可以逆转IDH1敲低导致的蛋白质聚集体增加,但对于由OGFOD1敲低或PRS23-Pro62突变引起的蛋白质聚集体积累,AKG则没有效果。为此,研究人员设计了一个双荧光素酶报告系统,用于检测MSCs中的常见翻译错误和终止密码子通读,并使用诱导MSCs中翻译错误的药物巴龙霉素验证该系统。结果表明,巴龙霉素引起的蛋白质稳态破坏和MSC衰老不受组蛋白甲基化的影响,且不能通过高浓度的AKG逆转。这表明蛋白质稳态失衡是MSC衰老的一个独立因素,而蛋白质稳态的调节在介导AKG延缓MSC衰老的能力中起着关键作用。
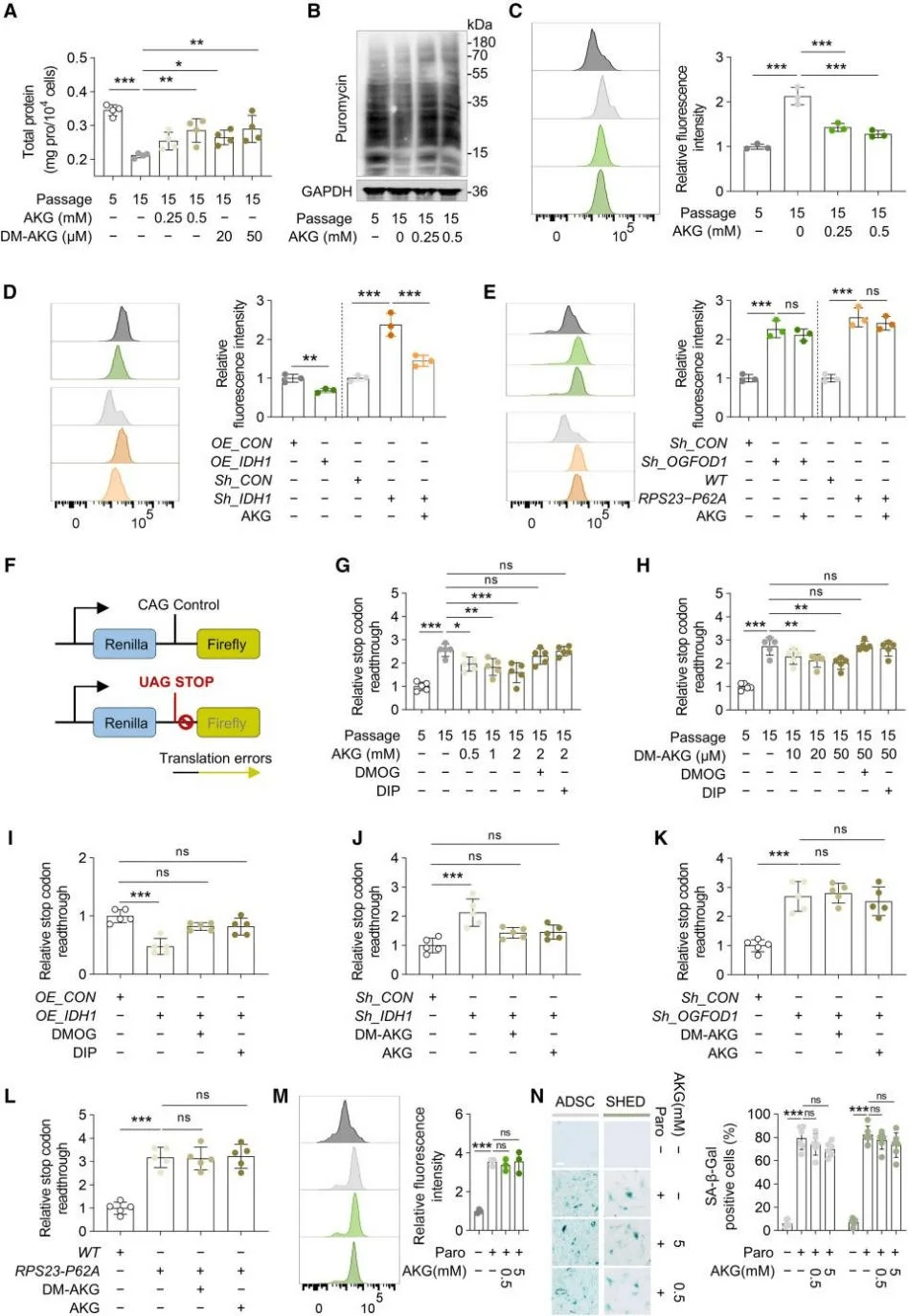
AKG通过OGFOD1-OH-RPS23提高了MSCs中蛋白质的翻译准确性
由于IDH1的激活能够促进AKG的生成,研究人员接下来聚焦于以IDH1激活为重点的抗衰老策略。研究人员使用先前发现的天然存在IDH1激动剂灯盏乙素(Scu),Scu能够提高ADSCs中的IDH酶活性,并恢复衰老MSCs中的AKG水平。Scu通过激活IDH1-AKG-RPS23信号轴来促进MSC增殖和延缓衰老的潜力。为模拟体内代谢环境,研究人员开发了肠屏障-肝脏类器官微流控系统,证实Scu经肠道吸收和肝脏代谢后仍能有效抑制MSCs衰老。老年小鼠体内实验进一步验证Scu可提高AKG浓度、增强RPS23羟化修饰,并显著改善衰老相关表型,表明IDH1小分子激动剂在干预衰老及相关疾病中具有潜在的应用价值。
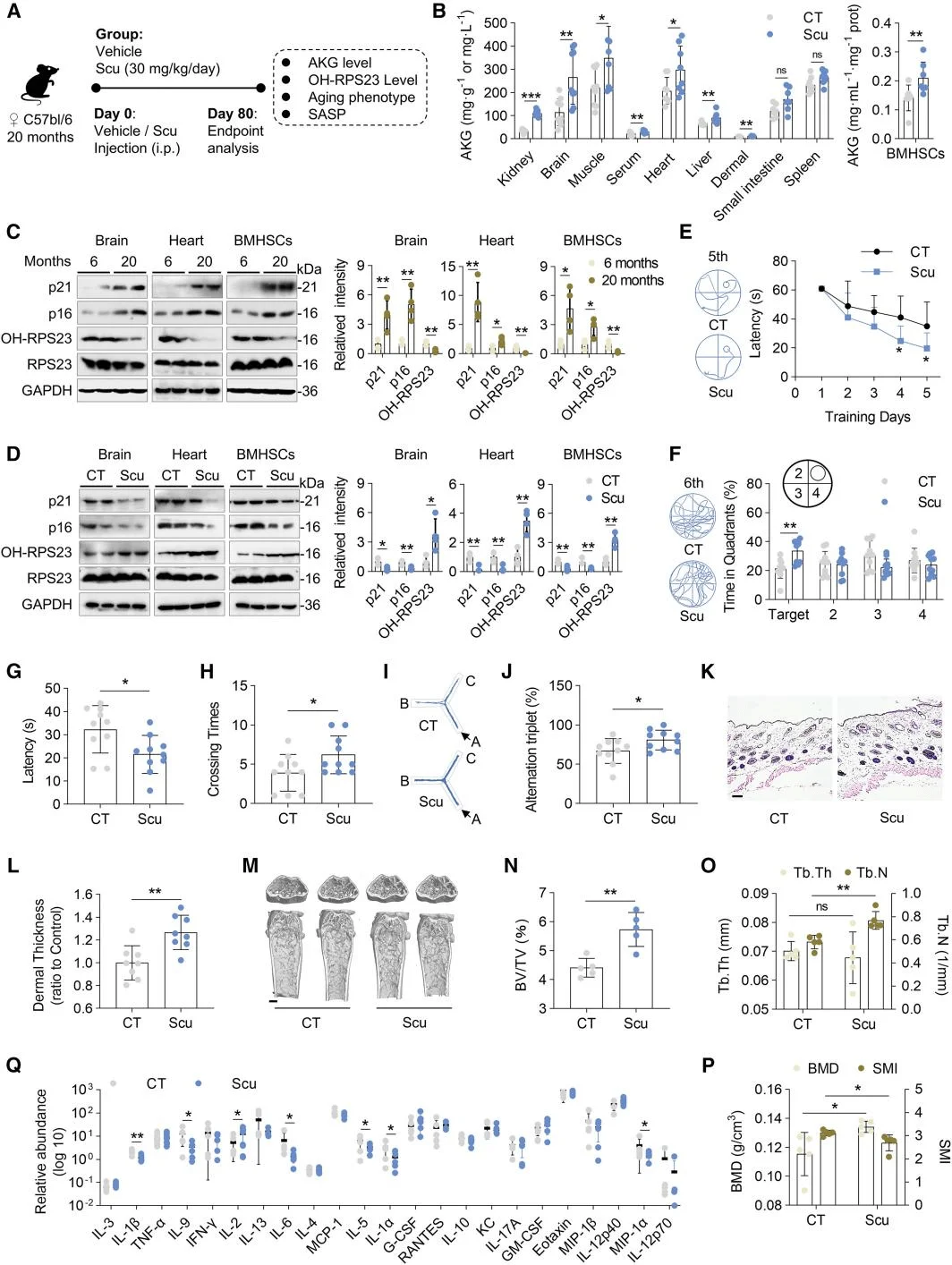
IDH1激动剂Scu改善了老年小鼠的衰老表型
综上所述,该研究揭示了AKG通过靶向RPS23来维持蛋白质稳态,从而促进MSCs的自我更新并延缓细胞衰老。这些发现整合了衰老过程中的两个关键因素——代谢失调和蛋白质稳态的丧失,为开发潜在的抗衰老治疗方法提供了依据。
源井生物提供的支持
源井生物为本研究提供了核心支持。通过源井生物提供的人诱导多能干细胞(iPS细胞)模型,研究团队成功整合了衰老过程中的两个核心机制——代谢失调与蛋白质稳态丧失,从而揭示了它们在细胞衰老调控中的协同作用。源井生物的关键助力不仅推进了对衰老机制的深入理解,也为开发潜在的抗衰老治疗策略筑牢了核心基础。
欢迎联系我们,获取更多专业支持与解决方案>>
参考文献
Cui Z, Li J, Li C, et al. Identifying the target, mechanism, and agonist of α-ketoglutaric acid in delaying mesenchymal stem cell senescence[J]. Cell Reports, 2025, 44(7).
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划





























 联系电话
联系电话
 投诉电话
投诉电话
