 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
CRISPR文库发现胶质瘤潜在临床靶点

在脑肿瘤的复杂生物学机制领域中,CRISPR文库是个重要的工具,可以帮助研究者发现潜在的靶点。本文以CRISPR文库在高等级胶质瘤研究中的应用为例,我们可以深入了解CRISPR文库如何助力脑肿瘤研究领域获得突破性进展。
研究背景
高等级胶质瘤(HGG)是致命的原发性脑癌,儿童和青少年癌症相关死亡的主要原因之一。其中,弥漫性半球胶质瘤H3G34突变型(DHG-H3G34)主要见于青少年,占儿童或青少年HGG的30%以上,但相对研究较少。
摘要
IlonLiu等人通过全基因组CRISPR-Cas9筛选,识别对DHG-H3G34细胞生长和存活至关重要的基因,从而发现潜在的临床可操作靶点。为了更全面地了解DHG-H3G34肿瘤细胞的基因依赖性和脆弱性,作者进行了两次不同的全基因组文库筛选和数据分析。
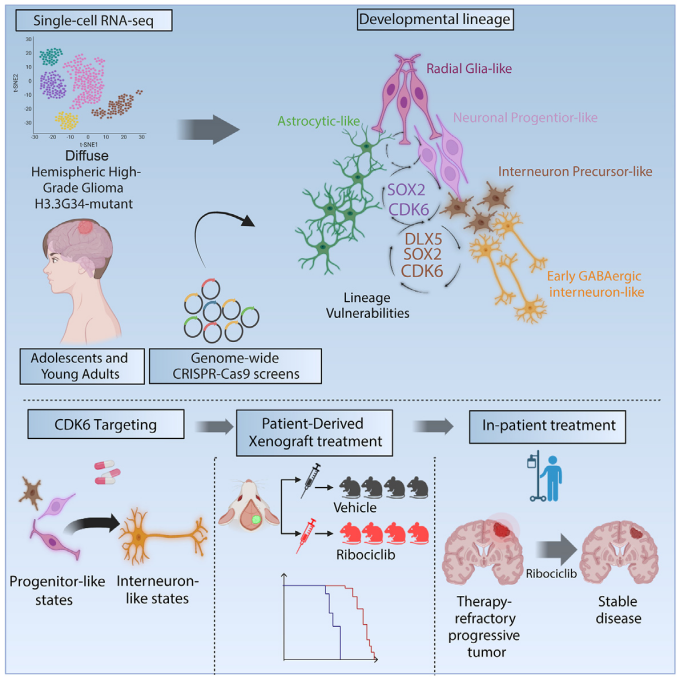
CRISPR文库发现SOX2和CDK6基因
1.OPBG-GBM-001细胞文库
文库类型:人全基因组敲除文库(GeCKOv2 library)
转导细胞:OPBG-GBM-001(源自H3.3G34R患者)
筛选方法:收集T0样本并储存在-80°C用于后续处理。剩余细胞在没有抗生素的情况下培养至第10次倍增(30天),每2-3天添加新鲜培养基并每周传代一次。比较不同时间点(T0与T8、T0与T10)的基因表达情况,以确定基因的必要性。
2.KNS42细胞文库
文库类型:人全基因组敲除文库(Avana library)
转导细胞:KNS42细胞
筛选方法:细胞在没有选择的情况下传代21天,保持每个sgRNA500倍的覆盖。从终点细胞沉淀中提取基因组DNA,进行PCR扩增并使用标准Illumina机器和协议进行测序。
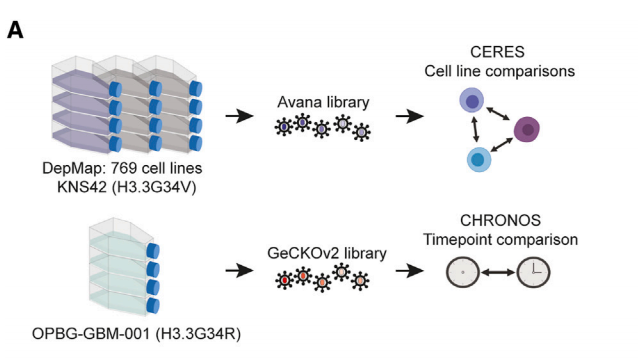
图1 全基因组CRISPR-Cas9筛选示意图。
将两个CRISPR文库筛选所得的基因投射到患者DHG-H3G34的单细胞RNA测序数据上,观察到大多数命中基因在中间神经元谱系发育的祖细胞样细胞中显著富集,而几乎没有基因命中与AC样/MES样细胞程序相关,这表明DHG-H3G34主要依赖于中间神经元发育状态相关的基因特征。在两个筛选中,SOX2和CDK6基于排名基因效应得分成为最重要的命中基因,并且在DepMapconsortium评估的769种泛癌细胞系中显示出高度的选择性。
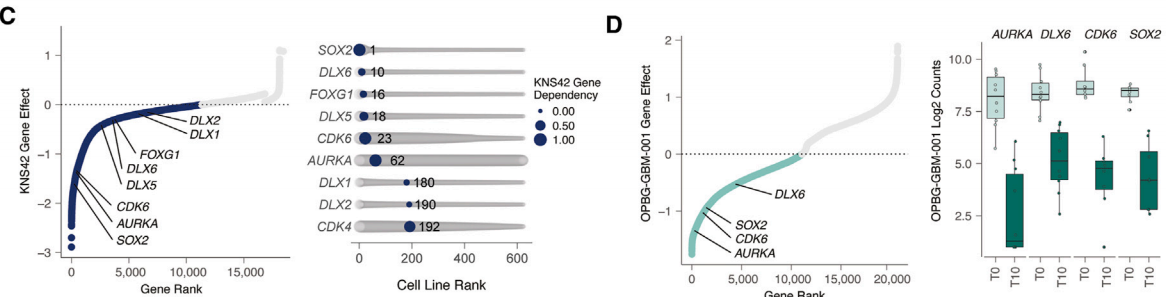
图2 KNS42筛选的基因排名(C);OPBG-GBM-001筛选的基因排名(D)
CDK6基因功能验证
为了将研究结果推向更直接的临床可转化性,作者验证FDA批准的药物可用的靶点——CDK6,与700种泛癌细胞系相比,它也是DHG-H3G34最特异性的靶标之一。在体外验证了,多种DHG-H3G34细胞敲除CDK6基因后DHG-H3G34细胞的活力显著下降。
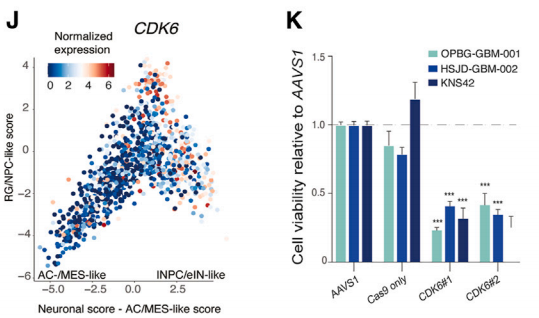
图3 敲除筛选的基因后细胞活力显著下降
通过两种方法对CDK6耗竭进行了体内验证。在CDK6敲除后,将BT690-DHG-H3G34肿瘤细胞异种移植到小鼠体内;在BT690异种移植物形成肿瘤后,诱导shRNA介导的CDK6敲低。这两种方法均显著降低了肿瘤生长,并延长了总生存期。
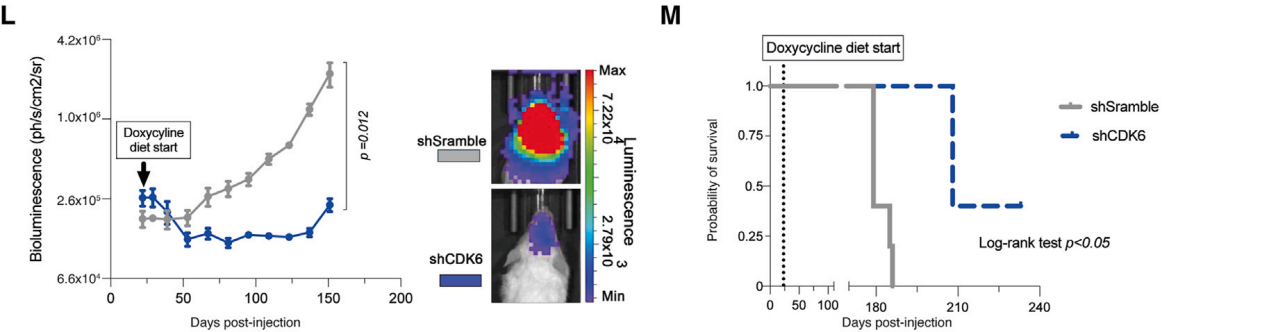
图4 DHG-H3G34肿瘤在基因敲除情况下的生长变化
此外,CDK6在肿瘤细胞中通过表观遗传机制上调表达,其特异性降解剂和CDK4/6抑制剂(如Ribociclib)能够有效地减少肿瘤生长,并延长异种移植小鼠的存活期。在临床病例中,一名DHG-H3G34患者使用Ribociclib治疗后,病情稳定了18个周期。
结论
本研究揭示了DHG-H3G34沿着假定的发育层次结构重现了中间神经元谱系发育的各个阶段,并从中衍生和验证了独特的靶点。通过整合全基因组CRISPR-Cas9筛选和单细胞RNA测序结果,表明DHG-H3G34依赖于其中间神经元谱系层次结构中祖细胞样区室的基因,靶向CDK6能够改变其特征性的发育生物学,为进一步的转化研究铺平了道路。
小结
不难看出,CRISPR文库筛选技术在脑肿瘤学领域的应用,不仅为研究者提供了一个强大的基因编辑工具,还为理解肿瘤的复杂性、发现新的治疗靶点、推进个性化医疗的发展以及加速转化研究提供了宝贵的资源。
参考文献:
Liu, Ilon et al. “GABAergic neuronal lineage development determines clinically actionable targets in diffuse hemispheric glioma, H3G34-mutant.” Cancer cell, S1535-6108(24)00305-2. 27 Aug. 2024, doi:10.1016/j.ccell.2024.08.006

