CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
IF=10.7|m6A相关基因遗传缺陷促进ALS病理通路

肌萎缩侧索硬化症(ALS)是一种不断进展的累及上、下运动神经元的退行性神经疾病,目前仍缺乏有效治疗手段。虽然散发型患者的病因仍不明确,通过对家族型患者的研究,越来越多的ALS基因得以发现(如C9orf72、TARDBP、SOD1、FUS)。这些基因的突变可影响不同的生物学通路,包括RNA代谢、蛋白质稳态或自噬、细胞骨架或转运、线粒体功能和DNA修复。RNA代谢异常为ALS的重要发病机制之一,与多种已知的ALS突变密切相关。由于真核细胞中广泛存在的m6A甲基化修饰可显著影响RNA的成熟、稳定、出核,以及转录效率,进一步探究m6A相关基因的功能异常在ALS中的作用将有助于提高对该疾病的认识。
近日,北京协和医院崔丽英课题组在MedComm(IF:10.7)发表了题为“Loss-of-function variants in RNA binding motif protein X-linked induce neuronal defects contributing to amyotrophic lateral sclerosis pathogenesis”的研究论文。该研究采用源井生物构建的稳转过表达人源TDP43Q331K突变株,以及在此基础上构建的Rbmx干扰NSC-34细胞系,阐释了Rbmx功能缺失在ALS相关病例过程中的机制作用。
本研究中,作者首先在ALS患者队列中分析了已知m6A修饰相关基因的突变图谱,并通过突变负荷等分析与种族配对的健康人队列比较,发现位于RNA结合蛋白RBMX上的致病突变与患者较差的临床预后有潜在的相关性(图1)。
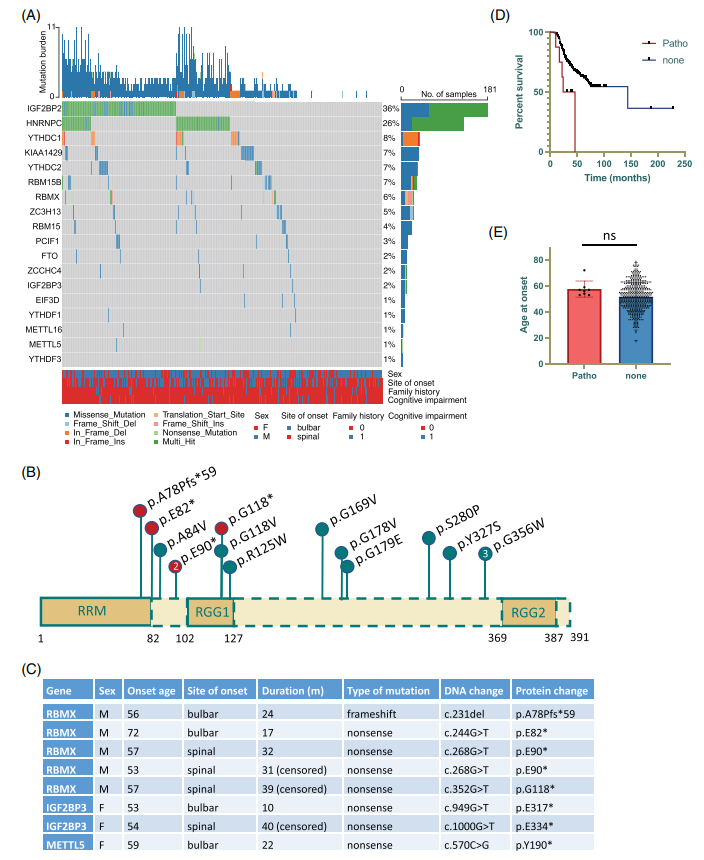
图1 m6A调节因子的遗传变异及其在肌萎缩侧索硬化症(ALS)患者中的临床意义
作者使用了过表达人TDP43突变的NSC-34细胞,并在此基础上通过shRNA稳定敲低细胞中Rbmx基因的表达。免疫荧光与qPCR实验表明,该基因的功能缺失可通过强化p53相关通路,引起细胞凋亡(图2)。
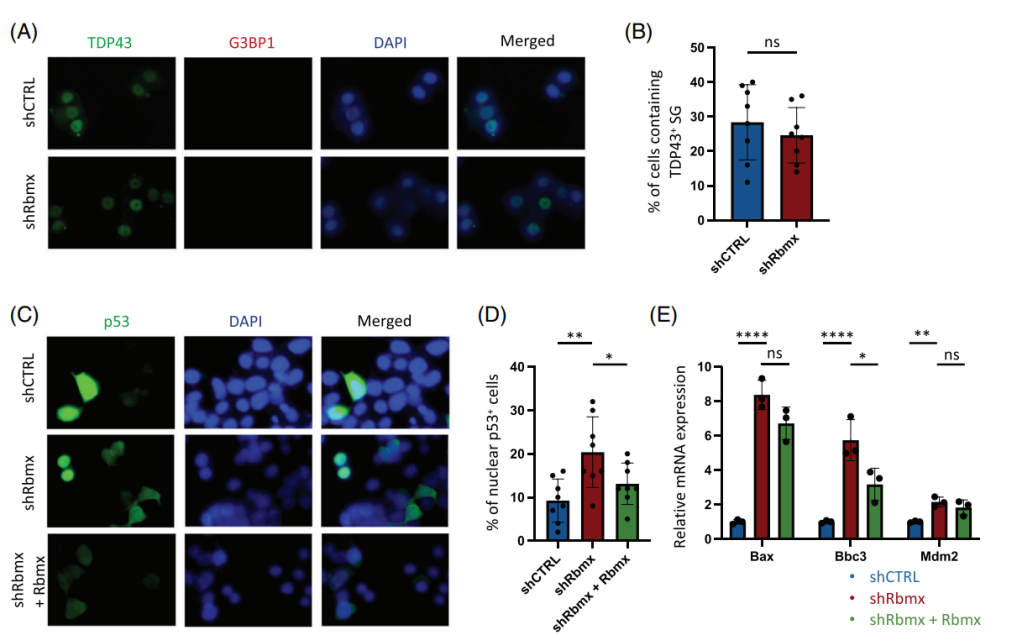
图2 在NSC-34细胞中降低Rbmx表达诱导p53途径的激活。
作者进一步使用ALS患者来源的iPS运动神经元,通过siRNA敲低RBMX基因。与在细胞系中的发现一致,RBMX基因的表达缺失可在人源细胞中产生相似效果,并可引起运动神经元形态学的异常与p53通路激活(图3)。
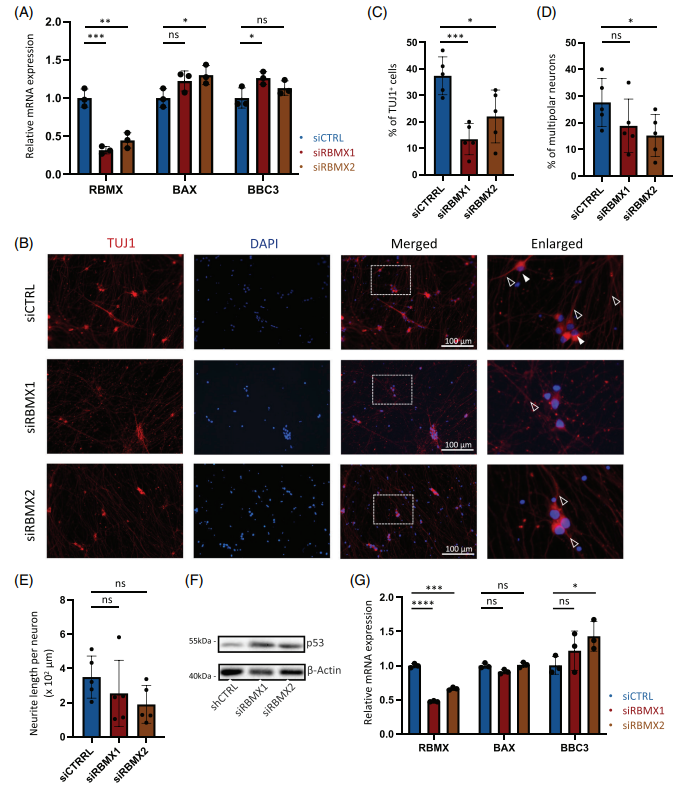
图3 RBMX在人类细胞系和ALS运动神经元中的敲低诱导p53激活和神经元缺陷。
最后,作者联合分析了HEK293T细胞敲低RBMX后的转录组与ALS患者运动皮层单细胞转录组数据,发现受RBMX调控的基因在人脑中在与发病机制相关的Excitatory Neuron中富集表达。与健康人相比,这些RBMX下游基因平均表达水平在ALS来源细胞中显著降低,且这些受RBMX影响的基因主要富集在ALS相关的生物学通路上。此外,通过LASSO回归和随机森林等分析方法,作者亦发现已知ALS相关的基因(如TBKBP1)在RBMX相关致病机制中起到了更为关键的作用(图4)。
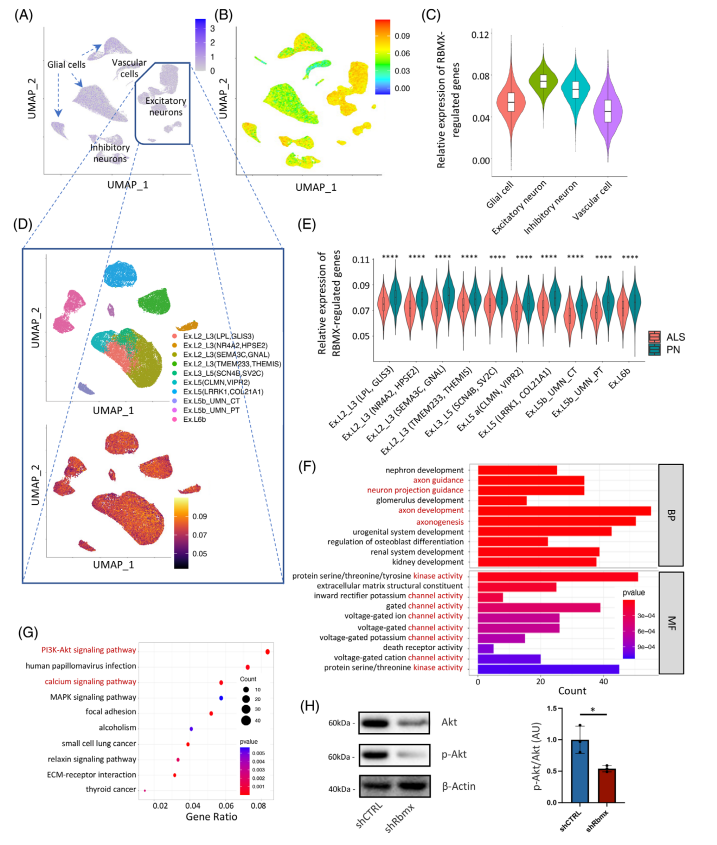
图4 RBMX在初级运动皮层的表达及其丰富的功能途径。
综上,RBMX介导的转录后调控与ALS的病理生理机制密切相关。该研究展示,RBMX表达的缺失可以引发神经元缺陷,且该机制倾向于影响初级运动皮层中兴奋性运动神经元的生存,促进ALS相关的病理通路。进一步研究m6A相关基因的功能异常有望为ALS提供新的发病机制的见解。
参考文献:
He, Di et al. “Loss-of-function variants in RNA binding motif protein X-linked induce neuronal defects contributing to amyotrophic lateral sclerosis pathogenesis.” MedComm vol. 5,9 e712. 10 Sep. 2024, doi:10.1002/mco2.712