看CRISPR/Cas9基因编辑技术如何玩转药物靶点(三)——离子通道


看CRISPR/Cas9基因编辑技术如何玩转药物靶点(三)——离子通道
离子通道是由细胞膜上的跨膜蛋白组成的亲水性蛋白质微孔道,其可以调节膜内外的离子浓度差,进而调节细胞功能。例如,一些离子通道控制着细胞膜内外的离子浓度差,以此调节神经传导、心肌收缩等。另外也有分布在细胞器膜上的离子通道,这些通道在溶酶体、线粒体膜上,能够控制细胞代谢等功能。[1]
离子通道在人体中发挥着重要作用,且易受到药物干预,是目前药物开发的重要靶标。如今,离子通道靶向药被广泛用于治疗心律失常、高血压、局部麻醉、疼痛、中风、癫痫、抑郁、躁郁症、囊肿性纤维化、心律失常、COPD、自身免疫疾病和糖尿病等一系列疾病。[2] 目前很多关于离子通道的研究,都是基于动物水平进行的。但是,其中一部分已经研究透彻的离子通道相关课题,完全可以利用基因敲除细胞系进行实验。通过细胞实验,能够高效的得出可靠结论。比如,当探索离子通道在面对某些应激情况的作用时,细胞系便能够给予研究者造模的空间。研究者能够利用敲除的细胞系进行应激造模实验,然后通过与wt细胞作对比,观察敲除离子通道之后细胞的活力或细胞内离子浓度,以此推断离子通道对细胞稳态的重要性。此外,离子通道敲除细胞系更重要的作用是对药物进行大规模的筛查分类。利用特定离子通道的敲除细胞,我们能快速判断药物的作用位点,快速并且可靠地分类出能够影响离子通道活性和不影响离子通道活性的药物。当然,在研究离子通道机制时,敲除细胞系也是一种可靠的实验工具。
下面我将给大家介绍几篇利用离子通道相关基因敲除稳转细胞系的研究实例。
1. 敲除TRPV4可阻止IL8的表达水平,挽救拉伸引起的腰痛
第一篇“Identification of the TRPV4 ion channel as a mechanotransducer and therapeutic target in low back pain”是鉴定TRPV4离子通道作为腰痛的机械传感器和治疗靶点的研究。[3]作为一种跨膜蛋白的TRPV4,属于transient receptor potential Vanilloid(TRPV)家族。它可以对温度、化学物质和机械刺激做出反应,并在多种细胞和组织中表达。除此以外,TRPV4 还可以调节细胞内的钙离子浓度,并参与细胞凋亡、细胞增殖、细胞膜电位调节和血管内皮功能的调节等过程。作者利用CRISPR/Cas9技术成功构建TRPV4敲除AF细胞系,研究了基因的表达、炎症介质的释放和MAPK途径的激活。结果显示敲除TRPV4能阻止拉伸诱导的IL8和IL6基因的表达。由此,作者为TRPV4在人AF细胞中可能是通过p38传递超生理机械信号到炎症信号提供了新的证据。而药理抑制或基因编辑靶向TRPV4可作为解决成纤维细胞损伤病人的椎间盘源性腰痛的潜在治疗策略。
源井拥有TRPV4等超3000种1周达敲除细胞现货,多种离子通道敲除细胞、MAPK/ERK/AKT/mTOR等26条信号通路敲除细胞均在列,优质纯合低至¥8000!欢迎点击入库搜索>>
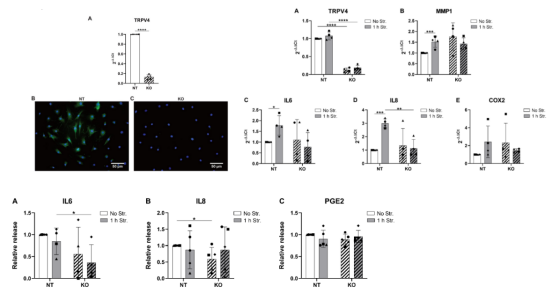
图1. TRPV4敲除细胞相较于WT细胞表现出相关基因表达情况
2. 通过敲除KV1.3,研究了Loureirin B对Ca2+流入和细胞因子分泌影的作用
第二篇“Loureirin B exerts its immunosuppressive effects by inhibiting STIM1/Orai1 and KV 1.3 channels” [4]通过CRISPR/Cas9系统敲除KV1.3离子通道(KCNA3基因),探索了一种离子通道干预药物Loureirin B(龙血素B)对Ca2+流入和细胞因子分泌的影响。在免疫系统中,作为主要存在于T细胞膜上的钾离子通道,KV1.3通道可以调节T细胞的活化状态,并通过调节细胞内Ca2+浓度来调节免疫反应。该研究团队发现在Jurkat细胞中敲除KV1.3会降低Ca2+流入和IL-2分泌,但不会消除Loureirin B对其影响。
源井可提供Jurkat细胞基因敲除服务,总结超5000例细胞基因编辑成功经验,创新研发出能提高基因编辑效率达10倍的CRISPR-U™技术,搭配精细化细胞培养体系及差异化转染体系,保证交付优质纯合!200+细胞随心构,定制快至4周,点击了解详情>>
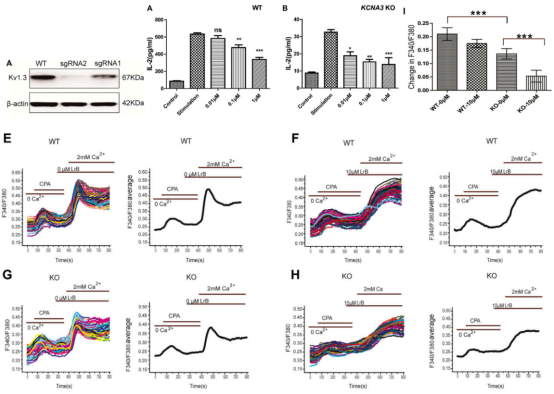
图2. Loureirin B抑制KCNA3敲除细胞的IL-2分泌并阻断胞内Ca2+的再摄取
在实验中,研究人员进一步证明Loureirin B可以通过抑制STIM1/Orai1来减少Ca2+流入和IL-2分泌。这些发现表明,LrB通过抑制KV1.3和STIM1/Orai1渠道来实现免疫抑制作用。
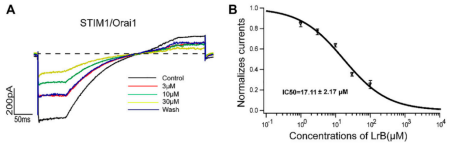
图3. Loureirin B以浓度依赖性方式抑制 STIM1/Orai1 电流
3. CFTR敲除细胞验证CFTR通道在骨细胞中的Cl-外排介导作用
CFTR是一种调节上皮组织中电解质和水转运的阴离子通道,其突变易引起囊性纤维化病变。先前有研究表明CFTR还与机械敏感有关,就此“Channel function of CFTR in bone cells for microenvironment homeostasis”5研究了CFTR在骨细胞中的功能,揭示了CFTR对骨细胞微环境的调节机制,为骨细胞相关疾病的治疗提供了新策略。
研究团队发现MLO-Y4细胞经CFTR抑制剂处理后胞内Cl-浓度和去极化膜电位会增加,他们猜测CFTR或许介导了骨细胞中的Cl-外排。他们利用CRISPR/Cas9技术成功构建出了CFTR敲除MLO-Y4细胞系。对CFTR基因敲除细胞系进行抑制剂处理后,检测胞内Cl-浓度和膜电位,发现CFTR基因敲除细胞系胞内Cl-浓度和膜电位的增加更大,证实了CFTR介导骨细胞中的Cl-外排。此外,通过比较CFTR敲除前后MLO-Y4细胞碱化后胞内pH恢复速率发现,CFTR能促进细胞分泌HCO3-,提示CFTR通过介导HCO3-外排调节骨细胞中的pH,为全身性酸中毒引起的pH变化导致的严重骨质疏松症、骨软化症治疗提供理论基础。
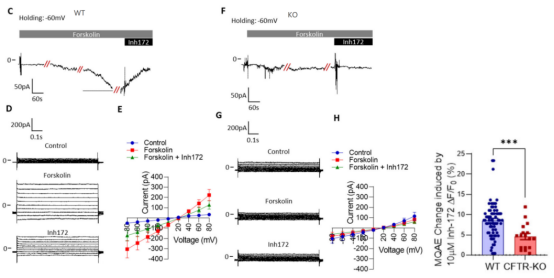
图4. CFTR敲除MLO-Y4细胞证明CFTR的促Cl-外排作用
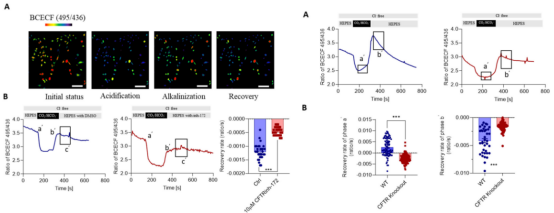
图5. CFTR抑制剂对野生型及CFTR敲除细胞HCO3-分泌和pH维持的影响
以上是近两年来发表的应用离子通道敲除细胞系进行药物干预机制、离子通道作用机制研究的3篇文章。当研究未知离子通道时,研究者不确定敲除通道基因后是否会导致细胞间互作改变,会愿意花费漫长时间构建动物模型。
但是,对于已经被大家熟知的离子通道,我们便没有必要等待漫长的动物模型构建的周期。我们可以利用CRISPR/Cas9技术直接在目标细胞系上敲除或敲入离子通道,进行细胞层面实验。特别是一些需要长时程检测离子通道活性的实验,离子通道敲除细胞系更能成为比较理想的实验材料。若采用动物模型,我们需要对离体组织进行离子通道的活性检测,即使将生命力较为顽强的脑组织放入维持液中,其理想的检测窗口也只能延长到4小时,更不用说那些更加脆弱的心肌组织。
此外,离子通道敲除细胞系是对治疗药物进行初期筛选最好的工具。简要来说,其有两种优势,第一是细胞具有良好的稳定性,并且重复性高,相较于动物实验,细胞实验成本更低,实验周期更短。另外一点就是,进行细胞实验时,我们可以把人类的肿瘤细胞作为实验工具,这样便可以保证离子通道的蛋白结构的同源性,为药物筛选的结果提高可信度。
源井敲除细胞现货库拥有KCNA3、STIM1、CFTR等多种离子通道敲除细胞,超3000种优质纯合速递快至1周,仅需¥8000,欢迎入库搜索>>
精心研发出提高编辑效率达10倍的CRISPR-U™技术,源井可提供快至4周的敲除细胞定制服务,超200种细胞成功编辑经验,交付成果有保障!点击了解服务详情>>
参考文献:
1 Ohya, S., Kito, H., Hatano, N. & Muraki, K. Recent advances in therapeutic strategies that focus on the regulation of ion channel expression. Pharmacol Ther 160, 11-43, doi:10.1016/j.pharmthera.2016.02.001 (2016).
2 Boyden, P. A. & Jeck, C. D. Ion channel function in disease. Cardiovasc Res 29, 312-318 (1995).
3 Cambria, E. Identification of the TRPV4 ion channel as a mechanotransducer and therapeutic target in low back pain, ETH Zurich, (2021).
4 Shi, S. et al. Loureirin B Exerts its Immunosuppressive Effects by Inhibiting STIM1/Orai1 and KV1. 3 Channels. Frontiers in Pharmacology 12, 1298 (2021).
5 Zhang, X. Channel function of CFTR in bone cells for microenvironment homeostasis. (2022).










