胰腺癌治疗新思路——靶向USP8增强PD-L1免疫疗法敏感性!


胰腺癌治疗新思路——靶向USP8增强PD-L1免疫疗法敏感性!
程序性死亡受体1(PD-1)的一个配体PD-L1是T细胞识别敌我的关键凭证。正常情况下,T细胞通过表面PD-1受体识别组织细胞上的PD-L1避免杀伤自身组织细胞,但有些肿瘤细胞表面也存在PD-L1——它们可以借助这张“绿卡”逃避免疫细胞的攻击,也就是我们所说的免疫逃逸。
想要阻止免疫逃逸最直接的方法就是阻断PD-1和PD-L1的结合,这种抑制策略具有广谱抗肿瘤性,已在乳腺癌、黑色素瘤、非小细胞肺癌等多种类型的癌症免疫治疗中获批,且该类型免疫抑制剂的应用大幅提高了患者5年生存率。但胰腺导管癌的肿瘤微环境有着很强的免疫抑制性,PD-1/PD-L1阻断法对胰腺导管癌的疗效不佳。
近日,浙江大学的白雪莉、梁廷波发现靶向泛素特异性蛋白酶8(USP8)能增加胰腺癌对PD-L1免疫疗法的敏感性,联用USP8抑制剂和PD-L1抑制剂可有效抑制胰腺肿瘤生长,并在Cell Death & Differentiation在线发表题为“Targeting ubiquitin-specific protease 8 sensitizes anti-programmed death-ligand 1 immunotherapy of pancreatic cancer”的研究论文,为胰腺癌治疗提供了新思路。

PD-L1受E3连接酶和去泛素化酶介导的泛素/蛋白酶体通路调控,提示PD-L1泛素化可能是降低肿瘤免疫抑制的突破口。该团队此前已证明抑制泛素-蛋白酶体途径介导的PD-L1降解将增强癌细胞的免疫逃逸能力,且发现USP22可以通过去泛素化增加PD-L1的稳定性从而帮助肝癌细胞的免疫逃逸,说明靶向去泛素化酶可能抑制癌细胞的免疫逃逸。
与USP22一样,USP8也是一种去泛素化酶,可以催化泛素分子的释放保护蛋白质免受降解,在细胞增殖、细胞周期、蛋白质表面定位等方面具有重要作用,且有许多研究表明其发生突变或表达上调会导致癌症发生、肿瘤迁移,不仅如此,USP8还对肺癌、胃癌、乳腺癌等多种类型肿瘤的多种信号通路产生影响,导致患者生存率低下。此前尚未有报道,USP8在胰腺癌中的作用,白雪莉、梁延波等人对此展开了研究。经生物信息学分析得出,与正常组织相比,USP8在胰腺癌组织中高表达(图1b),且临床胰腺癌患者的USP8表达与肿瘤-淋巴结转移阶段有着显著相关性,提示USP8可能是胰腺癌的潜在抗肿瘤免疫治疗靶点。
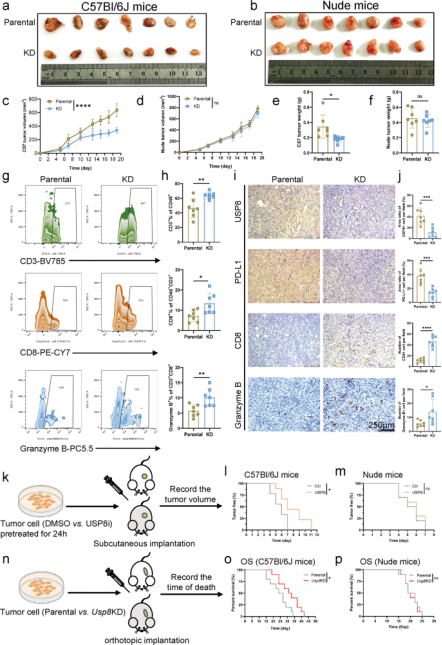
图1. USP8在胰腺癌肿瘤组织中高表达
进一步研究发现USP8的表达与多种已知的免疫抑制因子呈正相关。研究人员使用USP8敲低稳转KPC细胞进行小鼠原位成瘤,发现在免疫功能正常的小鼠中,USP8敲低KPC细胞成瘤比亲本KPC细胞成瘤的肿瘤要轻和小(图2a)。且经USP8敲低KPC细胞成瘤的免疫正常小鼠的生存期较亲本KPC细胞成瘤的免疫正常小鼠长。这些现象在免疫缺陷小鼠中是不存在的,说明USP8缺失发挥的抗肿瘤作用是免疫依赖性的。
为评估抑制USP8对胰腺癌肿瘤发生发展影响,研究人员对小鼠进行皮下注射DMSO或USP8特异性抑制剂预处理的胰腺癌细胞,发现USP8抑制剂预处理可以减少免疫功能正常小鼠的肿瘤发生(图2l)。不仅如此,对构建的胰腺癌肿瘤模型下小鼠进行给药处理发现,USP8抑制剂组的肿瘤大小、体积、重量都明显减小。说明USP8与胰腺癌肿瘤的发展、迁移、侵袭有关,是潜在的抗肿瘤免疫治疗靶点。
源井可提供USP8 KO细胞现货、USP8 KO细胞定制、USP8敲低稳转株定制服务助力肿瘤治疗靶点研究,现货速递快至1周,定制4周起交付优质纯合,欢迎咨询我们>>
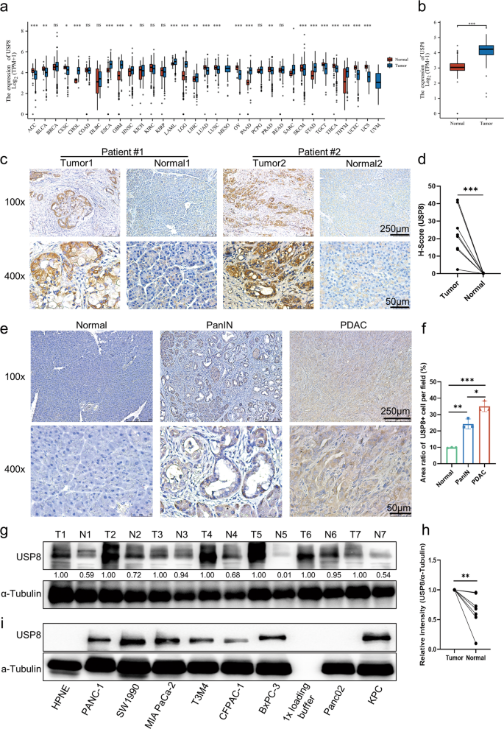
图2. USP8的缺失能显著提高抗肿瘤免疫原性
不仅如此,他们还发现USP8表达与胰腺癌组织中的PD-L1表达呈正相关,USP8在PD-L1翻译后水平通过调节其泛素化水平对其进行调控,这一结果在应用USP8抑制剂后得到了再次验证——USP8抑制剂可以显著降低PD-L1水平。体内外实验结果表明USP8是通过抑制泛素-蛋白酶体途径介导的PD-L1降解来稳定胰腺癌细胞中的PD-L1水平的,这也意味着靶向USP8能抑制胰腺癌细胞免疫逃逸。
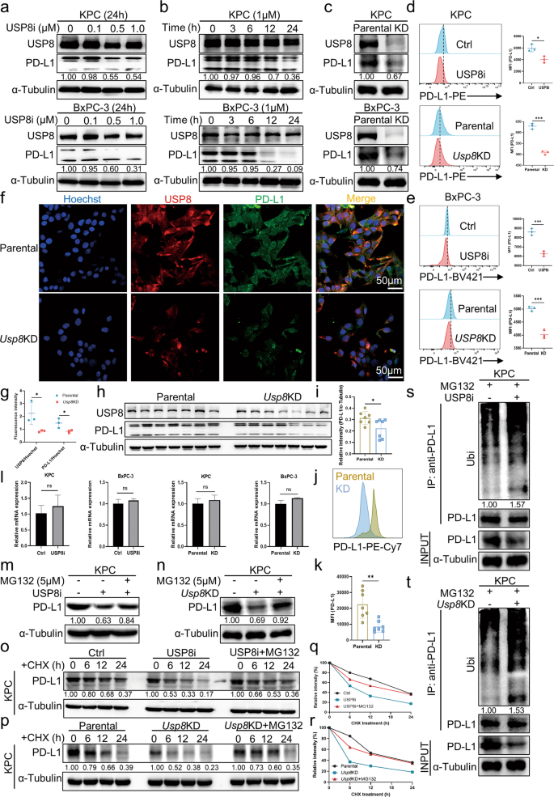
图3. USP8抑制泛素化介导的蛋白酶体对PD-L1的降解
研究人员对原位成瘤的小鼠进行了USP8抑制剂、PD-L1阻断剂联合使用,发现这样可以激活毒性T细胞、增强小鼠的抗肿瘤免疫原性,有效抑制肿瘤的生长和迁移。使用CRISPR/Cas9构建的Cd274敲除KPC细胞系进行细胞及小鼠层面研究发现,这种能引起抗肿瘤免疫的联合疗法依赖于PD-L1通路及CD8+ T细胞。
该研究揭示了胰腺癌中USP8和PD-L1的关系及作用,发现USP8抑制剂与PD-L1阻断剂的联合使用能有效抑制肿瘤生长,提出USP8不仅是胰腺癌免疫治疗潜在靶点还是提高PD-L1阻断疗法效果的关键,为胰腺癌免疫治疗策略提供新思路。
源井拥有超5000例基因编辑成功经验,已成功研发编辑效率提高10倍的CRISPR-U™技术,可提供上述敲除细胞、敲低细胞快至4周的构建服务,优质克隆交付低至¥1.28万,欢迎咨询我们>>
相关推荐:
超3000种KO细胞现货>>1周速递,低至¥8000,覆盖信号通路、疾病类型、药物靶点三大板块数千基因!
万条高切割效率gRNA载体现货5折>>与Cas9蛋白或Cas9稳转株同用即可实现高效基因敲除!
超百种Cas9稳转株>>稳定高表达Cas9蛋白,附表达报告!
Cas9蛋白>>纯度达95%,无RNase、核算内/外切酶污染!










