“制胜法宝”CRISPR强助力阿尔兹海默症(AD)研究


“制胜法宝”CRISPR强助力阿尔兹海默症(AD)研究
目前,全球至少有5000万痴呆患者,预计到2050年,将达1.52亿,其中约60%-70%为阿尔茨海默病患者。阿尔兹海默症(Alzheimer's disease,AD),亦俗称为老年痴呆症,临床上以认知功能衰退、记忆损伤为主要表现,是一种中枢的神经退行性疾病。近年来,CRISPR/Cas9基因编辑技术迅猛发展,在基础科学研究和人类疾病治疗靶点的开发上展现出巨大的潜力。长期以来,基因编辑工具CRISPR一直被视为科学家弹药库中不可或缺的制胜法宝,且被评估为研究和治疗AD的宝贵工具,主要应用于AD模型构建、致病基因筛选和靶向治疗等方面。截至目前,已有较多的研究聚焦于基因编辑技术CRISPR实现对AD的深入研究,本文精选了近年来使用基因编辑技术在AD方面的研究,供大家学习与讨论。
(1)CRISPR/Cas9 editing of APP C-terminus attenuates β-cleavage and promotes α-cleavage(Nature communications,IF=14.9196(2021))
CRISPR/Cas9基因编辑技术是一种潜在的疾病治疗工具,但依赖于使用CRISPR技术进行基因删除或突变校正的方法在实用性和范围上受到限制。首先,整个基因的删除肯定会对生理产生有害作用,这些基因通常也具有正常的生理作用;其次,旨在纠正点突变的策略仅适用于一小部分遗传的神经退行性疾病(通常< 10%的病例),在神经退行性疾病模型中的应用有所限制。基于此,美国威斯康星大学Krishanu Saha与Subhojit Roy研究员合作,使用CRISPR/Cas9技术对淀粉样前体蛋白(APP)C-端编辑来减少AD中APP-β的裂解以及Aβ的产生,提供一种通过基因编辑操纵淀粉样蛋白干预AD进程的治疗策略。
在这项研究中,研究人员在细胞和动物模型中引入了一种基于CRISPR/Cas9技术的策略,通过选择性编辑内源性淀粉样前体蛋白(APP)C末端序列以实现对淀粉样蛋白生成途径的调控。研究发现,这种编辑在人类 iPSC衍生神经元细胞中改变APP的裂解平衡,减少APP-β的裂解以及Aβ的生成,同时上调具有神经保护性的APP-α裂解。进一步的,在分析基因编辑可能的脱靶效应中发现:APP N末端和代偿性APP同系物保持完整,对体外神经生理学没有明显影响;在人类 iPSC衍生神经元细胞及小鼠脑中均未检测到任何的脱靶效应。最后,为了阐释此次基因编辑对于APP β/α调控机制,研究人员使用AAV9s进行小鼠海马体的体内注射,提出这种基因编辑策略可能通过限制APP/BACE-1在物理上的趋近来起到调控APP β/α裂解。
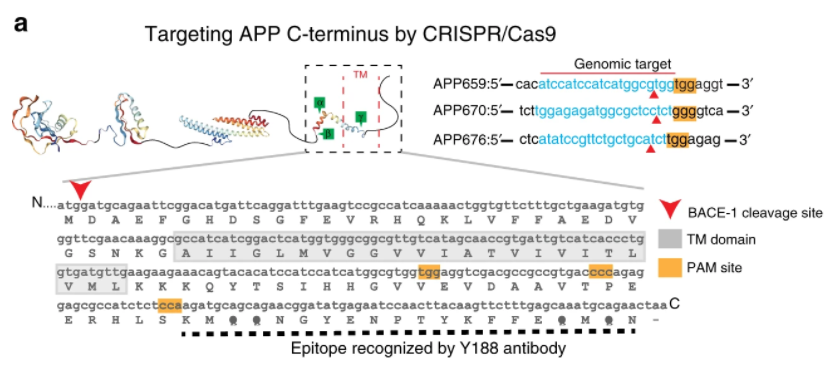
图1
(2)Gene expression and functional deficits underlie TREM2-knockout microglia responses in human models of Alzheimer’s disease(Nature communications,IF=14.9196(2020))
TREM2作为一种髓系特异性AD风险基因的发现,加速了对小胶质细胞在AD中作用的研究。虽然利用TREM2小鼠模型进行研究已提供了许多重要见解,但TREM2在人类小胶质细胞中的正常和疾病相关功能仍不清楚。为了进一步探究TREM2对人类疾病的影响,来自加利福尼亚大学尔湾分校的Mathew Blurton-Jones教授团队对人类小胶质细胞中TREM2的功能进行了研究,并在Nature Communications国际著名杂志上发表了该研究成果。
为了揭示TREM2在人类疾病中的相关功能,研究人员分析了从TREM2敲除诱导的多能干细胞(iPSC)系分化的小胶质细胞。通过将转录组学和功能分析与嵌合AD小鼠模型相结合,发现TREM2的缺失会降低小胶质细胞存活率,损害包括载脂蛋白E在内的关键疾病相关底物的吞噬功能,并抑制SDF-1α/CXCR4介导的趋化性,最终导致体内对β-淀粉样斑块的反应受损。进一步的,通过对异种移植人小胶质细胞进行单细胞测序,发现人类TREM2基因敲除小胶质细胞中疾病相关小胶质细胞(DAM)反应有所缺失,并且在流式细胞术和免疫组织化验证了这一发现。总之,这一系列的研究发现揭示了TREM2在人类疾病方面的保守和新颖性功能,深入了解了对人类小胶质细胞中TREM2的正常和疾病相关功能,表明TREM2可能在AD的发生发展中起着关键作用。
源井KO细胞现货库现提供TREM2敲除细胞,及近2000种其他基因的现货细胞,低至¥8000,快至一周交付纯合子,目前正火热促销中!点击了解活动详情 >>
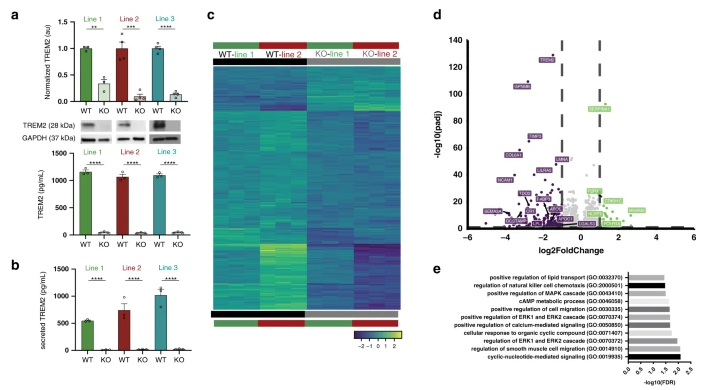
图2
(3)Repression of phagocytosis by human CD33 is not conserved with mouse CD33(Communications biology,IF= 6.268(2019))
CD33是一种免疫调节受体,通过调节小胶质细胞的吞噬作用,与阿尔茨海默病 (AD) 易感性相关。人CD33 (hCD33) 和鼠CD33 (mCD33) 之间的结构特征差异在于:mCD33中具有独特的跨膜赖氨酸,而hCD33中独特的细胞质酪氨酸。然而,这种结构差异所引起的抑制吞噬功能差异尚不清楚。一项刊登在国际杂志Communications Biology上的研究报告中,来自加拿大阿尔伯塔大学等机构的科学家们通过研究发现:mCD33和 hCD33在调节吞噬作用中具有不同的作用;此外,他们还开发了一种在小胶质细胞系中表达hCD33的新转基因小鼠模型,为探索hCD33与淀粉样斑块积聚之间的联系提供了合适的小鼠模型。
在这一具体的研究中,研究人员使用新的αmCD33单克隆抗体,发现mCD33在中性粒细胞上高表达,而在小胶质细胞上低表达。值得注意的是,mCD33在细胞表面表达完全依赖于 Dap12,这种依赖作用是靠Dap12与mCD33中跨膜赖氨酸的相互作用来维系。在RAW264.7巨噬细胞、BV-2小胶质细胞、原发性新生儿和成人小胶质细胞中,mCD33基因敲除后细胞对外源物的吞噬(包括聚集的 Aβ1-42)作用没有任何改变。但是,在高表达hCD33的人单核吞噬细胞系(THP-1及 U937细胞)中,hCD33基因的敲除却增加了细胞对外源物的吞噬作用。此外,研究进一步发现在小胶质细胞谱系中表达hCD33的转基因小鼠的原代小胶质细胞中表现出对外源物的吞噬的抑制作用。因此,mCD33和 hCD33在调节吞噬作用中具有不同的作用,突出了研究hCD33在AD易感性的重要性。
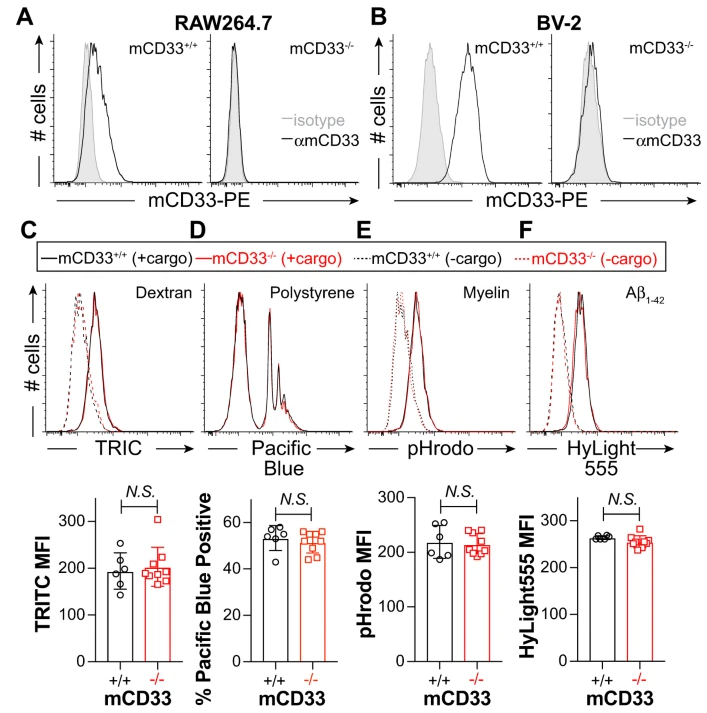
图3
源井生物基于传统的CRISPR/Cas9技术进一步研发了CRISPR-U™独家专利技术,具有更高的基因编辑效率,目前已成功构建了拥有近2000种KO细胞的基因敲除细胞库,可为您提供上述TREM2和CD33基因敲除细胞系现货,助力研究阿尔兹海默症的研究,现低至8000元即可一周内获得心仪细胞。除此之外,源井还可提供优质的基因敲入、点突变细胞构建服务,轻松满足各类研究需求。










