【热门盘点】CRISPR/Cas9技术如何助力乳腺癌研究?


【热门盘点】CRISPR/Cas9技术如何助力乳腺癌研究?

背景
乳腺癌是女性最常见的恶性肿瘤之一,也是全球女性发病率最高的肿瘤疾病。CRISPR技术作为一种简单、高效、精确的基因编辑手段,不仅可用于检测药物靶点及耐药靶点,为靶向药筛选提供便捷,还能用于基因治疗,有助于科研人员对治疗及逆转治疗后的耐药进行研究。截止现在,已有较多报道阐述了利用CRISPR技术乳腺癌方面的研究成果。以下盘点一些利用CRISPR/Cas9技术研究乳腺癌的案例,希望能给您的研究带来一些帮助。
PP2A-B55抑制激酶MASTL/Greatwall在乳腺癌中的治疗意义
B55家族基因中的PP2A调节亚基的缺失或表观沉默是乳腺癌细胞的一个共同点,失活的肿瘤抑制子PP2A经常在人类的肿瘤细胞中被发现。而细胞周期激酶MASTL(也叫Greatwall)是PP2A-B55磷酸酶复合物调控的关键因子——在细胞分裂过程中,维持有丝分裂状态需要MASTL抑制PP2A-B55,而有丝分裂结束则需要MASTL失活并使PP2A再激活。MASTL作为人类癌症治疗的靶点,为进一步了解其治疗相关性及其对PP2A活性依赖性,西班牙的细胞分裂与乳腺癌研究中心联合英国剑桥癌症研究中心等其他研究团队,用RNA干扰或利用CRISPR/Cas9技术对MASTL基因进行敲降或敲除,发现 MDA-MB-231等一些乳腺癌细胞株的增殖受损。由于敏感的癌细胞需要MASTL激酶活性和PP2A的B55亚基表达,这表明有部分乳腺癌患者可以从MASTL定向治疗中受益。此外,MASTL蛋白水平升高与疾病预后不良相关,并可能在雌激素受体(ER)阳性乳腺肿瘤中具有独立于Ki67增殖标志物的预后价值。
源井生物除了能够为您提供优质的基因敲除服务和基因敲除细胞系现货,还能提供基因干扰稳转株定制服务,助您更高效地研究基因功能。目前低至¥7980即可享受“单克隆”级别的稳转株构建服务,点击前往了解活动详情>>
图1
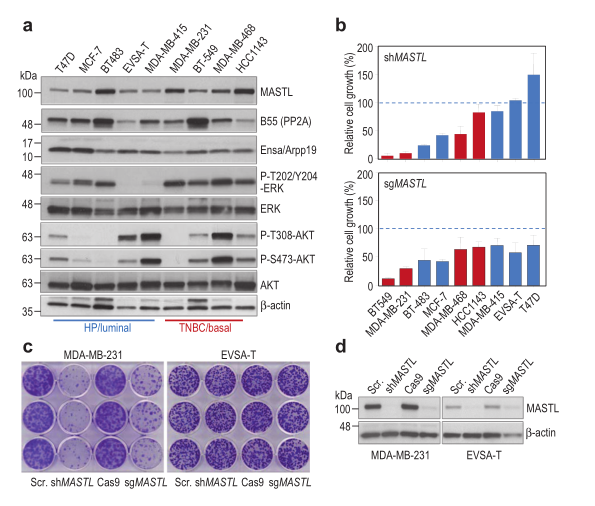
图2
Linc-RoR促进MAPK/ERK信号转导和雌激素独立的乳腺癌生长
ER+乳腺癌细胞从雌激素依赖状态向雌激素独立状态的转化是促进内分泌治疗耐药性的关键步骤。为了研究MAPK/ERK信号通路在雌激素独立乳腺癌细胞生长中的潜在机制,江苏大学团队从lncRNA数据库中选择了一组重点的lncRNA,并对其表达进行了分析。采用CRISPR/Cas9对MCF-7细胞进行linc-RoR敲除,通过回补实验在敲除细胞中重新表达linc-RoR。群落形成和MTT测定检测了linc-RoR在雌激素独立的生长和他莫西芬耐药中的作用。使用Western blot和qRT-PCR分别检测蛋白和lncRNA水平的变化。使用Kaplan-Meier Plotter (http://kmplot.com)数据集分析了与DUSP7相关的临床结果。结果发现linc-RoR作为一种onco- lncRNA,促进了ER+乳腺癌的雌激素独立性生长。且在雌激素剥夺条件下,linc-RoR引起磷酸化的MAPK/ERK通路上调,进而激活ER信号通路。敲除linc-RoR可消除雌激素剥夺诱导的ERK激活和ER磷酸化,而linc-RoR的重新表达可恢复上述表型。此外,还发现ERK特异性磷酸酶双特异性磷酸酶7 (DUSP7),也被称为MKP-X,参与了linc-RoR敲除诱导的MAPK/ERK信号的抑制。有趣的是,linc-RoR敲除增加了DUSP7蛋白的稳定性,抑制ERK的磷酸化。而从临床数据分析显示,DUSP7在ER+乳腺癌样本中的表达低于ER-乳腺癌样本。此外,DUSP7表达的下调与患者生存不良相关。综上所述,这些结果表明linc-RoR通过调节ERK特异性磷酸酶DUSP7,促进乳腺癌细胞的雌激素独立性生长和MAPK/ERK通路的激活。因此,该研究不仅有助于研究linc-RoR在ER+乳腺癌中雌激素独立和他莫昔芬耐药的作用,还揭示了linc-RoR与MAPK/ERK通路之间的联系。
为了助力科研人员对MAPK信号通路的研究,源井构建了MAPK通路中所有关键基因的KO细胞现货。除此之外,我们的KO细胞库内还有包括NF-kB、Hedgehog、JAK-STAT、PI3K/AKT、Notch、TGF-β、Wnt 热门信号通路的KO细胞系,低至¥8000,快至一周到手,点击前往搜索感兴趣的KO细胞系>>
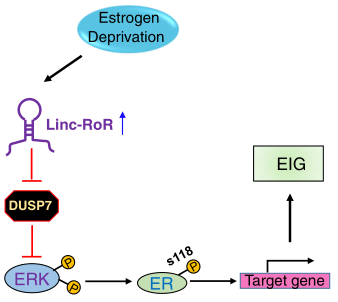
图3
酸挤压离子转运体在乳腺癌细胞三维微环境生长调控中的作用
在乳腺癌的三维微环境中,通过显著改变内环境pH,可导致代谢酸生成的增加,以及细胞扩散程度降低(表现为细胞外空间受限),但目前对特定pH调节转运体对乳腺癌3D生长的作用仍然知之甚少。哥本哈根大学Pedersen教授对MCF-7和MDA-MB-231进行相关蛋白的Western blot(2D和3D生长)、免疫组化定量分析和球形生长实验,并通过药理作用、shRNA/siRNA介导的敲低以及CRISPR/Cas9敲除三种途径来评估单个转运蛋白的作用。在MCF-7细胞球体中,乳酸-H+共转运蛋白MCT1 (SLC16A1)的表达从球体外周向球心增加,Na+、HCO3−共转运蛋白NBCn1 (SLC4A7)在球体外周高度表达,Na+/H+交换蛋白NHE1 (SLC9A1)和MCT4 (SLC16A3)分布均匀。MDA-MB-231细胞球体中也出现了类似的模式,但这些细胞不表达MCT1。3D培养时NBCn1和NHE1的相对总表达量较2D培养时降低,MCT1和MCT4的相对总表达量未发生改变。MCT1 (AR-C155858)的抑制作用减弱了MCF-7的球体的生长,加入S0859 (Na+、HCO3−共转运蛋白和MCTs的抑制剂)会加剧了这一现象。药理数据通过稳定敲低MCT1或NBCn1来重现,而敲低MCT4则没有影响。使用CRISPR/Cas9技术敲除NHE1,但NHE1部分敲除和NHE1抑制剂cariporide都没有抑制MCF-7球体生长。相反,MDA-MB-231球体的生长受到了NHE1敲低和NHE1敲除的抑制,而并非NBCn1或MCT4敲低。这项研究展现了四种主要的酸挤压转运蛋白在人乳腺癌细胞的三维球体中不同的表达和定位模式,并揭示了三维的生长以细胞类型依赖的方式依赖于这些转运蛋白,这对乳腺癌治疗具有潜在的重要意义。
源井生物基于传统的CRISPR/Cas9技术进一步研发了CRISPR-U™独家专利技术,具有更高的基因编辑效率,目前源井生物已凭借该技术成功构建了拥有近2000种KO细胞的基因敲除细胞库,现低至8000即可一周内获得成功敲除的KO细胞,轻松满足各类研究。










