万能“剪刀手”:CRISPR如何助力COVID-19治疗靶点探索
COVID-19,一种由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的一种呼吸道疾病,如今已成全球大流行态势。当前,COVID-19的爆发对全球公共卫生、科学研究、医疗界构成严重的威胁。自新型冠状病毒(SARS-CoV-2)被首次发现,众多科研工作者将注意力聚焦于研究这种新型冠状病毒及其所引发的疾病。基因编辑工具CRISPR长期以来被认为是科研工作者的科研利剑,使用CRISPR技术的科学家也不在少数,这种基因编辑工具很快被带到对抗COVID-19的战争前线。CRISPR/Cas9,一种由guide RNA指导工程核酸酶(Cas9)对靶向目的基因位点进行快捷及高效DNA编辑的技术,因其多样性、模块性及高效性等优点已经成为在细胞、动物和植物中操纵基因组的工具。那么它是如何被应用在COVID-19的研究呢?本文就近期以来,以基因编辑细胞作为研究工具实现对COVID-19的研究进行盘点整理,愿同大家一起分享与学习!
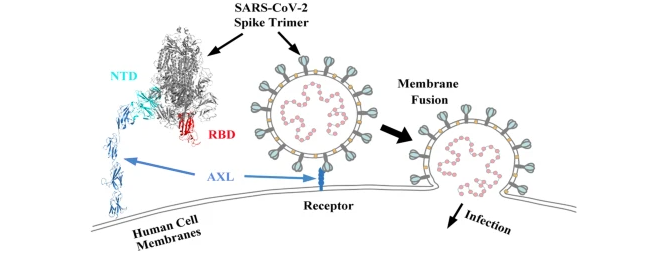
(1)AXL is a candidate receptor for SARS-CoV-2 that promotes infection of pulmonary and bronchial epithelial cells(Cell Research,IF=25.6176(2021))
已有的证据表明:SARS-CoV-2的S样蛋白与宿主受体ACE2之间的相互作用是引起COVID-19感染的潜在因素。尽管ACE2作为SARS-CoV-2受体的作用是明确的,但研究表明,ACE2在各种人体组织中的表达极低,尤其是在呼吸道。因此,可能存在促进SARS-CoV-2进入呼吸系统细胞的其他宿主受体和/或共受体。
发表在Cell Research国际著名杂志上的这项研究中,研究人员结合蛋白质组学计算找到对SARS-CoV-2具有最高结合亲和力的宿主受体,发现酪氨酸蛋白激酶受体UFO (AXL)能与 SARS-CoV-2的S样蛋白N端结构域发生特异性相互作用。为了验证AXL在促进SARS-CoV-2进入人类细胞过程中扮演的重要角色,研究者同时使用SARS-CoV-2假病毒与真正的SARS-CoV-2病毒对CRISPR编辑的人类细胞系进行感染实验。结果发现:在HEK293T 细胞中过表达 AXL与过表达 ACE2一样有效地促进 SARS-CoV-2 进入,而敲除 AXL 可显着降低 H1299 肺细胞和人原代肺上皮细胞中的SARS-CoV-2感染;而可溶性人重组AXL在表达高水平AXL的细胞中可阻断SARS-CoV-2感染。最后,为了确定COVID-19患者中AXL表达与SARS COV-2感染的相关性,研究人员对COVID-19患者支气管肺泡灌洗液细胞(BALF)进行单细胞mRNA测序,发现AXL的表达水平与患者BALF细胞中的SARS-CoV-2的水平密切相关。
总之,这一项研究结果揭示AXL是SARS-CoV-2的一种新型候选受体,其可能在促进人类呼吸系统的病毒感染中发挥重要作用,这对开发针对AXL的临床干预具有启示意义。
源井背靠丰富的基因编辑经验,不仅构建有优质的AXL KO细胞系(A549 / HEK293)和ACE2 KO细胞系(Hela/16HBE)现货,还可提供成熟的ACE2过表达稳转株(A549/HepG2/HeLa等)的构建服务,助力SARS-CoV-2受体的研究。目前稳转株正火热促销中,低至¥7980,欢迎点击了解活动详情 >>
(2)Genome-wide CRISPR screening identifies TMEM106B as a proviral host factor for SARS-CoV-2(Nature Genetics,IF=38.3307(2021))
近期,比利时鲁汶大学Dirk Daelemans、Jim Baggen等研究人员合作,利用全基因组CRISPR筛选发现TMEM106B是SARS-CoV-2的促病毒宿主因子。该项研究成果已在线发表在Nature Genetics著名期刊上。
全基因组敲除筛选(Genome-wide CRISPR Screening)已被广泛用于识别各种病毒的宿主因子,SARS-CoV-2 在内的冠状病毒也不例外。在这篇文章中,研究人员为了确定对冠状病毒感染至关重要的宿主因子,对SARS-CoV-2和人类冠状病毒229E进行了全基因组功能遗传筛查。这些筛选揭示了病毒特异性以及其共同的宿主因子,包括TMEM41B和PI3K 3型。并且发现SARS-CoV-2需要溶酶体蛋白TMEM106B才能实现人类细胞系和原代肺细胞的感染。此外,研究发现TMEM106B的过表达增强了SARS-CoV-2感染和假病毒感染,揭示其在病毒进入过程中发挥作用。最后,对COVID-19患者气道细胞进行单细胞RNA测序的结果表明,TMEM106B表达与SARS-CoV-2感染相关。总而言之,这项研究揭示了一系列冠状病毒宿主因子,对开发针对SARS-CoV-2感染或未来人畜共患病冠状病毒爆发的药物具有指导意义。

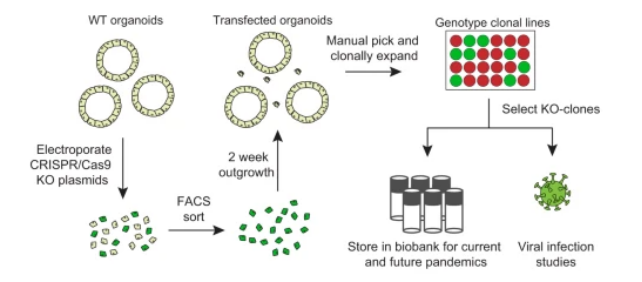
(3) A CRISPR/Cas9 genetically engineered organoid biobank reveals essential host factors for coronaviruses(Nature communications,IF=14.9196(2021))
快速鉴定病毒复制所必需的宿主基因可加快治疗干预措施。然而,基因筛查通常是在转化的细胞系中进行的,这些细胞系在体内难以代表病毒靶细胞,因此产生的科研成果可能无法应用于临床上。基于此,荷兰鹿特丹伊拉斯姆斯医学中心Bart L. Haagmans与荷兰皇家大学医学中心Hans Clevers等研究员展开合作合作,开发基于CRISPR/Cas9基因工程技术构建的类器官生物库,用以研究冠状病毒的基本宿主因子。在这项研究中,为了辨别哪些宿主因子是可靠的抗冠状病毒治疗靶点,研究人员为之前与冠状病毒生物学有关的 19 个宿主基因生成了突变克隆的肠道类器官(Intestinal organoids,IOs)。研究人员成功验证了ACE2和DPP4分别是 SARS-CoV/SARS-CoV-2 和MERS-CoV病毒进入的受体。IOs中的 SARS-CoV-2 复制不需要内体组织蛋白酶 B/L 蛋白酶,但具体取决于细胞表面蛋白酶 TMPRSS2,但其他 TMPRSS 家族成员不是必需的。新出现的冠状病毒变种B.1.1.7以及SARS-CoV 和 MERS-CoV 同样依赖于 TMPRSS2。这一系列的发现强调了非转化人体模型与冠状病毒研究的相关性,将 TMPRSS2 确定为有吸引力的泛冠状病毒治疗靶点,并证明类器官敲除生物库是研究当前和未来新兴冠状病毒生物学的宝贵工具。
ACE2、DPP4、TMPRSS2和FRUIN等作为冠状病毒的感染人体细胞的重要靶点,其KO细胞系可应用于病毒入侵人体的各种基础研究中,源井可提供多种KO细胞系现货如ACE2 KO细胞(HeLa/16HBE)、TMPRSS2/FURIN KO细胞(HeLa)、DPP4 KO细胞系 (A549 / HEK293)等近3000种KO细胞现货,低至8000元,快至一周交付,欢迎点击搜索感兴趣的KO细胞现货 >>
为了帮助研究者更好的开展SARS-CoV-2的基础研究和药物研发,源井生物研发出一系列与新冠病毒相关的细胞产品,包括S蛋白稳转株、ACE2过表达稳转株、KO细胞、疫苗研发相关细胞和新冠研究高频使用的野生型细胞。源井拥有丰富的基因编辑经验,独家研发了具有更高的基因编辑效率的CRISPR-U™技术,已为全球20多个国家与地区提供了数千次基因编辑细胞服务,欢迎联系我们了解更多。
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划


























 联系电话
联系电话
 投诉电话
投诉电话
