【文献解读】揭秘肝细胞癌治疗新靶点SNORD17与P53网络的复杂关系!


【文献解读】揭秘肝细胞癌治疗新靶点SNORD17与P53网络的复杂关系!
肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一,早期临床症状不明显、难以诊断,常在发病的中晚期确诊。尽管过去几十年里,肝细胞癌的治疗技术有明显的提升,但这类癌症的侵袭能力和转移能力较强,治疗后复发率较高,从而导致这类癌症的死亡率仍然居高不下。目前对肝细胞癌潜在的发病机制还处于探究阶段,可用于治疗的方法相对有限,急需寻求更多的治疗方法和技术。肿瘤抑制因子p53在DNA损伤或癌基因异常激活的反应中被激活,诱导多种细胞过程,包括细胞周期阻滞、凋亡和衰老,研究表明p53在HCC的发展中发挥着关键作用。
许多非编码RNA在p53信号网络中发挥重要作用,包括miRNA和lncRNA,然而小核仁RNA(Small nucleolar RNAs, snoRNAs)在p53调控网络中的作用还不太明确。针对这个问题,华中科技大学同济医学院附属同济医院肝脏外科中心的 Liang Chu、Xiaoping Chen和Bixiang Zhang课题组合作在期刊《cell death & differentiation》上发表了题为“Non-coding small nucleolar RNA SNORD17 promotes the progression of hepatocellular carcinoma through a positive feedback loop upon p53 inactivation”的研究论文(IF2020=15.8)。该研究构揭示了小核仁RNA SNORD17和p53信号通路在肝细胞癌的中的调控作用,为肝细胞癌的治疗提供了一个新的潜在靶点。

借助GEO数据库(Gene Expression Omnibus database)、Kaplan-Meier分析和 qRT-PCR分析筛选得到了肝细胞癌预后相关且在肝细胞癌组织中表达量上调的的小核仁RNA SNORD17。同时SNORD17在HCC中的高表达与肿瘤体积增大、血管浸润呈正相关,推测SNORD17是在HCC临床检测中重要的snoRNA(图1)。
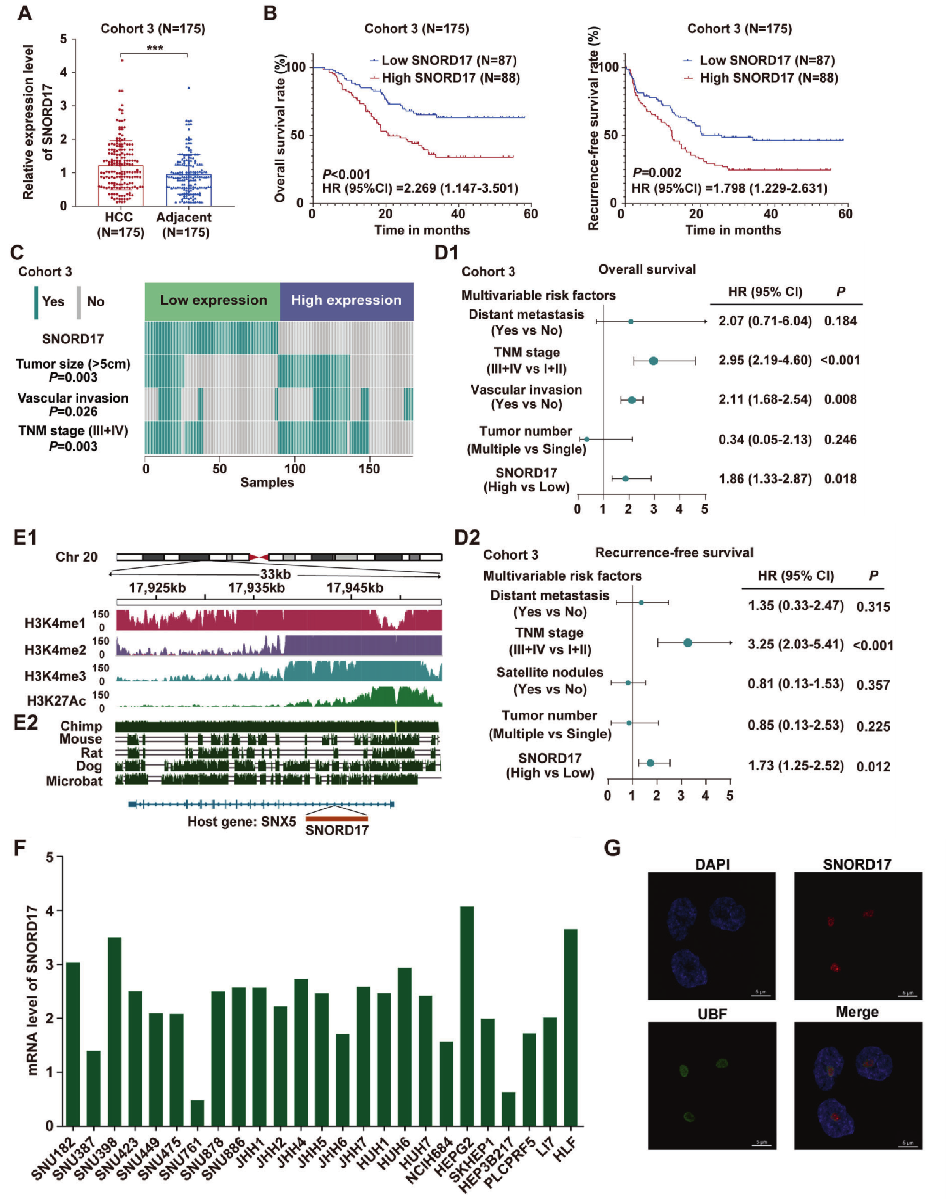
图1 在HCC组织中SNORD17是与临床相关的snoRNA
为了进一步研究SNORD17在肝细胞癌中的作用,研究人员构建了SNORD17基因敲除的Hep G2细胞(源井生物协助构建)和SNORD17基因敲降的SK-Hep1细胞(图2 A)。在HCC细胞系中SNORD17基因的敲除和敲降均可显著抑制细胞增殖、克隆形成和G1/S期转变(图2 B~E)。流式分选发现,与对照组细胞相比,SNORD17基因的敲除和敲降均显著增加了肝癌细胞的凋亡(图2 F)。为进一步研究SNORD17在HCC生长中的作用,利用HepG2-WT细胞和HepG2-SNORD17-/-敲除细胞建立的皮下异种移植瘤模型,结果显示,与对照组相比,在HepG2细胞中敲除SNORD17显著降低了原位肝肿瘤体积和肿瘤重量(图2 G)。
上述所使用的HepG2-SNORD17-/-敲除细胞是由源井生物采用双gRNA法,并独家CRISPR-U™专利技术对SNORD17全长序列进行了敲除,最终构建的HepG2-SNORD17-/-敲除细胞被用于研究SNORD17在HCC中的作用。源井基于自身丰富的基因编辑经验,利用独家CRISPR-U™专利技术构建了包含近2000种的KO细胞现货库,覆盖数千种基因,该研究所使用的SNORD17 HepG2敲除细胞系在库内也有现货,低至¥8000,快至一周到手!如果您有KO细胞的需求,欢迎点击入库搜索>>
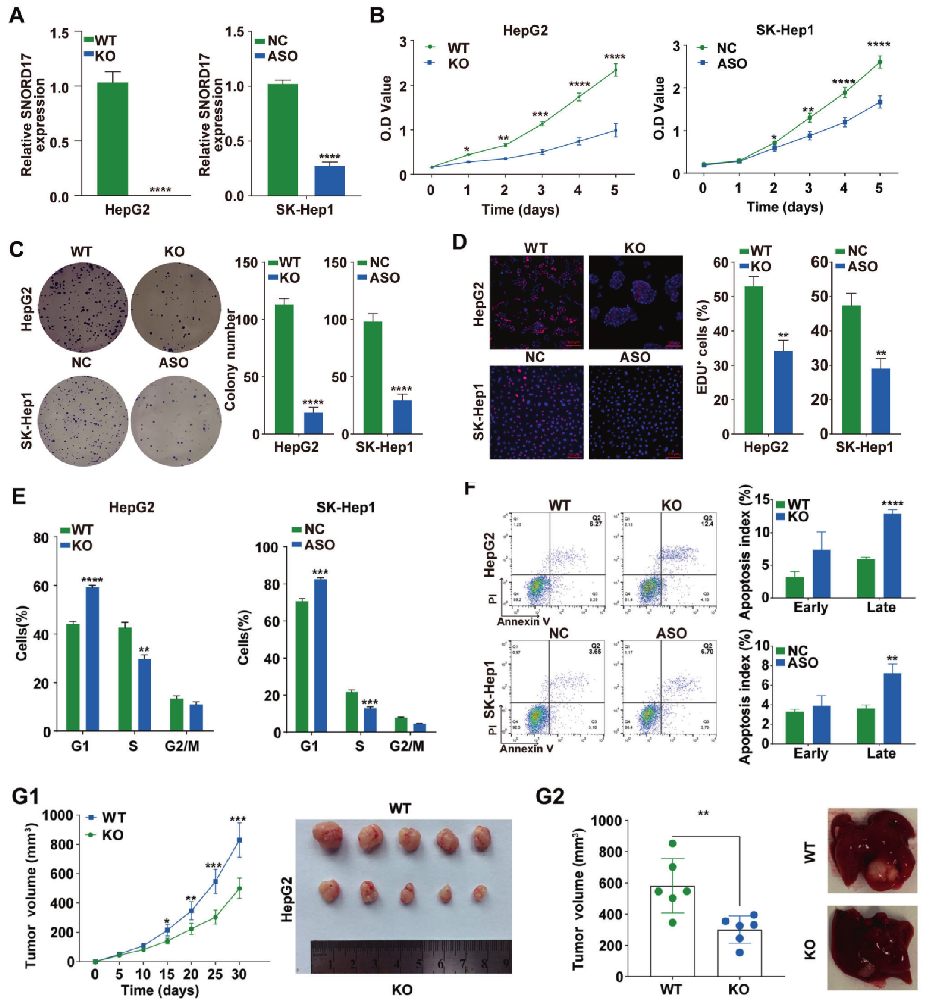
图2 SNORD17在体内和体外均能促进肝癌细胞的增殖、细胞周期和减缓细胞凋亡
为了探索SNORD17促进肝癌发展的分子机制,通过mRNA表达谱检测HepG2细胞中SNORD17敲除后基因表达的变化。对差异表达基因的KEGG和GSEA分析表明,p53信号通路富集程度最高,且与SNORD17表达量呈现相反的趋势。这些差异表达的基因主要与p53信号通路相关,参与调控细胞周期、细胞凋亡和代谢(图3 A)。Western Blot 检测结果发现,SNORD17缺失引起p53表达量上调(图3 B),若SNORD17过表达则表现出相反的趋势。Luciferase报告基因检测发现,在肝癌细胞中,SNORD17表达量的降低能显著增强p53的转录表达(图3 C)。在HCC细胞中,SNORD17表达量下调能显著促进p53下游效应因子p21和Puma的转录表达(图3 D)。在p53缺失的肝癌细胞中,敲降SNORD17不会影响细胞增殖(图3 E)和克隆(图3 F)形成,过表达SNORD17并没有促进肿瘤组织的生长(图3 G)。由此可推断p53可以通过调控SNORD17的表达进而影响HCC细胞生长。
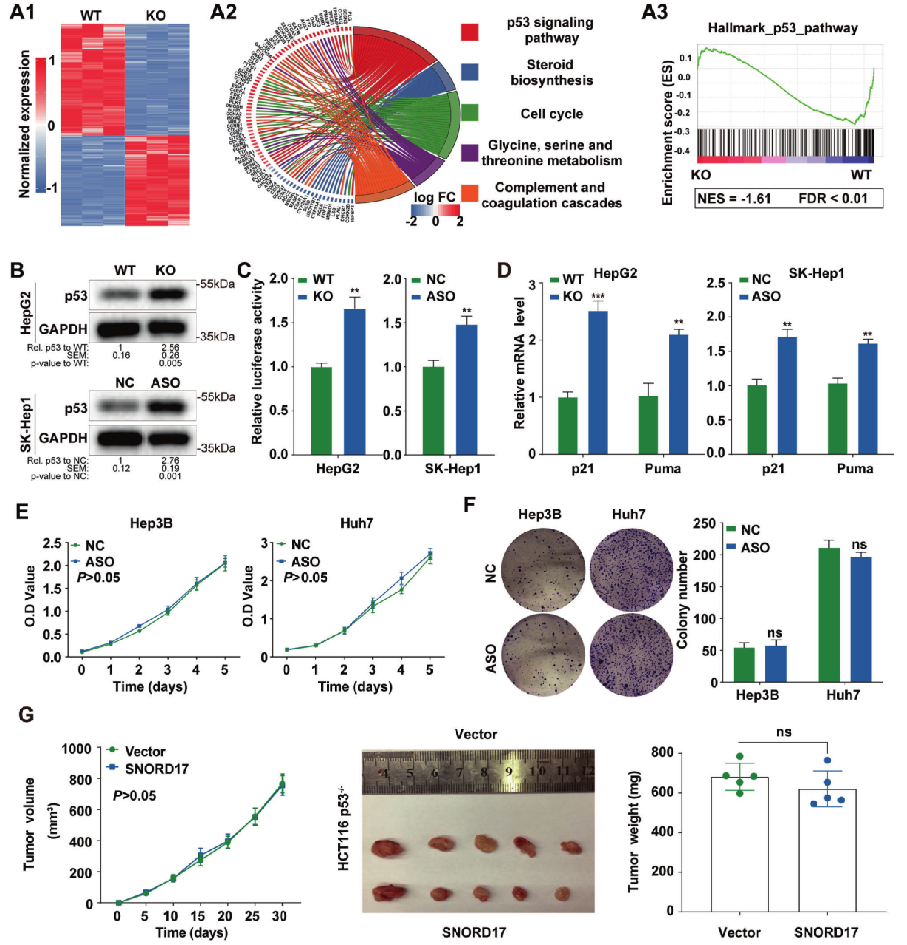
图3 p53介导SNORD17对HCC细胞生长的影响
RNA pull-down试验发现,有19种与SNORD17特异性结合的蛋白,其中的MYBBP1A 和NPM1是富集量最多的蛋白,并被报道参与调控p53(图4 A),RIP检测证实在细胞内MYBBP1A和NPM1能与SNORD17相互结合发挥作用(图4 B)。乙酰化修饰对p53的激活至关重要,曾有报道MYBBP1A能促进p53的乙酰化,那在乙酰化修饰的过程中,SNORD17扮演着怎么样的角色呢?通过Co-IP等一系列实验发现,SNORD17能将NPM1和MYBBP1A同时锚定在核仁内部,抑制核质中NPM1-MDM2复合物和MYBBP1A-p53复合物的形成,分别通过泛素化修饰和乙酰化修饰进而影响p53的活性;同时p53的乙酰化修饰也可正向反馈抑制SNORD17的转录(图4 C)。
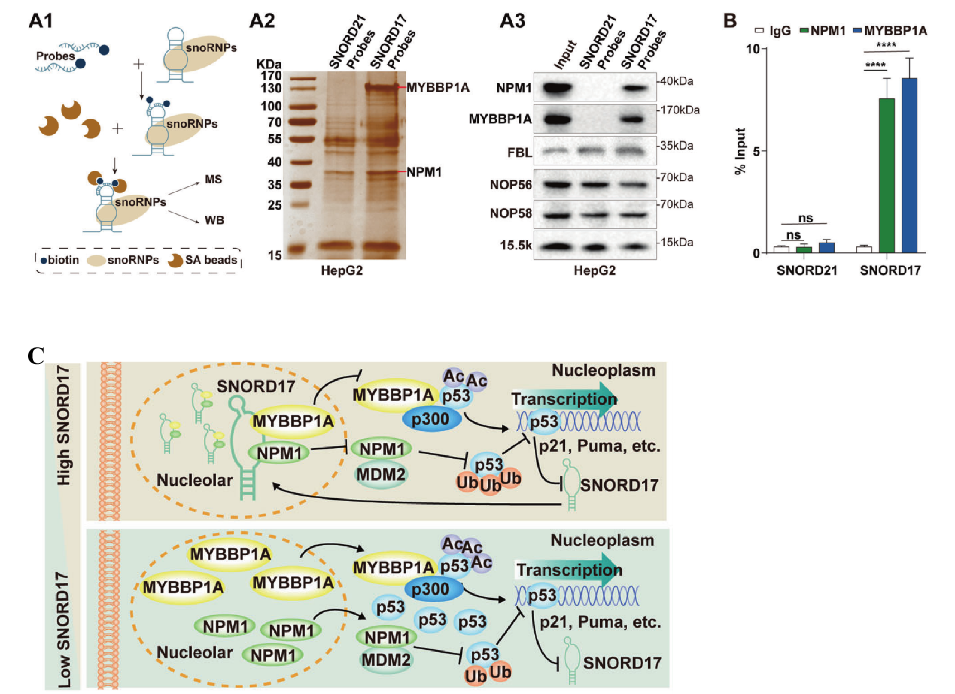
图4 SNORD17与p53的调控关系
综上所述,SNORD17通过与MYBBP1A结合并抑制其转移到核质,从而抑制乙酰基转移酶p300调节的p53乙酰化。SNORD17在HCC中调节p53的稳定性和活性,增加了p53调控网络的复杂性,有望成为HCC治疗的新靶点。同时该项研究也进一步证实了snoRNAs在肿瘤发生中的关键作用,并可作为各种癌症的预后标志物,这对后续的癌症治疗研究也起到了一定的借鉴作用。
参考文献:
Liang J, Li G, Liao J, Huang Z, Wen J, Wang Y, Chen Z, Cai G, Xu W, Ding Z, Liang H, Datta PK, Chu L, Chen X, Zhang B. Non-coding small nucleolar RNA SNORD17 promotes the progression of hepatocellular carcinoma through a positive feedback loop upon p53 inactivation. Cell Death Differ. 2022 Jan 15. doi: 10.1038/s41418-022-00929-w. Epub ahead of print. PMID: 35034103.
源井生物基于传统的CRISPR/Cas9技术进一步研发了CRISPR-U™独家专利技术,具有更高的基因编辑效率,目前源井生物已凭借该技术成功为全球20多个国家与地区提供了数千次基因编辑细胞服务,并成功构建了拥有近2000种KO细胞的基因敲除细胞库,现低至8000即可一周内获得成功敲除的KO细胞,轻松实现各类研究。










