两个诺贝尔奖强强联合--CRISPR基因编辑的ESC/iPSC应用于再生和个性化医学


两个诺贝尔奖强强联合--CRISPR基因编辑的ESC/iPSC应用于再生和个性化医学
多能干细胞可分化为各种细胞并构成成熟生物。这些细胞可以在体外培养,称为胚胎干细胞(ESCs)。 ESC在发育生物学上经历了一场巨大的革命。这些体外生长的ESCs具有在体内产生胚胎所有谱系的潜力,并且在体外分化后可以产生任何类型的体细胞,例如心肌细胞,平滑肌细胞,内皮细胞,神经元细胞和肝细胞。与其他细胞类型相比,胚胎干(ESC)细胞的优势在于它们易于进行基因操作。它们可以很容易地进行基因修饰,同时保持多能性,并且可以选择性地增殖。人类ESC作为治疗许多退化性疾病(例如缺血性心力衰竭,帕金森氏病,阿尔茨海默氏病,糖尿病,脊髓损伤和年龄相关性黄斑变性)的宝贵细胞来源而受到欢迎。在2010年,首次使用人类胚胎干细胞治疗脊髓损伤,并在此之后对人类胚胎干细胞进行了十几项临床试验,以治疗严重的缺血性左心室功能不全,年龄相关性黄斑变性,帕金森氏病和糖尿病以及其他退化性疾病。
然而,基于人类ESC的临床试验极大地受到了限制,例如关于使用胚胎来源细胞的伦理问题,以及是用操作不当培养的干细胞而导致异常发育,以及移植排斥反应。 Takahashi和Yamanaka(2016)在将体细胞重编程为多能状态方面取得了突破性发现。在他们的研究中,通过强迫异位表达转录因子OCT4,SOX2,KLF,c-MYC,NANOG和LIN28,重编程了诸如皮肤活检来源的成纤维细胞和外周血来源的T淋巴细胞等体细胞。这些细胞被称为诱导多能干细胞(iPSC),表现出相似的基因表达,表观遗传学特征和分化潜能,可与ESC一样,产生任何体细胞。
应用范围:
ESC和iPSC在生物医学研究中有着广泛的应用:
1. 基础研究:了解cell fate control和细胞再生,研究多能性、组织和器官发育、生理学。
2. 药物发现:用于心血管疾病、神经系统疾病和神经精神疾病、罕见病等疾病的药物研发
3. 毒理学研究:在毒性测试中使用iPSC衍生的细胞类型。
4. 疾病建模:心血管疾病模型、iPSC在心血管疾病模型中的利用率百分比、iPSC来源在心脏研究中的比例、用于重编程的载体类型的比例、用于疾病建模的分化心肌细胞的比例、iPSC衍生的类器官开发和疾病、使用iPSC衍生的肝细胞、神经退行性疾病建模中的iPSC、癌症衍生的iPSC来建模肝脏疾病。
5. 基于细胞的疗法:用于AMD的细胞疗法,如自体iPSC-RPE和异源iPSC-RPE,用于帕金森氏病的iPSC衍生的多巴胺能神经元,用于实体癌的iPSC衍生的NK细胞,用于GvHD的iPSC衍生的细胞,iPSC衍生的细胞用于脊髓损伤,iPSC衍生的心肌细胞用于缺血性心肌病。
CRISPR-U™基因编辑ESC和iPSC:
CRISPR系统是一种有效的基因组编辑系统,可通过将目标基因序列替换为所需的供体序列来进行基因敲除或敲入基因组操作。CRISPR系统可以产生单个或多个基因敲除,正确的突变或插入报道基因转基因。用CRISPR介导的ESC和iPSC的基因编辑,可用于探索谱系选择,分化和干细胞命运的遗传决定因素,从而使研究人员能够研究各种基因或非编码元件如何促进特定的过程和途径。 ESC和iPSC细胞模型中的基因组编辑可以在功能基因组学,信号通路,药物发现,药物反应,癌症研究和细胞治疗等领域推进研究计划。
为了加速ESC和iPSC的研究,源井生物开发了CRISPR-U™用于ESC和iPSC的基因操作。因此,通过利用CRISPR/Cas9系统在ESC和iPSC中实现基因组编辑。 CRISPR-U™系统用于在ESC和iPSC中进行快速,精确的基因编辑。 CRISPR生成的细胞模型已使各种疾病的机制和治疗探索成为可能,例如心血管疾病,肝病等。此外,CRISPR生成的细胞模型可与药物发现,安全药理学和其他治疗研究相结合。 源井生物可以自定义ESC和iPSC中的基因编辑,并且可以在动物模型中生成各种基因修饰。
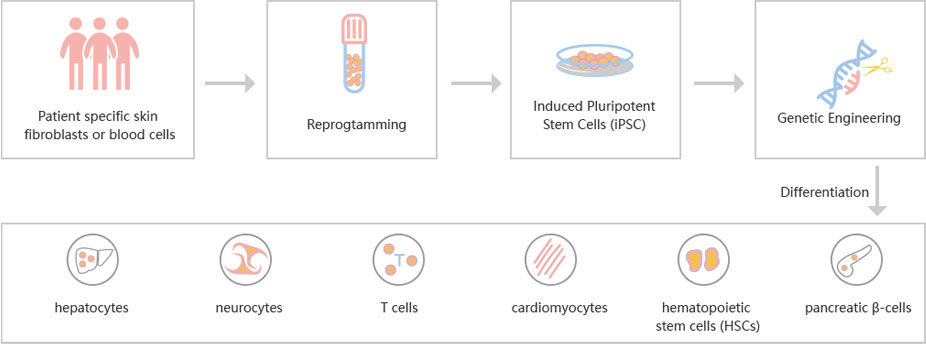
图:针对工程ESC和iPSC的CRISPR-U™定制流程
基因敲除iPSC的研究案例:
缺失I类HLA的血小板可以逃避自然杀伤细胞的免疫力
血小板输注是血小板减少症患者的基本治疗方法。接受血小板输注的患者中约有5%–15%观察到同种免疫血小板输注的难治性(allo-PTR),最主要的原因是产生了针对人类白细胞抗原I类(HLA-1)的同种抗体。在这种HLA-1介导的同种异体PTR中,除了与HLA-1相容的血小板外,输血的血小板被立即排斥。但是,选择兼容供体的需求限制了供应,最困难的情况是罕见的HLA-1型。作为产生人细胞和组织的离体来源,已经广泛研究了人诱导的多能干细胞(iPSC),并且iPSC衍生的血小板(iPLAT)具有解决当前输血系统中上述问题的潜力。在本研究中,CRISPR/Cas9介导的HLA-KO iPLAT通过敲除HLA-1复杂分子β2-微球蛋白(B2M)产生。选择B2M的外显子1作为敲除靶标。对于KO B2M,研究人员构建了sgRNA表达载体(pHL-H1-B2M-sgRNA-mEF1a-RiH),CRISPR/Cas9表达载体(pHL-UbicP-SphcCas9-iP-A)并转染了MK-iPSC以生成HLAKO iPLAT。 HLA-KO iPLAT对所有HLA-1均缺乏,但在体外未引起NK细胞的细胞毒性反应,并且在用人NK细胞重建的人源化小鼠模型(Hu-NK-MSTRG)中输注后,其循环量相当于野生型iPLAT 。这项研究揭示了血小板独特的非免疫原性,并为HLA-KO iPLAT的临床应用提供了概念证明。
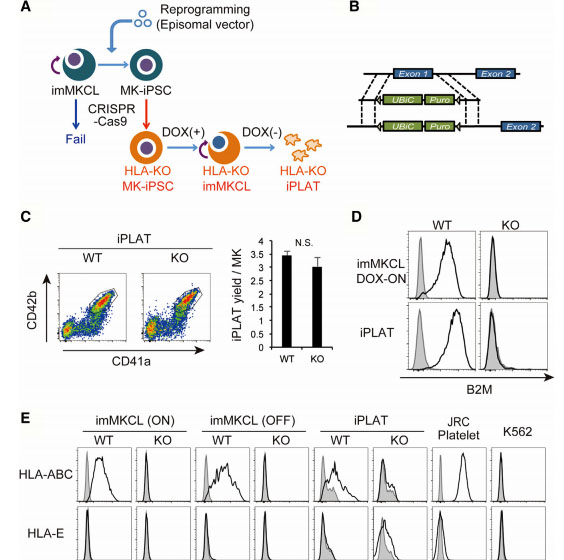
图1:通过在imMKCL中敲除β2-微球蛋白生产HLA-KO iPLAT。 首先将imMKCL重新编程为次级MK-iPSC,其中B2M被敲除。增殖并发展成熟的MK-iPSC之后,iPLAT中敲除B2M(A,B)。流式细胞仪分析生成的CD41a + CD42b + iPLAT,以及imMKCL,iPLAT,JRC血小板和K562细胞(C,D和E)上B2M和HLA-ABC和HLA-E的细胞表面表达。
基因点突变iPSC的研究案例:
通过CRISPR/Cas9和iPS细胞研究如何纠正隐性营养不良性大疱性表皮松解
营养不良性大疱性表皮松解症(DEB)是一种罕见的遗传性皮肤脆弱性疾病,其特征是皮肤和粘膜起泡,可以以显性(DDEB)或隐性(RDEB)方式遗传。 DEB是由编码VII型胶原(C7)的COL7A1基因突变引起的,该蛋白是形成锚定纤丝(AFs)的关键蛋白,该锚定纤丝可以稳定基底膜区(BMZ)的表皮粘附。 RDEB患者缺乏功能性C7,严重损害了皮肤-表皮的稳定性,导致皮肤上广泛的水疱和开放性伤口,极大地影响了患者的生活质量。目前尚无批准用于治疗RDEB的疗法。研究人员使用CRISPR系统对来自杂合和纯合状态的RDEB患者的诱导多能干细胞(iPSC)进行了修饰,并纠正了COL7A1基因中第19外显子(c.2470insG)和第32外显子(c.3948insT)的突变。通过同源性导向修复(HDR)。他们发现,通过基因校正的iPSC可以产生三维人皮肤等效物(HSE),将其分化为角质形成细胞(KCs)和成纤维细胞(FBs),然后移植到免疫缺陷小鼠上,该小鼠在BMZ以及C7处均能正常表达C7。移植后2个月恢复房颤。这些发现代表了针对RDEB的基于创新自体干细胞疗法的临床应用的关键进展。这一发现可以作为将这种治疗方法转化为临床的基础。
CRISPR/Cas9质粒方法和RNP方法对COL7A1基因纯合和杂合突变的双等位基因校正
研究人员采用了两种CRISPR介导的基因组编辑方法来校正iPSCs纯合和杂合状态下的COL7A1基因突变。他们使用CRISPR/Cas9质粒法在纯合iPSC中应用了双等位基因校正。他们评估了iPSC衍生细胞中COL7A1基因第19外显子的基因校正功效。他们发现,外显子19中的COL7A1突变中有10%的克隆经过了双等位基因校正,而40%的克隆已进行了单等位基因校正。序列分析表明目标序列区域无脱靶突变。为了提高校正效率,研究人员使用了Cas9蛋白和经过化学修饰的合成gRNA作为RNP复合物。通过RNP方法,他们对COL7A1第19外显子的纯合突变(c.2470insG)实现了58%的双等位基因校正和42%的单等位基因校正,对COL7A1第19外显子和第32外显子的杂合突变(c.2470insG/c.3948insT)分别实现了19%的双等位基因和48%的单等位基因校正。此策略可构建“无痕”表型而不会留下残留足迹,并在单个iPSC中产生非常高的效率,而没有脱靶问题。
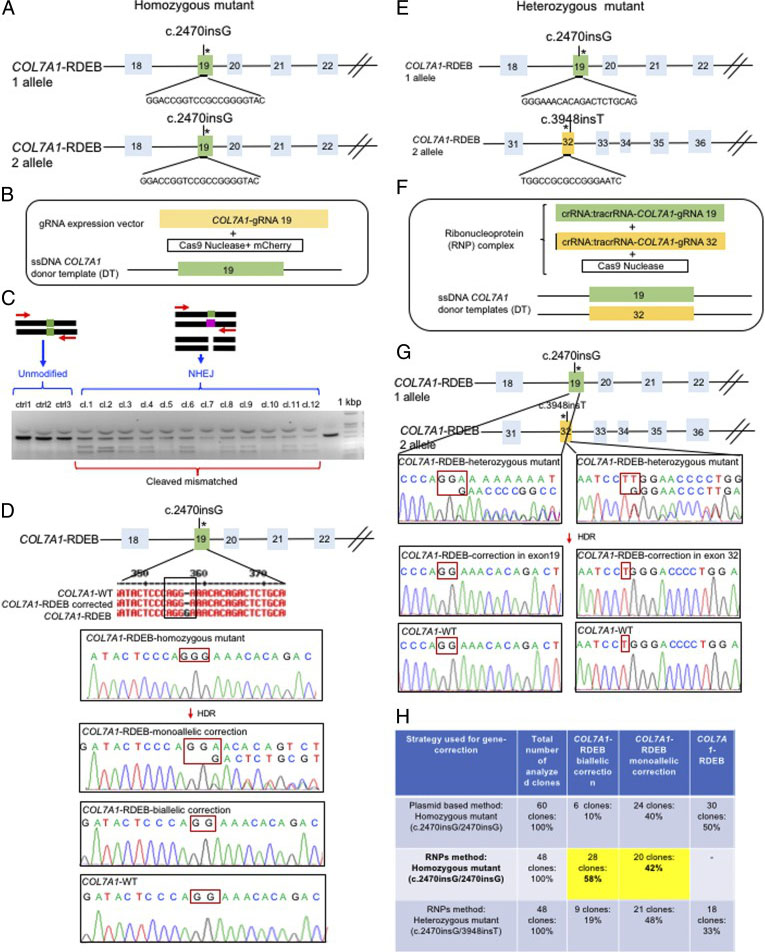
图2.在iPS细胞中使用基于质粒和蛋白质的方法评估CRISPR/Cas9基因校正效率。 (A)COL7A外显子19中纯合(c.2470insG)突变的CRISPR靶位的示意图。 (B)用于基于质粒的基因校正策略的组件。 (C)基因编辑靶向COL7A1基因的外显子19后的T7E1测定。 (D)桑格测序证实了各种基因型。 (E)COL7A外显子19中杂合(c.2470insG / c.3948insT)突变的CRISPR目标位点的示意图。 (F)用于基于蛋白质的基因校正策略。 (G)测序证实了各种基因型。 (H)CRISPR/Cas9基因编辑后检测到的基因型和功效概述。
裸鼠移植后的皮肤完整性和VII型胶原修复
研究人员建立了从RDEB患者来源的iPSC生成角质形成细胞(iKC)和成纤维细胞(iFBs)的方案。他们观察到功能性iKC需要60天才能体外成熟,并且96%的iPSC衍生的KC(iKC)表达角蛋白14,而96%的50%的p63表达水平很高。除此之外,他们在分化31天后从iPSC获得了iFB。他们观察到超过90%的iPSC衍生的iFB具有与正常人FB一致的表达模式。然后将来自基因校正的iKC和iFB的3D皮肤移植到免疫缺陷小鼠上,并在移植后2个月进行分析。他们分析了C7,表皮分化标记物(如角蛋白14,角蛋白10,loricrin,丝聚蛋白和波形蛋白)的表达。 iPSC来源的校正异种移植物表达C7,完全类似于WT皮肤,表明基因校正恢复了iPSC来源的iKC和iFB中的蛋白质功能。
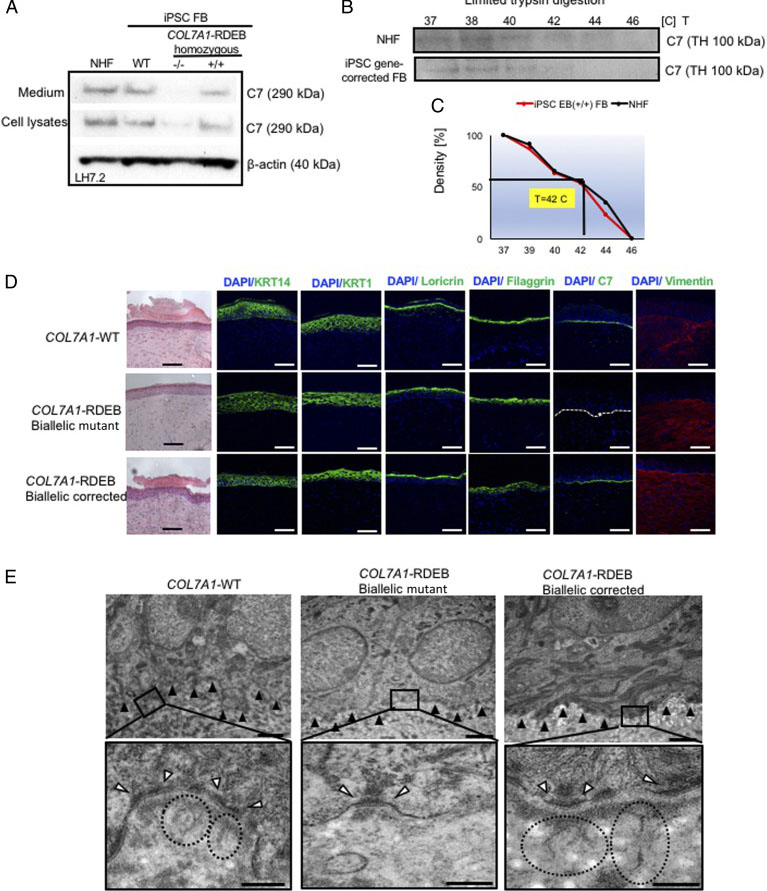
图3.基因校正的RDEB患者iPSC衍生的FB和HSE的功能验证。 (A)免疫印迹(WB)分析评估VII型胶原(C7)蛋白在正常人FB,野生型iPSC衍生的FB(iPSC WT FB),COL7A1-RDEB纯合突变体(-/-)中的表达和分泌并进行了校正(+ / +)iPSC分化为FB。 (B)(C)在升高的温度下,通过有限的胰蛋白酶消化正常人FB和iPSC基因校正的RDEB衍生的FB的培养基,分析和定量C7的热稳定性。 (D)使用基因校正的RDEB患者iPSC衍生的KCs和FBs进行3D HSE的生成,然后将其移植到裸鼠上,在组织学上可与移植后2个月使用iPSC WT KCs / FBs生成的3D HSEs进行组织学比较。 H&E染色显示正常的表皮和真皮形态。在移植后2个月,使用LH7.2抗体通过免疫荧光(IF)染色(绿色信号)证明了C7的沉积。在校正的,突变的和WT异种移植物上对角蛋白14,角蛋白10,loricrin,丝蛋白和波形蛋白进行额外的IF染色。 (E)在移植后2个月,对阳性iPSC WT KCs / FBs皮肤移植物,阴性COL7A1-RDEB纯合突变体和COL7A1-RDEB基因校正的KCs / FBs皮肤移植物以及基因校正的RDEB皮肤移植物进行透射电子显微镜检查。 BMZ由黑色箭头指示。
基因敲入iPSC的研究案例:
CRISPR介导的LGMD2A的新型自体细胞疗法
肢带型肌营养不良症2A型(LGMD2A)是常染色体隐性遗传性疾病,是LGMD的最常见形式。 LGMD2A的发生是由于功能性钙蛋白酶3(CAPN3)的丧失,钙蛋白酶敏感性钙蛋白酶半胱氨酸蛋白酶家族是骨骼肌特异性同种型。研究人员使用CRISPR/Cas9介导的基因组编辑技术对三位LGMD2A患者的iPSC进行了校正,以纠正CAPN3基因中的突变。 CRISPR介导的基因敲入方法用于编辑携带三个不同CAPN3突变的iPSC基因组,并在体外拯救肌管衍生物中的CAPN3蛋白。为了纠正该突变,研究人员使用了靶向克隆到pX458载体中的CAPN3-外显子14(50 -CATCTCCGTGGATCGGCCAG-30)的指导RNA序列。在pBluescript质粒主链中构建HDR供体载体,其中带有由HEF1-eIF4g驱动的loxP侧翼GFP-2A-neoR的选择盒用于阳性选择,而由MC1启动子驱动的HSV-tk的选择盒用于阴性选择。 GFP-2A-neoR盒上游有一个由5个引物组成的同源臂,由内含子13(950 bp),敲入插入片段(由15-24个外显子组成)和sv40 poly(A)信号序列组成。由In14(950 bp)组成的3-prime同源臂位于GFP-2A-neoR盒的下游。为了测试体内CAPN3表达的回补,将基因校正的iPSC衍生的成肌祖细胞移植到C3KO-NSG小鼠的心毒素预损伤胫骨前(TA)肌肉中,并回补CAPN3 mRNA。
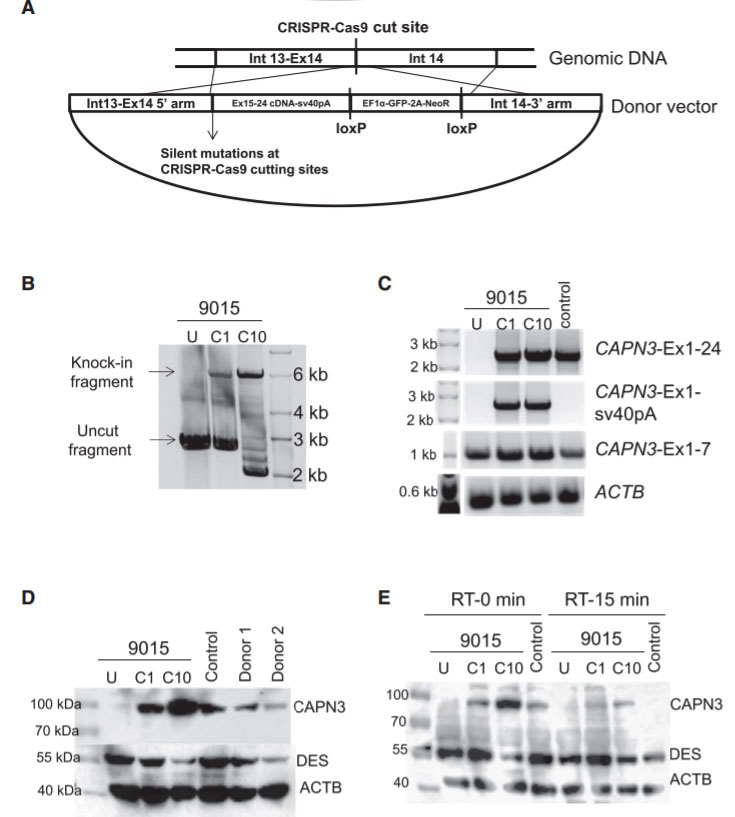
图4:9015 LGMD2A iPSC中CAPN3突变的基因校正。在这项研究中,研究人员采用了基于同源性的修复方法,以基于基因敲入的CAPN3突变校正(A)。通过基因组PCR扩增的LGMD2A iPSCs基因校正(C1和C10)跨区。对基因校正和未经校正的9015 iPSC衍生的肌管以及未受影响的肌管(对照)进行RT-PCR分析。使用蛋白质印迹法在基因校正的(C1和C10)LGMD2A iPSC衍生的肌管中拯救CAPN3蛋白表达。在验证研究中,将患者的父母和与iPSC无关的对照肌管作为参考(D)。另外,还通过蛋白质印迹分析了CAPN3的自催化活性,蛋白质获自从在室温下孵育0或15分钟的肌管获得的裂解物(E)。
CRISPR-U™ 高效修饰iPSC细胞系基因
源井生物专注于iPSC重编程、基因编辑、诱导分化的优化,已建立一套成熟的实验流程。结合源井生物独立创新的CRIPSR-U技术,打靶效率比传统方法提高十倍,真正做到“实验快人一步“!
参考文献:
CRISPR/Cas9-based targeted genome editing for correction of recessive dystrophic epidermolysis bullosa using iPS cells. PNAS, vol. 116(52), 26846–26852, December 26, 2019.
iPSC-Derived Platelets Depleted of HLA Class I Are Inert to Anti-HLA Class I and Natural Killer Cell Immunity. Stem Cell Reports, Vol. 14, 49–59, January 14, 2020.
Gene Correction of LGMD2A Patient-Specific iPSCs for the Development of Targeted Autologous Cell Therapy. Molecular Therapy, Vol. 27 (12) December 2019.










