CRISPR技术将铜绿假单胞菌研究推向新篇章


CRISPR技术将铜绿假单胞菌研究推向新篇章
铜绿假单胞菌是一种革兰氏阴性菌、好氧、呈长棒形的细菌。铜绿假单胞菌是一种主要致病菌,患囊肿性纤维化、烧伤、获得性免疫缺陷综合症和癌症的住院病人易严重感染本菌。铜绿假单胞菌最令人担忧的一点是极易产生耐药性,这是由于抗生素耐药基因(如mexAB、mexXY等)能编码多重耐药泵,以及菌的膜通透性低。由于多重耐药(MDR)、广泛耐药(XDR)和泛耐药(PDR)的菌株不断涌现,这给抗菌治疗带来了严峻的挑战。 大量的研究聚焦于铜绿假单胞菌感染机制的分子基础和开发防治感染的新方法。同时,铜绿假单胞菌是生物膜形成、群体感应、药物靶点和代谢工程研究的模式生物。
基于CRISPR/Cas 9的基因组编辑将加速对铜绿假单胞菌的多功能研究。
· 基因组、蛋白质组和生物学 · 细胞外基质的代谢和维持 · 耐药性 · 分泌系统
基因编辑通常会彻底改变对微生物物种的理解、开发和控制。铜绿假单胞菌是生物膜形成、群体感应、药物靶点和代谢工程研究的模式生物。然而,传统的铜绿假单胞菌遗传操作方法需要多步选择才能产生突变体,并在缺失基因的地方留下疤痕序列。因此,传统的方法仍费时费力。
源井生物研发的CRISPR-B™可高效编辑铜绿假单胞菌的基因。利用CRISPR/Cas9和λ-Red重组系统,可实现铜绿假单胞菌快速、精确、无缝的基因编辑操作。源井生物可以定制铜绿假单胞菌的基因编辑,以及微生物中的各种基因修饰。
硝酸镓(Ganite)是治疗铜绿假单胞菌感染的潜在药物。基于CRISPR/Cas9的基因突变研究表明,铁载体pyochelin介导和ABC转运体是铜绿假单胞菌Ga3+内化的两个主要途径。研究者揭示了Ga3+能抑制铜绿假单胞菌生长和生物膜形成。
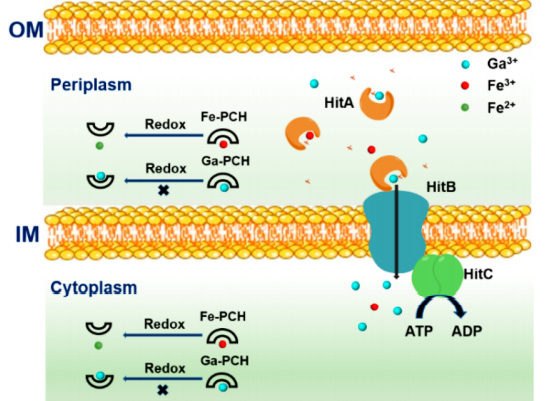
铜绿假单胞菌利用pyochelin介导和ABC转运体通路摄取Ga3+和Fe3+的示意图
硝酸镓能改善CF和慢性铜绿假单胞菌肺部感染患者的肺功能,且无任何严重不良反应,该结果显示硝酸镓具有治疗铜绿假单胞菌感染的潜在临床应用价值。
为了研究铜绿假单胞菌摄取镓的分子机制, 研究人员利用CRISPR/Cas9技术,对铜绿假单胞菌模型菌株PAO1中的关键基因进行突变,以分别阻断铁的吸收途径。 研究中共构建了5个不同的PAO1突变体,(1)PAO1ΔhitA突变体阻断经典的高亲和力铁吸收系统ABC转运蛋白,两个突变体(2)PAO1ΔpvdA和(3)PAO1ΔpchF分别阻断了两个铁载体PVD和PCH的生物合成途径,(4)PAO1ΔfeoB突变体失去了高亲和力的内膜铁离子转运体,(5)PAO1Δtesf突变体取消了Tesf介导的铁吸收途径。
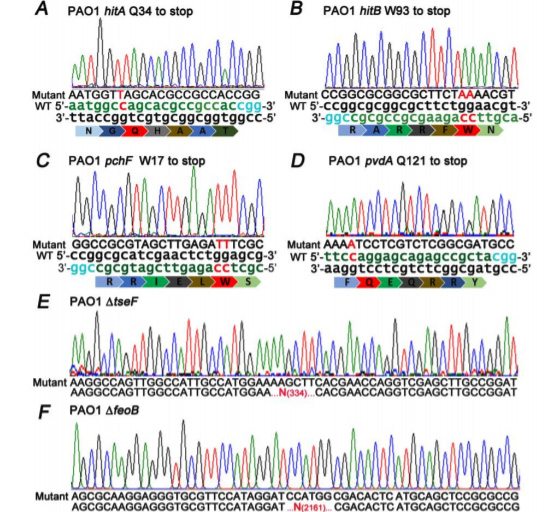
图1:铜绿假单胞菌突变体的测序结果
研究人员通过测定在缺铁培养基中Ga(NO3)3对不同菌株的最低抑菌浓度(MICs),分析Ga(III)对野生型(WT)和不同PAO1突变体生长的影响。他们还分析了不同的铁吸收途径对PAO1和PAO1Δtesf突变体摄取镓的影响。在这个双突变株中也观察到细胞内铁水平的显著下降(图3B),这表明 HitABC转运体是铜绿假单胞菌铁摄取的主要贡献者。
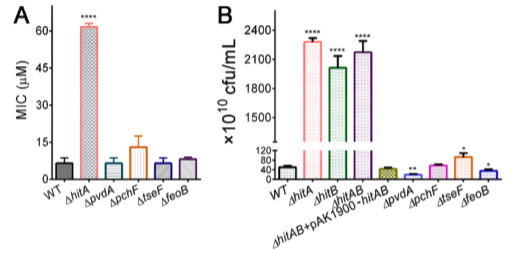
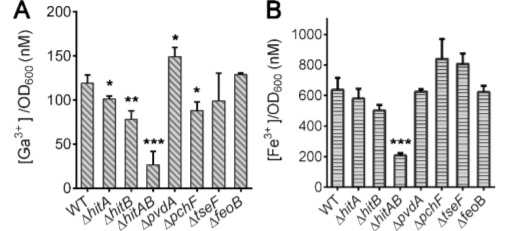
图3:铜绿假单胞菌及其突变体细胞内镓含量(A)和铁含量(B)。
HitA是一种存在于细菌周质中的可溶性铁结合蛋白,与单个Fe3+具有很高的亲和力。HitA在Ga3+摄取过程中也有类似的作用。为了揭示这一现象,他们应用细胞热位移分析(CETSA)观察到Ga3+可以在体内与HitA结合。随后,他们进行了金属竞争试验,观察到Fe3+可以很容易地从Ga3+-HitA蛋白中取代Ga3+。研究人员生成了apo-HitA和Fe3+结合以及Ga3+结合的HitA蛋白的高分辨率晶体结构。Ga3+-HitA的结构与Fe3+-HitA相似,Fe3+的配位球与Ga3+位点上确定的几乎相同,因此证实 Ga3+可以模仿Fe3+占据HitA的金属结合位点。
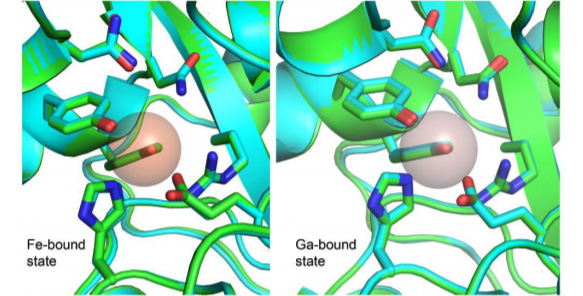
图4:一个不对称单元上两个Fe3+-HitA和Ga3+-HitA链的叠加。金属配位球在两条链上是相同的。
本研究为铜绿假单胞菌内化Ga3+提供分子机制,促进了镓类抗菌药物的开发。
源井生物自主研发的 CRISPR-B™ 技术优化了微生物基因编辑载体及过程。其效率和准确度是传统方法的20多倍。该技术可以广泛应用于细菌和真菌的基因编辑。马上联系我们,了解与您研究相关的服务吧!
参考文献
Identification and characterization of a metalloprotein involved in gallium internalization in Pseudomonas aeruginosa. ACS Infect Dis 2019, 5(10):1693-1697.
Research Topic on Pseudomonas aeruginosa, Biology, Genetics, and Host-Pathogen Interactions. Front Microbiol 2012, 3:20










