科研利器:基因编辑Huh-7细胞系——助力冠状病毒、药物代谢、癌症研究

技术专题

细胞应用干货
Expert Insights - Cell Application
科研利器:基因编辑Huh-7细胞系——助力冠状病毒、药物代谢、癌症研究
浏览量: 726
发布日期: 2025年11月03日
科研利器:基因编辑Huh-7细胞系
——助力冠状病毒、药物代谢、癌症研究
肝脏作为人体五脏之一,与机体正常的代谢、解毒、凝血等过程息息相关,并且参与机体免疫,是维持机体生命不可缺少的重要器官。在进行肝脏疾病的研究中,合适的细胞模型是重要的工具之一,但由于常规肝细胞获取困难、培养难度高、培养成本高昂,在一定程度上制约了肝脏疾病研究的发展。因此,在肝脏研究中选择培养简单、遗传背景稳定的肝细胞系则成为了一种替代选择,其中Huh-7是最为常用肝癌细胞系之一。
Huh-7肝细胞系的应用
Huh-7细胞系由Nakabayshi、H.和Sato,J建立于1982年,是从一名57岁的日本男性的肝脏肿瘤中提取的高分化肝细胞来源的癌细胞系,呈上皮样形态。大多数Huh-7细胞的染色体数目在55 - 63之间,具有高度异质性。
Huh-7对丙肝病毒(HCV)高度敏感,到目前为止,Huh-7及其衍生细胞株是唯一能够有效复制丙型肝炎病毒(HCV)的细胞系,因此Huh-7常被用作研究HCV的模型。可用于筛选抗丙型肝炎病毒的候选药物,和开发抗丙型肝炎的新药。
可用于建立细胞系来源的异种移植(Cell Line Derived Xenograft, CDX)小鼠模型,即Huh-7 CDX模型。此模型可用于临床前肿瘤生长抑制的研究,包括激酶抑制剂(例如.BZG-4000)、FGFR4、抗EGFRvIII抗体等新型抗肿瘤生长疗法(例如sorafenib和silibinin)。
可用于研究肝癌药物药效、代谢,并探讨药物的分子机制。
肝细胞系与CRISPR/Cas9技术相结合,为癌症、药物代谢和冠状病毒等研究提供新思路!
利用CRISPR/Cas9敲除Huh-7的病毒复制关键宿主因子,探索冠状病毒复制的关键基因
CypA(环孢素A结合蛋白)是许多RNA病毒复制的重要宿主因子。此外,有些报道称,一些病毒的复制在不同程度上依赖于CypA。这些研究由于使用了不同的病毒、细胞系和实验设计,因此很难进行比较。科学家研究了三种可以在Huh-7细胞中复制的单链正义RNA病毒的CypA依赖性,分别是马动脉炎病毒(EAV)、人类冠状病毒(HCoV-229E)和中东呼吸综合征冠状病毒(MERS-CoV)。通过比较这些病毒在同一亲本Huh-7细胞,和用CRISPR/Cas9技术产生的CypA基因敲除Huh-7细胞中的复制。
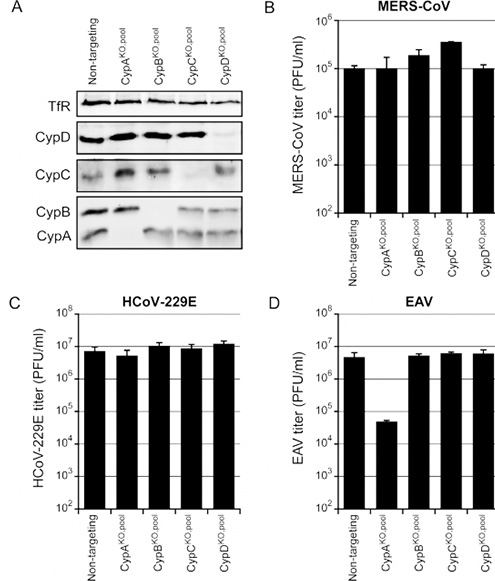
通过核转染法将分别打靶 CypA, CypB, CypC和CypD的sgRNA转入Huh-7细胞中,筛选后获得阳性cell pool。Huh-7 Cyp KO细胞池感染MERS-CoV(B)、HCoV-229E(C)或EAV(D),MOI为0.01。用菌斑法测定48h p.i.(B,C)或32h p.i.(D)时的病毒产量。在所有四个CypKO细胞池中,MERS-CoV和HCoV-229E的滴度没有改变(B和C)。在感染Huh-7 CypA KO细胞池后,EAV病毒滴度降低了2-logs,但在其他敲除细胞池中没有改变。这证明了CypA对EAV的复制起到重要作用。
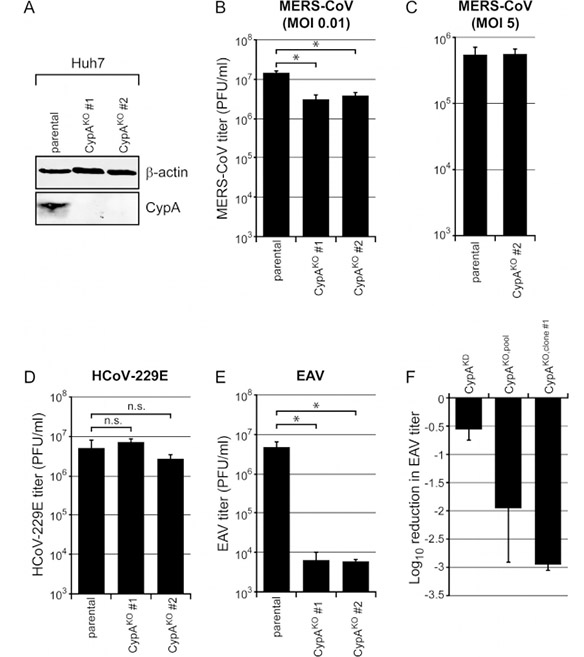
由于Huh7 CypA-KO细胞池可能存在低水平的CypA表达残留,这可能仍然足以支持正常水平的MERS-CoV和HCoV-229E复制,因此需要获得Huh7 CypA-KO单克隆。选择不同的克隆分别进行靶位点扩增及测序验证,筛选出CypA敲除的阳性克隆。野生型Huh-7细胞和Huh-7 CypA-KO克隆#1和#2均感染MERS-CoV、HCoV-229E或EAV。在这两个CypA-KO细胞克隆中,CypA表达的失活显著降低了MERS-CoV的复制(约3倍)。有趣的是,在这两个克隆中,没有发现HCoV-229E缺乏CypA的影响(D)。然而,对于EAV,观察到病毒产量的~3-log下降(E),与之前使用的Huh-7 CypA-KO细胞池相比,表现出10倍强的抑制作用。
综上,在CypB-KO、CypC-KO或CypD-KO细胞池中MERS-CoV、HCoV-229E和EAV的复制没有改变,这表明在Huh-7细胞中,这些病毒的复制不依赖CypB、CypC或CypD。然而,与CypA的情况一样,我们不能排除(非常)低水平的cyp仍然足以支持有效的病毒复制的可能性。敲除CypA使EAV产量降低约3-log,而MERS-CoV子代滴度降低约3倍,HCoV-229E复制没有改变。这项研究表明,不同单链正义RNA病毒的复制对细胞CypA的依赖性有显著差异。
CRISPR/Cas9介导的基因敲除和点突变Huh-7药物代谢模型,便于研究不同基因差异对药物代谢的影响
体外研究药物代谢和相关基因变异常常会使用新鲜分离培养或冷冻保存的人和动物肝细胞;然而,原代肝细胞不是最佳选择,因为它们需要收集肝,价格昂贵;而且它们不是永生化的,在不同的样本之间存在较大差异。在大多数情况下,细胞系在基因组上是相同的。因此, 研究者开发了一种CRISPR/Cas9基因修饰的人肝细胞系,可持续性地研究基因变异对药物代谢影响。研究CYP3A5的变异分别对镇静药或麻醉药咪达唑仑(MDZ)和免疫抑制剂他克莫司(Tac)这两种酶底物代谢的影响。
大约50%的口服药物由CYP3A4和CYP3A5代谢。在P450酶中,CYP3A4和CYP3A5在肝脏中最为丰富,其表达具有高度的变异性。CYP3A5*3(rs776746)等位基因功能缺失在白种人中非常普遍。与具有CYP3A5*1基因型的个体相比,Tac的代谢率较低;然而,CYP3A5*1等位基因在非裔美国人中富集,MDZ、Tac和其他药物的快速代谢。因此,CYP3A5基因型是决定药物适宜剂量的重要因素。
到目前为止,还没有商业化的肝细胞系在7号染色体上二倍体并表达CYP3A5*1。 Huh-7细胞系能通过CYP3A4活性将底物MDZ转化为其代谢产物羟基化的1-OH-MDZ和4-OH-MDZ;然而,Huh-7细胞在MDZ代谢方面不是很有效,因为它们是CYP3A5*3等位基因的纯合体。因此,有必要开发一种肝细胞系,可以在细胞培养中模拟与CYP3A5*1基因型相关的药物快速代谢过程。

通过核转染法将gRNA和Cas9以及ssODN共转入Huh-7细胞中,筛选后挑取单克隆培养。选择不同的克隆分别进行靶位点扩增及测序验证,筛选出基因敲除的阳性克隆。通过敲除或点突变CYP3A5*3的外显子3B的剪接连接点,从而获得了三个CYP3A5*1细胞系。
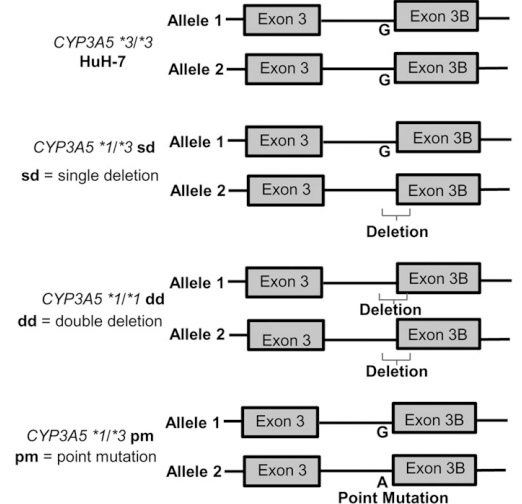
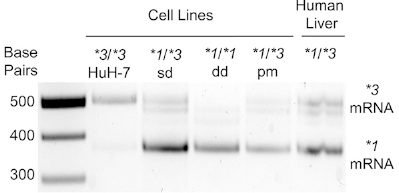
与野生型Huh-7相比,CYP3A5*1/*3sd(杂合子KO)、CYP3A5*1/*1dd(纯合子KO)或CYP3A5*1/*3pm(点突变)表达CYP3A5*1的mRNA,CYP3A5的mRNA和蛋白表达均升高。因此,通过CRISPR/Cas9技术,成功将*3基因型转化为*1基因型,由此激活Huh-7细胞系中CYP3A5的表达。 这个细胞模型可以加快临床前的药物开发,节省时间和金钱,更准确地预测不同人群或基因型的药物代谢、药代动力学、毒性和疗效。
CRISPR/Cas9技术将GFP敲入Huh-7细胞的Nanog,揭示肝细胞癌发病率存在性别差异的原因
肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的恶性肿瘤,其发病率具有明显的性别差异——明显倾向于男性。有研究证明,雄激素/雄激素受体信号轴和前列腺癌、宫颈癌等多种激素相关性肿瘤的发病具有相关性。而肝脏作为雄激素代谢的重要场所,其微环境中雄激素水平也较高,肝细胞癌似乎与雄激素/雄激素受体信号轴有着密切关系。
肿瘤干细胞(Cancer Stem Cells,CSCs)与肿瘤的发生、转移具有密切关系,其具有自我更新和无限增殖的能力,是癌症发展的关键因素。有研究揭示,多能性因子Nanog参与维持CSCs的干性。但雄激素/雄激素受体信号轴是否通过Nanog相关途径对HCC细胞的干性维护产生影响,目前尚不清楚。
研究者发现在肝癌组织中,雄激素受体表达非常高,并与Nanog相关。随后,通过CRISPR/Cas9将GFP标记huh7细胞内源性Nanog,证实了雄激素受体和Nanog在HCC细胞中的共定位。通过核转染法将gRNA、Cas9和Donor共转入huh-7细胞中,进行药筛,药筛完成后挑选单克隆培养。选择不同的克隆分别进行靶位点扩增及测序,筛选出敲入纯合的阳性克隆。
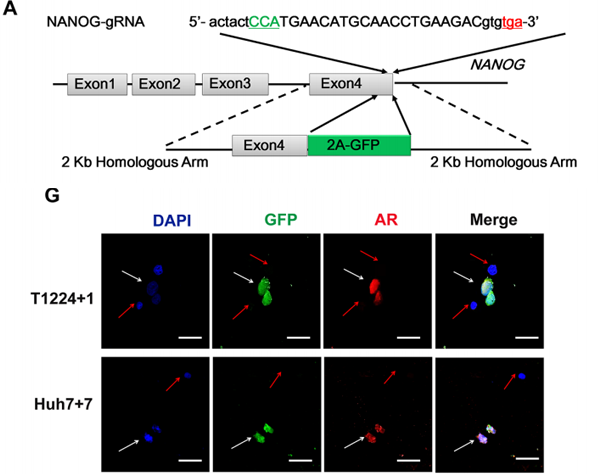
这些研究结果显示, 雄激素/雄激素受体信号轴通过影响肿瘤细胞的干性,为HCC疗法中的这个轴抑制提供了证据,为肝癌治疗中轴突的抑制提供了一种可能的途径。.
通过后续的体外实验,研究者证明了该信号轴可以促进HCC细胞的干性,这种作用是以Nanog依赖性的方式并通过激活其转录来实现的,而这种作用可以通过雄激素阻断或AR降解增强子或而被抑制。
CRISPR-U™可在肝细胞系中进行高效的基因编辑
CRISPR-U™是源井生物自主研发的应用于基因编辑细胞系的独家技术,通过优化基因编辑载体和基因编辑流程,CRISPR-U™技术的基因切割效率和重组效率是普通的CRISPR/Cas9技术的10倍以上,可轻松为您定制您感兴趣 KO、KI、点突变肝细胞系,亦可为您实现各种稳转株需求。
Reference:
de Wilde A H, Zevenhoven-Dobbe J C, Beugeling C, et al. Coronaviruses and arteriviruses display striking differences in their cyclophilin A-dependence during replication in cell culture[J]. Virology, 2018, 517: 148-156.
Dorr C R, Remmel R P, Muthusamy A, et al. CRISPR/Cas9 genetic modification of CYP3A5* 3 in HuH-7 human hepatocyte cell line leads to cell lines with increased midazolam and tacrolimus metabolism[J]. Drug Metabolism and Disposition, 2017, 45(8): 957-965.
Jiang L, Shan J, Shen J, et al. Androgen/androgen receptor axis maintains and promotes cancer cell stemness through direct activation of Nanog transcription in hepatocellular carcinoma[J]. Oncotarget, 2016, 7(24): 36814.
相关服务推荐
基因敲除细胞系
基于CRISPR-U™专利技术,源井生物根据不同细胞特点选择适宜的转染方法(电转法或病毒法),将gRNA和Cas9转入细胞中,然后进行单克隆筛选,通过靶位点扩增及测序验证筛选出成功敲除的阳性克隆,最终交付纯合子细胞株与相关数据报告。










