肝脏作为人体五脏之一,与机体正常的代谢、解毒、凝血等过程息息相关,并且参与机体免疫,是维持机体生命不可缺少的重要器官。在进行肝脏疾病的研究中,合适的细胞模型是重要的工具之一,但由于常规肝细胞获取困难、培养难度高、培养成本高昂,在一定程度上制约了肝脏疾病研究的发展。因此,在肝脏研究中选择培养简单、遗传背景稳定的肝细胞系则成为了一种替代选择,其中HepG2是最为常用肝癌细胞系之一。
HepG2细胞系的应用
HepG2由knowles等建系于1979年,是一种肝母细胞瘤,来源于一名15岁的高加索白人男性肝癌标本。HepG2细胞呈上皮样形态,典型染色体数目为55个。
- 肝炎病毒研究:HepG2不含hepatitis B virus (HBV)和hepatitis C virus (HCV),因此HepG2是常用的研究HBV和HCV细胞系模型。
- 体外HCC模型:HepG2是一种来源于肝细胞癌(HCC)患者肝组织的细胞系,是常见的体外HCC模型。HepG2中p53抑癌基因无突变,因此可用于研究p53与肝细胞癌(HCC)的密切关系,以及HCC的发病、诊治、预防。
- 药物研究:肝脏是人体内药物代谢的最主要器官,也是重要的解毒器官。HepG2细胞系无论在形态上还是功能上都更接近于人的肝组织,该细胞系常用于药物代谢和肝毒性研究。
利用CRISPR/Cas9构建
基因敲除HepG2的HBV感染细胞模型细胞,为彻底治愈乙肝提供新思路
乙型肝炎病毒(hepatitis B virus, HBV)是一种DNA病毒,在细胞外的HBV基因组DNA是一种松弛环状的双链DNA(relaxed circularDNA,rcDNA)分子,当病毒感染细胞,HBV基因组进入到宿主细胞核后,rcDNA会在转化成共价闭合环状DNA(covalently closed circularDNA,cccDNA),并且可以稳定存在。目前,不能彻底治愈乙肝的一个重要原因就在于无法清除肝细胞核内稳定存在的cccDNA。HBV rcDNA向cccDNA的转变是乙肝病毒建立持续性感染的必需步骤,因此,
对HBV cccDNA形成的分子机制的研究对于乙肝治疗有深远意义。
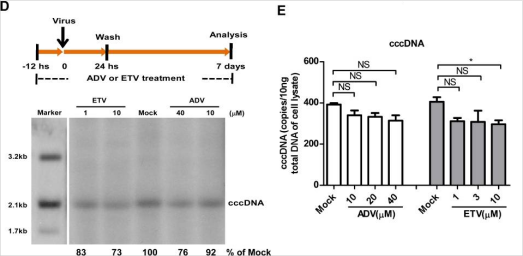
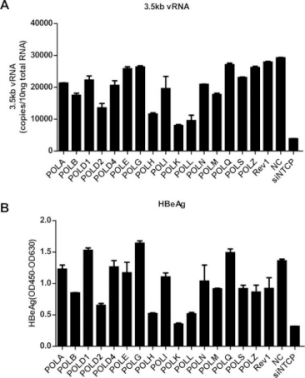
为了探讨HBV cccDNA形成的机制,研究者在HepG2中表达HBV的受体——钠离子-牛磺胆酸共转运蛋白(NTCP),建立了高效的HBV感染HepG2-NTCP细胞模型,在病毒感染24小时后即可检测到cccDNA的形成。随后,使用病毒DNA聚合酶抑制剂以及靶向宿主DNA聚合酶的siRNA进行实验,结果显示HBV 病毒聚合酶在rcDNA转为cccDNA过程中不是关键的因素,而敲降POLK、POLL和POLH能有效降低病毒核衣壳蛋白(HBeAg)和3.5kb vRNA的表达水平,其中敲降POLK显示了最显著的效果。
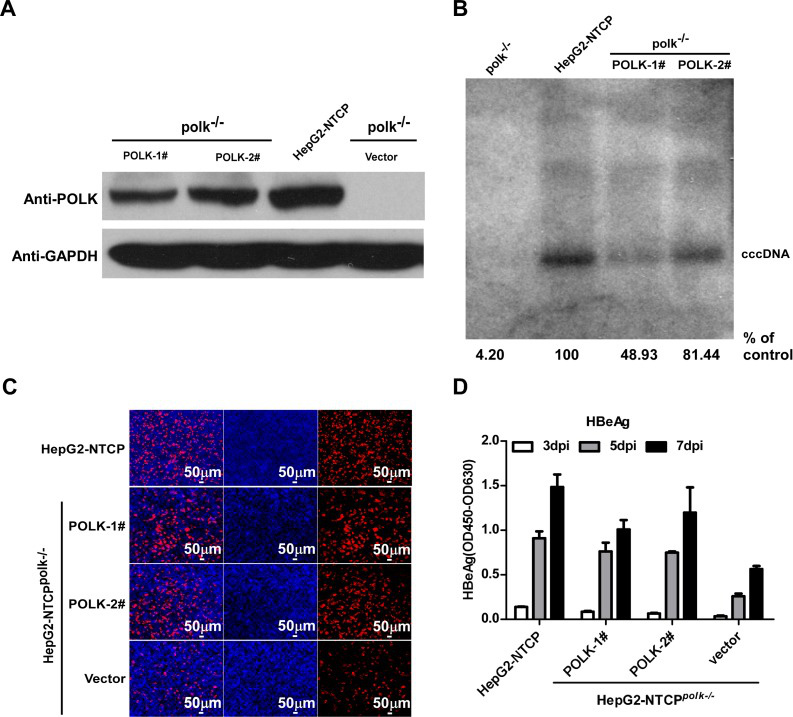
进一步的,利用CRISPR/Cas9在HepG2-NTCP细胞中敲除POLK,可大大减少cccDNA的形成,确认了HBV cccDNA形成过程需要POLK的参与。在POLK敲除的HepG2-NTCP细胞中进行POLK回补,即可恢复HBV cccDNA的合成和病毒蛋白的表达。
该研究有力地表明在HBV感染HepG2-NTCP细胞模型中POLK是HBV cccDNA形成的关键细胞分子,为cccDNA形成的分子机制提供了新的思路,并有助于开发治疗慢性乙型肝炎的新疗法。
CRISPR-U™可以十倍高效地将CRISPR/Cas9转入Hep-G2细胞中 ,筛选后挑取单克隆培养。选择不同的克隆分别进行靶位点扩增及测序验证,筛选出
基因敲除的阳性克隆。
CRISPR/Cas9构建缺失突变细胞HepG2模型,揭秘威尔逊病(hepatolenticular degeneration)的成因
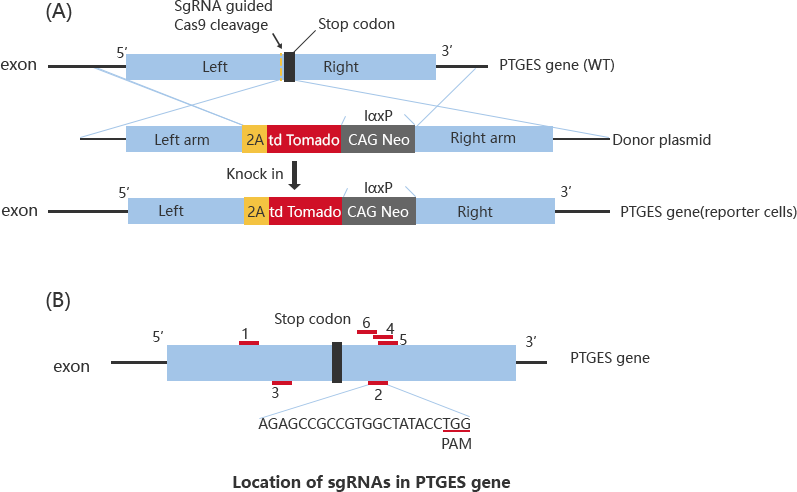
肝豆状核变性(hepatolenticular degeneration)是一种隐性遗传病,是由于ATP7B变异引起基因致病性功能丧失。其特征是铜稳态紊乱导致肝脏疾病和神经系统异常。NM_000053.3:c.1934T > G (Met645Arg) 被报道为复合杂合子,在西班牙血统的患者中高度流行。然而,功能研究表明,该氨基酸的变化并不改变蛋白质功能,导致学者质疑此突变的致病性。随后,研究使用一个minigene系统和CRISPR/Cas9基因编辑HepG2细胞来证明c.1934T > G导致约70%的6号外显子跳跃。
通过核转染法将CRISPR/Cas9以及ssODN共转入HepG2细胞中,筛选后
挑选单克隆培养。对单克隆分别进行靶位点扩增及测序,筛选出以下4个克隆进行研究。
| 克隆 | 基因型 |
|---|
| 2F3 | 复合杂合子,一个等位基因是c.1934T > G, 另外一个是6号外显子部分重复和~5 kb质粒插入。 |
| 1F6 | 纯合子 c.1934T > G |
| 1E8 | 纯合子 c.1934T > G |
| 2A1 | 纯合子移码插入 c.1931dupA (chr13:52535987:C > CT) |
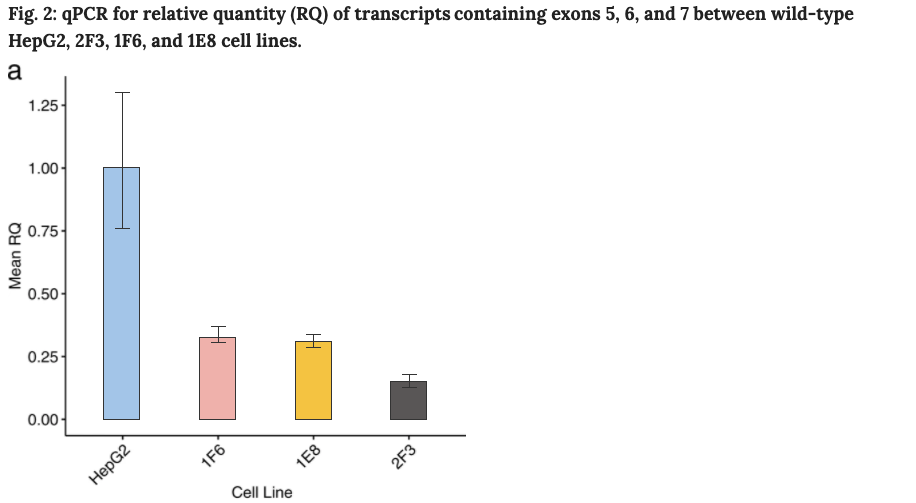
与野生型细胞的转录相比,2F3细胞只有15%的转录本含有外显子5,6,7。与野生型细胞相比,1E8和1F6细胞分别只有31%和33%。
此外,从野生型和经过编辑的HepG2细胞中提取蛋白裂解物,用western blot检测ATP7B蛋白的表达。与野生型细胞相比,复合杂合子(2F3)和纯合子(1E8,1F6)细胞表达ATP7B水平降低。与2F3细胞相比,1E8和1F6纯合子细胞系中ATP7B表达更多。对照组2A1 ATP7B
敲除细胞系没有检测到ATP7B的水平。
研究表明,c.1934T > G导致约6号外显子跳跃,从而引起移码和终止密码子提前出现,从而导致ATP7B功能丧失
。此研究阐明了该点突变在肝豆状核变性疾病中的机制作用,有助于开发恢复正确剪接的基因药物。
mPGES-1是一种末端限速酶(terminal rate-limiting enzyme),负责产生由炎症诱导的PGE2。mPGES-1的抑制剂被认为是治疗炎症和癌症的安全有效的靶点。然而,目前还缺乏一种特异、高效、简便的mPGES-1抑制剂高通量筛选方法。研究者开发了一种通过CRISPR/Cas9敲入荧光蛋白的一种成像策略来监测mPGES-1的表达。
通过使用通过核转染法高效地将gRNA、Cas9和Donor共转入HepG2等肝细胞系中,进行药筛,药筛完成后挑选单克隆培养。阳性克隆通过免疫荧光共定位、测序、RNAi和IL-1β治疗均证实了mPGES-1报告细胞的成功构建。
荧光蛋白KI细胞通过4种常用mPGES-1抑制剂处理后,流式细胞仪检测到荧光信号强度有显著的衰减,表明该 荧光蛋白KI细胞可作为筛选和优化mPGES-1抑制剂的一种高效、简便的方法
。同时,这种KI细胞为靶向小分子化合物的抗炎和肿瘤治疗提供了新的技术支持。
CRISPR-U™可在肝细胞系中进行高效的基因编辑
CRISPR-U™是源井生物自主研发的应用于基因编辑细胞系的独家技术,通过优化基因编辑载体和基因编辑流程,CRISPR-U™技术的基因切割效率和重组效率是普通的CRISPR/Cas9技术的10倍以上,可轻松为您定制您感兴趣基因编辑肝细胞系,亦可为您实现各种转基因的需求。
Qi, Yonghe, et al. "DNA polymerase κ is a key cellular factor for the formation of covalently closed circular DNA of hepatitis B virus." PLoS pathogens 12.10 (2016).
Merico, Daniele, et al. "ATP7B variant c. 1934T> G p. Met645Arg causes Wilson disease by promoting exon 6 skipping." NPJ Genomic Medicine 5.1 (2020): 1-7.
Chen, Zhanfei, et al. "CRISPR/Cas9-based liver-derived reporter cells for screening of mPGES-1 inhibitors." Journal of enzyme inhibition and medicinal chemistry 34.1 (2019): 799-807.


























 联系电话
联系电话
 投诉电话
投诉电话
