THP-1基因敲除细胞:解锁免疫与炎症研究的金钥匙


THP-1基因敲除细胞:解锁免疫与炎症研究的金钥匙
一、THP-1细胞:免疫研究的明星工具
THP-1细胞是从一名急性单核细胞白血病患儿的外周血中分离建立的悬浮细胞系,自1980年建系以来,因其高度接近人原代单核细胞的功能特性(如分化能力、炎症因子分泌)而广受青睐。相较于其他白血病细胞系(如U937、HL-60),THP-1在以下方面表现突出:
增殖速度快:平均倍增时间约为35~50小时,这个生长速率相较于其他白血病细胞系要高得多;
稳定性强:基因背景均一,避免了个体差异对实验的干扰,有利于实验结果的重现;
分化灵活:可被佛波酯(PMA)诱导为巨噬细胞,并通过LPS/IFN-γ或IL-4/M-CSF进一步极化为M1/M2亚型,模拟炎症与修复的动态过程;
安全性高:使用THP-1细胞系的安全性高。暂无报道发现THP-1细胞存在传染性病毒或有毒产物;
疾病模型适配性:如动脉粥样硬化、巨噬细胞分化、免疫与炎症等。
二、CRISPR/Cas9敲除THP-1细胞经典案例
案例1:SLC4A7敲除揭示吞噬体酸化机制
研究者利用CRISPR/Cas9敲除THP-1中的SLC4A7(碳酸氢盐转运体),发现其缺失导致吞噬体pH值升高,杀菌能力显著下降;通过回补实验证实SLC4A7是维持吞噬体酸化的关键基因[1]。
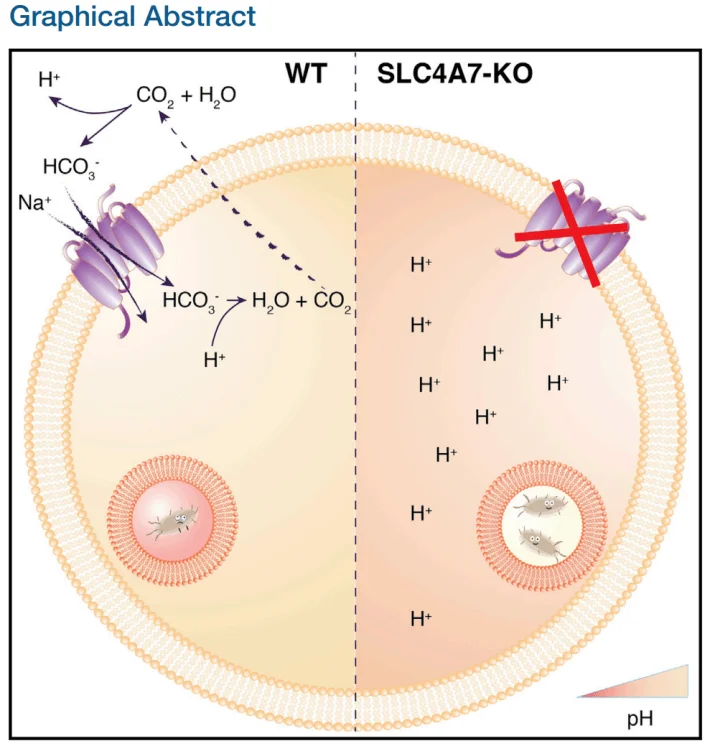
图1
案例2:利用CRISPR/Cas9技术敲除CYBB基因,模拟免疫缺陷模型
敲除CYBB基因(编码NADPH氧化酶亚基)后,THP-1细胞在PMA/LPS刺激下H₂O₂生成减少,同时促炎因子(IL-1β、TNF-α)释放增加,成功模拟CGD患者巨噬细胞表型,这种新的CGD细胞模型为疾病研究提供了强有力的工具,将有助于开发更高效的治疗方法,从而改善患者的生活质量[2]。
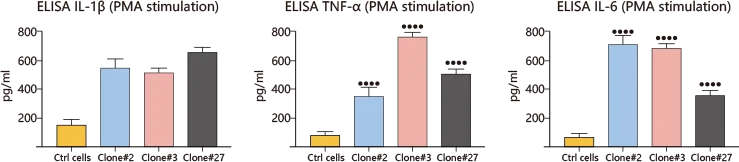
图2
使用CRISPR/Cas9系统在THP-1细胞上进行cGAS、STING、MAVS等基因的敲除,探究RNA-DNA复合物激活抗病毒免疫的分子机制
细胞通过对非自体和自体核酸的识别而引发促炎和抗病毒细胞因子反应,Arun K Mankan等人为了研究RNA-DNA复合物如何激活免疫应答,分别构建了cGAS、STING、MAV敲除的THP-1细胞,分别将dsDNA、pppRNA、RNA-DNA复合物导入细胞,发现RNA-DNA复合物可能是通过cGAS-cGAMP-STING通路进行免疫激活。
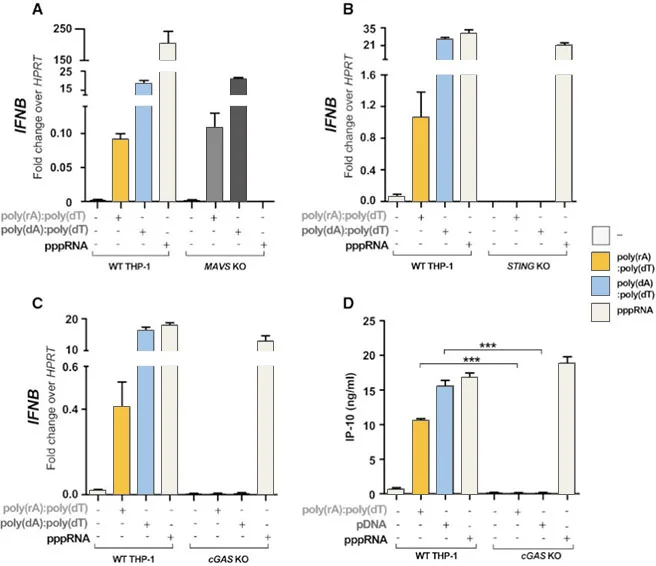
图3
三、THP-1基因敲除全流程解析(慢病毒法)
CRISPR/Cas9敲除THP-1细胞需经历以下关键步骤:
1)sgRNA设计与载体构建:针对目标基因外显子设计sgRNA,构建至慢病毒载体
2)慢病毒包装与感染:通过293T细胞包装慢病毒,优化感染复数(MOI),并添加Polybrene提升感染效率
3)抗生素筛选与单克隆扩增:采用相应抗性进行分步筛选,获得Cas9稳定表达株及sgRNA阳性细胞。
4)基因型验证:通过酶切、测序及Western blot确认敲除效率,筛选纯合克隆。
四、源井生物技术优势:高效构建基因编辑细胞
源井生物凭借CRISPR-U™、EZ-HRex™等独家专利技术,在细胞基因编辑领域占据领先地位。
高效编辑:基因敲除效率高达80%,远超传统方法(普通CRISPR效率仅10%-30%);
全流程服务:涵盖sgRNA设计、慢病毒包装、单克隆筛选及功能验证,支持敲除(KO)、点突变(PM)、敲入(KI)等多种需求;
成功案例库:已构建超5000种敲除细胞株,覆盖免疫、肿瘤、代谢等研究领域;
快速交付:标准项目周期仅需6周,支持急单加急。
五、总结
THP-1细胞凭借其高度可分化性和稳定的基因背景,成为免疫与炎症研究的理想模型。结合CRISPR/Cas9技术,可精准构建疾病模型、解析基因功能并加速药物开发。源井生物通过CRISPR-U™、EZ-HRex™技术点突变/敲入,技术与全流程服务体系,为研究者提供高效、可靠的基因编辑解决方案,助力科研突破!
立即咨询源井生物,定制您的THP-1基因编辑方案!
点击链接:源井生物基因编辑服务
技术热线:4006889033
参考文献
[1] Sedlyarov V, Eichner R, Girardi E, et al. The bicarbonate transporter SLC4A7 plays a key role in macrophage phagosome acidification[J]. Cell host & microbe, 2018, 23(6): 766-774. e5.
[2] Benyoucef A, Marchitto L, Touzot F. CRISPR gene-engineered CYBBko THP-1 cell lines highlight the crucial role of NADPH-induced reactive oxygen species for regulating inflammasome activation[J]. Journal of Allergy and Clinical Immunology, 2020.
[3] Mankan A K, Schmidt T, Chauhan D, et al. Cytosolic RNA: DNA hybrids activate the cGAS–STING axis[J]. The EMBO journal, 2014, 33(24): 2937-2946.










