IF=9.6 | 精准突袭,突破血脑屏障:Bioorthosome开启胶质母细胞瘤治疗新纪元

胶质母细胞瘤(GBM)因血脑屏障(BBB)的存在,一直是神经肿瘤治疗领域的“硬骨头”。近期,《Nano Research》发表了一项突破性研究,提出了基于代谢糖工程和生物正交化学的智能脂质体药物递送系统——Bioorthosome。该系统通过“隐形-激活”机制精准跨越BBB,在肿瘤微环境中实现靶向释放,有效提升了药物递送效率与抗肿瘤效果。体内外实验均显示出显著的治疗优势与安全性提升,预示着GBM精准治疗的新希望。本文将带你深入解析这一创新技术,探寻其在未来肿瘤治疗中的巨大潜力。
Bioorthosome的创新设计
本研究提出了一种名为Bioorthosome的新型脂质体药物递送平台。其核心优势在于结合了阻断型生物正交化学(Blocked Bioorthogonal Chemistry)和pH响应脂质体的设计,创新性地克服了传统药物递送系统在跨越血脑屏障时的局限性。
Bioorthosome通过在正常组织中“隐形”,避免了对健康组织的无差别反应。当它到达肿瘤区域时,肿瘤微环境的酸性特征会激活脂质体上的生物正交化学基团,从而精准地释放药物于肿瘤部位。这种设计赋予了Bioorthosome高度的靶向性和选择性,使其在治疗GBM时能够减少对正常组织的副作用。
工作机制与原理:
“隐形”与“激活”: Bioorthosome的表面携带特殊的麦芽糖(MA)配体,这一配体能够通过大脑的GLUT1通道穿越血脑屏障。一旦到达肿瘤区域,肿瘤微环境的酸性条件便触发其“激活”机制——MA配体脱落,暴露出生物正交基团(如DBCO基团)。
生物正交反应: 这些暴露出的生物正交基团可以与肿瘤细胞表面经过代谢糖工程引入的叠氮基团发生特异性的生物正交反应,从而实现药物的精准释放,类似于“定向导弹”锁定肿瘤目标。
通过这种机制,Bioorthosome能够实现药物对肿瘤细胞的高效递送,同时避免了传统药物递送系统在正常脑组织中的不必要释放,从而减少了副作用。
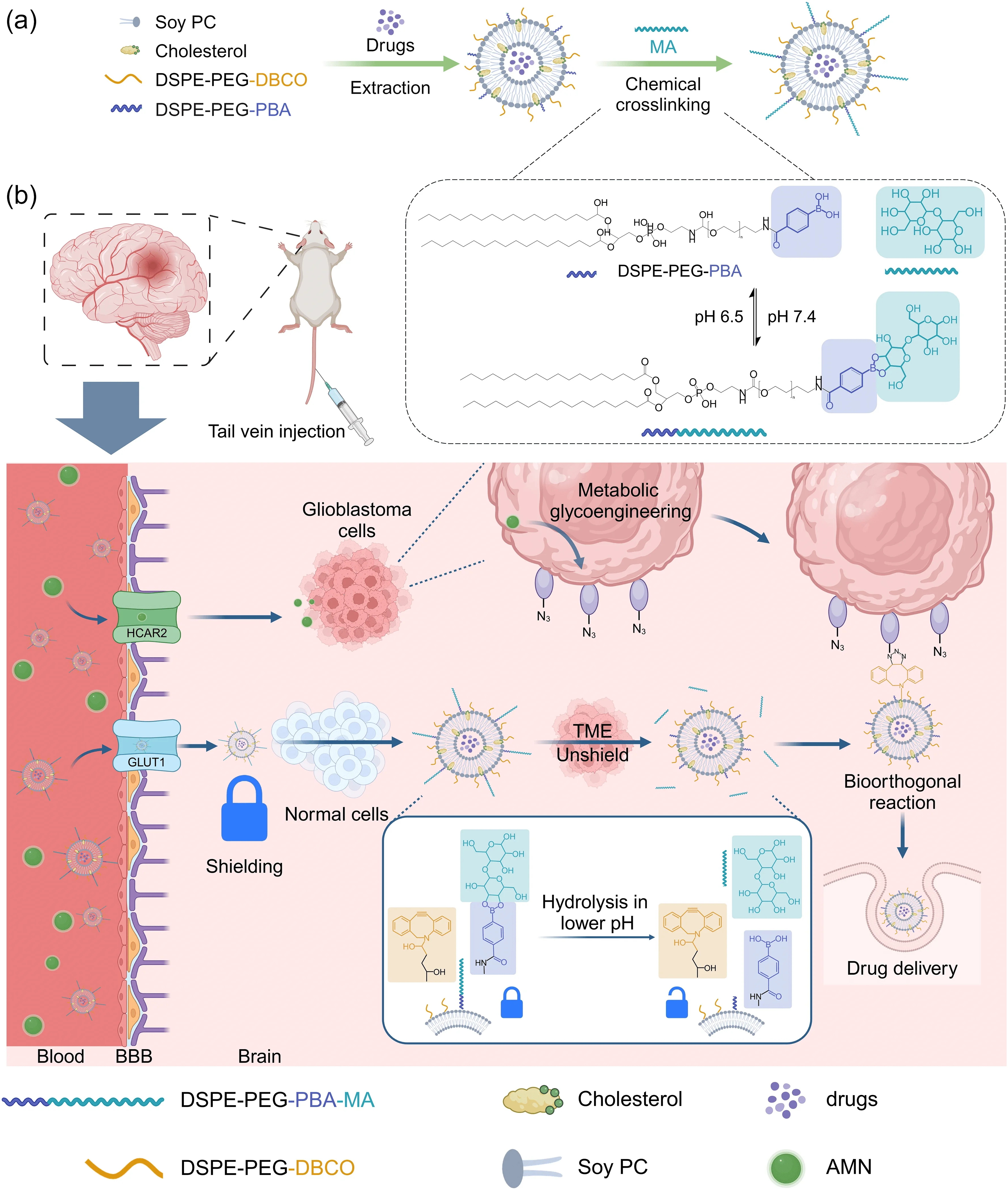
图1
体外与体内实验验证:
体外实验:研究团队在体外测试中发现,使用Bioorthosome联合“替莫唑胺(TMZ)”的组合治疗,在AMN预处理的GBM细胞上显著提高了细胞毒性。其药效比单独使用Bioorthosome或TMZ的组别高出约5.3倍。
体内实验:在小鼠GBM模型中,Bioorthosome表现出了能够穿越血脑屏障并精准定位到肿瘤部位的能力。实验中,尾静脉注射ICG标记的Bioorthosome后,小鼠脑内的荧光信号明显增强且持续时间更长,表明该系统在体内也能够成功跨越BBB,并在肿瘤位置聚集。
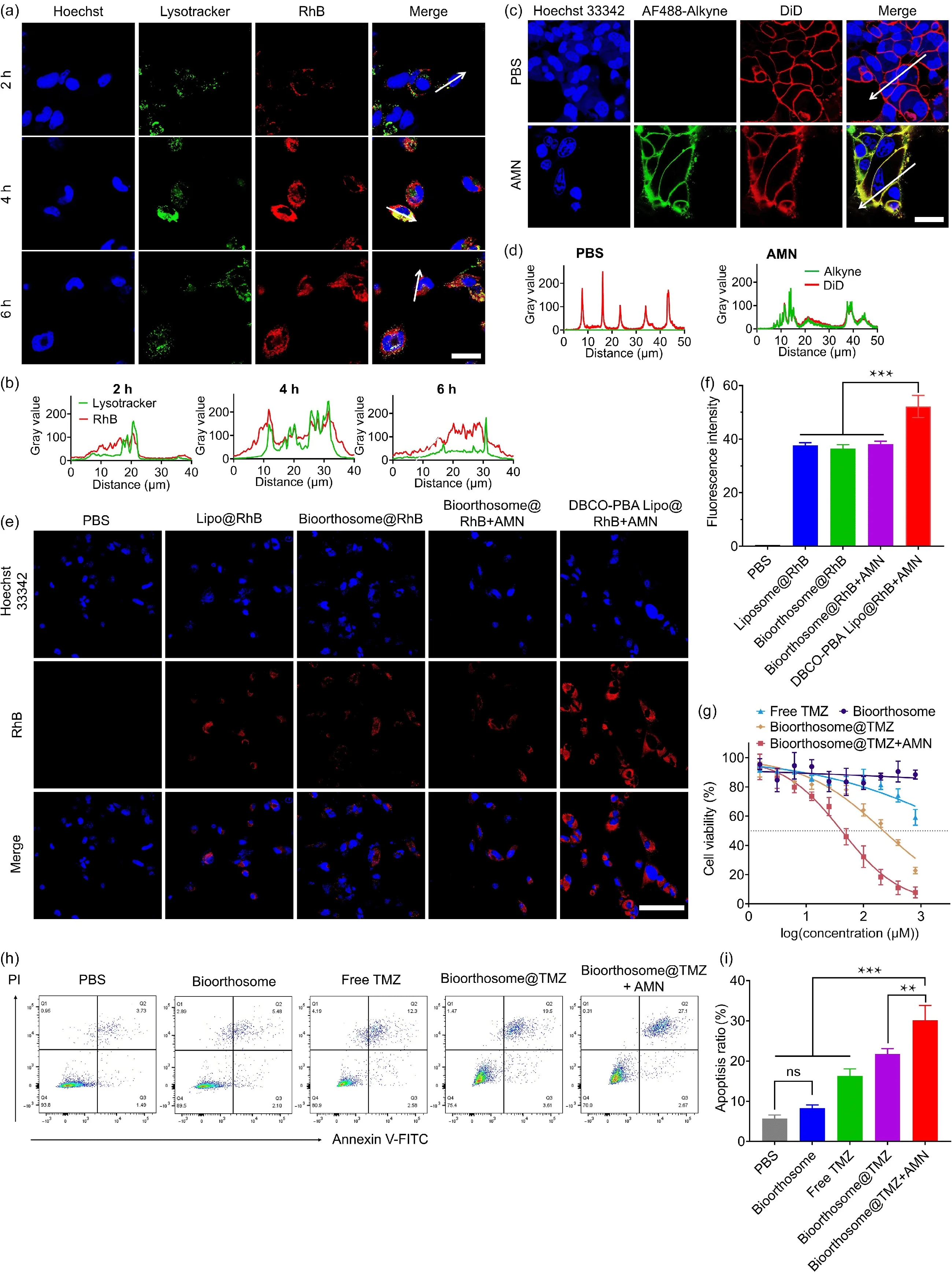
图2
在治疗实验中,Bioorthosome@TMZ联合AMN的治疗效果非常显著。接受这种治疗的小鼠中位生存期较生理盐水组延长了29.2%,比单独使用Bioorthosome的组延长了26.2%。与传统的自由TMZ治疗相比,Bioorthosome@TMZ组的小鼠体重减轻程度显著减轻,显示该系统不仅提高了疗效,而且减少了对正常组织的损害。
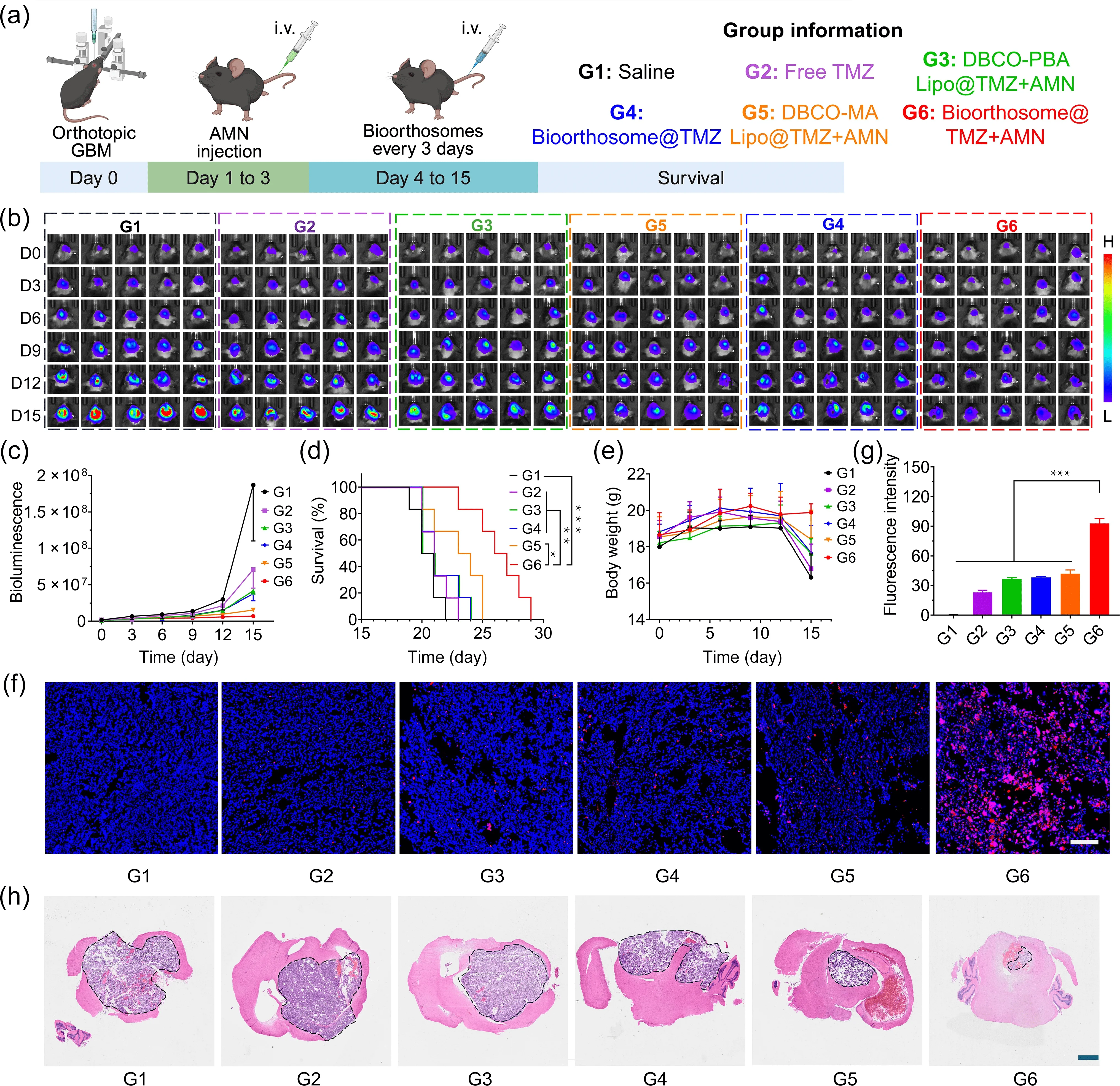
图3
未来展望与临床潜力:
Bioorthosome作为一种新型的药物递送系统,突破了传统脂质体药物递送的多重限制,尤其是在血脑屏障穿越和肿瘤靶向性方面的创新。未来,随着技术的进一步优化和临床前研究的深入,Bioorthosome有望在GBM治疗中发挥重要作用,为广大患者带来新的治疗希望。
随着生物正交化学技术的不断发展,类似的系统可能会被应用于其他类型的癌症治疗,开启癌症精准治疗的新纪元。研究团队相信,Bioorthosome不仅是GBM治疗的突破性进展,也为其他神经系统疾病的治疗提供了新的方向
源井生物提供的支持:
源井生物为该研究提供了关键的细胞模型支持。
Luc细胞系>>的引入使得研究团队能够通过活体成像技术实时监测药物递送的效果,进一步验证了Bioorthosome在体内的表现。
总结:
本文所提出的Bioorthosome平台为胶质母细胞瘤的治疗提供了创新的药物递送方案。通过结合阻断型生物正交化学与pH响应脂质体技术,Bioorthosome能够有效突破血脑屏障并实现药物的精准递送。该研究的成功验证了该平台在体外和体内实验中的优异表现,且未来具有巨大的临床应用前景。
参考文献
Wang C, Wu J, Duan Z, et al. Blocked bioorthogonal chemistry enabled switchable bioorthosome to improve liposomal drug delivery for glioblastoma therapy. Nano Research, 2025, 18(4): 94907338. https://doi.org/10.26599/NR.2025.94907338
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划



























 联系电话
联系电话
 投诉电话
投诉电话
