先导编辑(Prime Editing):精准基因治疗的革命性突破

在构建基因点突变细胞系时,科学家们已经开发了多种技术手段,例如RNP(核糖核蛋白)法可直接递送蛋白复合体且效率高,但需要结合电转设备)、单碱基编辑器(Base Editor)(适合实现特定类型的碱基置换)、质粒抗性筛选法(通过筛选抗性细胞群体提高成功率)以及近年来备受关注的先导编辑(Prime Editing)等。每种方法如同工具箱中的利器,拥有各自独特的优势与应用场景,科学家们需要根据项目目标灵活选择。今天,小源将为大家重点介绍近年来基因编辑领域颇受关注的一种方法——先导编辑(Prime Editing)!
一、什么是先导编辑?
先导编辑(Prime Editing,PE)由哈佛大学David Liu团队于2019年首次提出的一种“无断裂、可编程”的精准基因编辑技术。与传统CRISPR-Cas9系统依赖于DNA双链断裂(DSB)不同,先导编辑通过一种融合了Cas9 nickase(单链切口酶)与逆转录酶(RT)的蛋白复合体,在基因组中实现“搜索-替换”式的精准编辑,不仅大幅降低了脱靶率和染色体重排风险,还极大地拓展了编辑种类和范围:
1. 精准实现单碱基替换(不仅限于A>G或C>T)
2. 支持小片段的插入、缺失与定向编辑
3. 不引发大规模DNA损伤,安全性更高
4. 适配更广泛的细胞类型和应用场景(包括难编辑的细胞系)
Prime Editing打开了基因编辑的新纪元,尤其在疾病模型构建、细胞治疗开发、功能基因研究等领域,展现出令人兴奋的应用前景。
二、先导编辑核心原理
PE系统主要包含三个关键组件 :
1.先导编辑引导RNA(pegRNA):识别待编辑目标核苷酸序列,并编码用于替换目标序列的新遗传信息。pegRNA 由一个扩展的单向导RNA(sgRNA)构成,其中包含引物结合位点(PBS)和逆转录(RT)模板序列。在基因组编辑过程中,PBS 允许带切口的 DNA 链的 3' 端与pegRNA 杂交,而 RT 模板则作为合成编辑后遗传信息的模板。
2.Cas9 H840A切口酶与莫洛尼鼠白血病病毒(M - MLV)逆转录酶的融合蛋白:Cas9 H840A 切口酶是对Cas9酶进行改造所得,Cas9酶原本含有两个可切割DNA序列的核酸酶结构域,即切割非靶链的 RuvC结构域和切割靶链的HNH结构域。通过引入H840A替换(将第 840位的组氨酸替换为丙氨酸),使HNH结构域失活,此时只有RuvC结构域发挥功能,使得改造后的Cas9仅能在DNA上引入单链切口,故而称为切口酶。M - MLV逆转录酶则可从单链RNA模板合成DNA。
3.单向导RNA(sgRNA):其作用是引导融合蛋白中的Cas9 H840A切口酶部分对未编辑的DNA 链进行切割。
编辑流程:
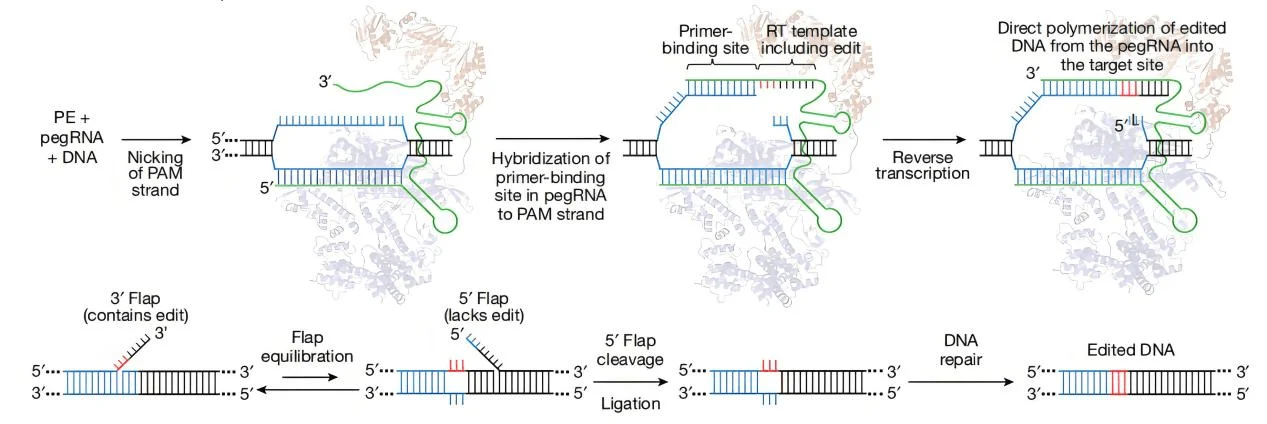
图1 PE的基本原理(Anzalone et al.,2019)
基因组编辑时,将pegRNA和融合蛋白转染到细胞中(通常借助载体将它们导入细胞)。融合蛋白对目标DNA序列进行切割,产生一个单链切口,暴露出3'- 羟基末端,该末端可起始对pegRNA中RT模板部分的逆转录过程,形成一个分支中间体,该中间体包含两条DNA链:一条3' 链含有新合成的(编辑后的)序列,一条5' 链含有未编辑DNA序列。随后,5' 链被结构特异性核酸内切酶或5' 外切核酸酶切割,使得3' 链能够进行连接,形成由一条编辑链和一条未编辑链组成的异源双链DNA。重新退火的双链DNA在编辑位点处存在核苷酸错配,细胞利用自身的错配修复机制对其进行校正,可能导致两种结果:一是将编辑链上的信息复制到互补链上,永久固定编辑;二是将原始核苷酸重新掺入编辑链,排除编辑。
先导编辑(Prime Editing, PE)在设计上进一步减少了对DNA双链断裂(DSB)的依赖,从而在一定程度上降低了染色体异常等潜在风险。得益于其独特的“搜索-替换”机制,PE技术能够覆盖约89%的已知致病突变,并支持多达12种类型的碱基转换及小片段精准编辑,拓展了基因修饰的多样性与精度,为精准医学与细胞模型构建提供了新的可能性。
三、PE技术进化史:
|
先导编辑 |
时间 |
特点 |
作用机制 |
|
PE1 |
2019 |
能实现基本编辑,但效率低、有非特异性编辑 |
pegRNA与nCas9组成复合物,找到目标DNA链并结合。Cas9切割出单链切口,切口3'端与 pegRNA的PBS结合,激活逆转录酶,逆转录酶按RTT模板合成编辑序列,编辑序列和原序列竞争结合另一条DNA链,没结合上的被细胞机制切除。 |
|
PE2 |
2019 |
改造M - MLV逆转录酶,编辑效率是PE1的1 - 5倍 |
在PE1基础上,给M - MLV逆转录酶换5个氨基酸,让它和DNA - RNA结合更牢、稳定性更好、耐高温,与pegRNA结合更紧密,加速逆转录,提高编辑效率。 |
|
PE3 |
2019 |
重新设计sgRNA,避免PE3的indel问题 |
重新设计sgRNA,把编辑序列加进去。Cas9切割时,引导DNA错配修复机制,按编辑单链精准修复互补链,避免双链切割造成的indel,提高编辑准确性。 |
|
PE3b |
2019 |
重新设计sgRNA,避免PE3的indel问题 |
重新设计sgRNA,把编辑序列加进去。Cas9切割时,引导DNA错配修复机制,按编辑单链精准修复互补链,避免双链切割造成的indel,提高编辑准确性。 |
|
双先导编辑(Twin PE) |
2021 |
可编辑较大片段,精准度高,有治疗潜力 |
用一个先导编辑蛋白和两个pegRNA,在基因组不同位点切出单链切口,避免双链断裂的不良后果。还能通过安装 “着陆位点”,配合位点特异性重组酶,实现长片段基因的插入、替换或删除。 |
|
PE4、PE5 |
2020 - 2021 |
短暂表达MLH1dn蛋白,减少错配修复影响和indel |
DNA 错配修复(MMR)机制会降低引导编辑效率并增加 indel 副产物。研究发现,敲低 MMR 相关基因(如 MSH2、MSH6、MLH1、PMS2)可显著提高引导编辑效率。基于此开发的 PE4 和 PE5 系统,通过共表达显性负性 MLH1(MLH1dn)抑制 MMR,在多种细胞中分别比 PE2 和 PE3 提高了 7.7 倍和 2.0 倍的编辑效率,同时提升了编辑 /indel 比率。此外,在目标编辑位点附近引入沉默突变,可逃避 MMR 识别,进一步提高引导编辑效率。 |
|
PEmax |
2024 |
比PE2在Hela细胞编辑效率提高2.5 倍,HEK293T细胞提高1.2倍 |
从多方面优化PE2:优化逆转录酶密码子,让细胞翻译更高效;改变SpCas9氨基酸,提升切割活性;在酶两端加NLS肽段,增强酶对核酸的吸附力,加快编辑过程,大幅提高编辑效率。 |
|
PE7 |
2024.4 |
相比PEmax,在U2OS细胞系编辑效率提升超10倍;点突变成功率比PE5提升20%;难编辑位点效率提升1.76 - 4.71倍,易编辑位点最高提升至86% |
普林斯顿大学团队发现小RNA结合外切核酸酶保护因子La是关键。PE7把La和先导编辑蛋白融合,用优化后的pegRNA。La能和新生RNA聚合酶III转录本3'端的多聚尿苷结合,与pegRNA 3' 端相互作用,促进多种先导编辑器、多种编辑类型及不同细胞的编辑,提高编辑效率。 |
|
核酸酶先导编辑器(uPEn) |
2025 |
编辑效率高,能多位点编辑,在畜禽育种有很大潜力 |
集成i53模块优化细胞内DNA修复环境。在细胞和动物受精卵编辑中,协同pegRNA和相关酶,精准引导修复,提高效率。能同时对多个基因操作,如在湖羊中同时敲除MSTN基因、敲入PPARG基因的Kozak基序。 |
表1.PE不同版本之间的区别
四、先导编辑应用前景
先导编辑技术凭借高效、精准和低脱靶率的特点,在多个领域有着广泛应用前景。
1. 疾病治疗
单基因遗传病治疗:苯丙酮尿症(PKU)由PAH基因突变导致,通过设计pegRNA引导Cas9切口酶结合,逆转录酶合成正常PAH基因序列并整合到基因组,在小鼠模型中成功纠正突变,恢复苯丙氨酸正常代谢,约40%的小鼠PAH酶活性显著恢复,血中苯丙氨酸浓度降至正常水平。镰状细胞贫血由β-珠蛋白基因突变引起,2023年4月,《Nature Biomedical Engineering》发表的研究显示,利用PE技术在患者造血干细胞中编辑突变基因,部分实验中成功编辑比例达20%-30%,为该病治疗提供了新思路。
眼科疾病治疗:莱伯先天性黑朦症是一种遗传性视网膜疾病,可致儿童失明或严重视力障碍。研究人员利用腺相关病毒载体将PE2递送至患病小鼠模型中,精准校正致病突变,改善了疾病表型,且未检测到脱靶编辑。实验中,约60%的治疗小鼠视网膜电图(ERG)反应幅度提升,视网膜功能明显改善,视觉功能有所恢复。这一成果为眼科遗传疾病治疗提供了新策略,相关研究发表于《Journal of Experimental Medicine》。
2. 基因功能研究
有研究对乳腺癌细胞系中的BRCA1基因进行PE编辑,成功构建BRCA1缺失细胞模型,约70%的细胞实现预期编辑,且在体外增殖和迁移能力上与未编辑细胞有显著差异。这一成果为肿瘤基因功能研究提供了重要实验依据。
3. 药物研发
在针对EGFR基因突变相关肺癌的研究中,利用PE技术构建携带EGFR敏感突变的细胞系,筛选出的新型靶向药物抑制率超80%,显著优于传统药物。此外,PE技术还可优化药物靶点,通过精准编辑改变靶点基因对药物的亲和力或敏感性,提升药物治疗指数,为药物开发提供新手段和研究方向
4. 农业育种
在水稻中,PE技术被用于编辑相关基因,成功培育出具有优良性状(如抗倒伏和增产)的植株。对水稻的SD1基因进行PE编辑后,约30%的编辑植株表现出显著的矮化和茎秆粗壮的抗倒伏性状,同时产量较野生型提高了10%-15%,为水稻品种改良提供了新途径。2025年2月,南京农业大学万永杰教授和张艳丽教授课题组在《Protein & Cell》期刊发表研究成果,成功利用升级后的核酸酶先导编辑器(uPEn)在湖羊中实现MSTN/PPARG双基因高效编辑,为培育生长性能更好、肉质更佳的湖羊新品种提供了可能。
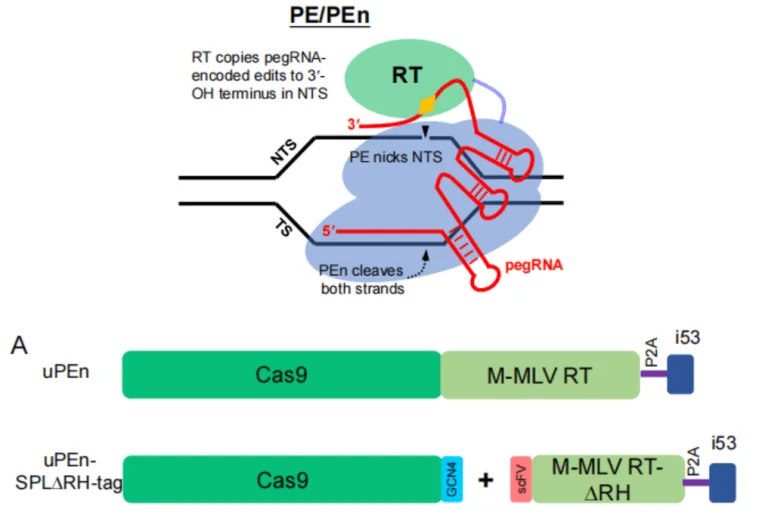
图2.南京农业大学与南京大学合作开发出升级版PE工具(uPEn)
五、小源总结
在传统基因编辑技术为生命科学研究与应用奠定坚实基础的背景下,先导编辑(Prime Editing, PE)作为一种无需依赖DNA双链断裂和供体模板的新型精准编辑工具,展现了广阔的应用前景。自PE1至PE7及其衍生策略不断发展,PE在编辑效率、精准性及操作灵活性方面持续优化,拓展了从疾病治疗、基因功能研究到药物开发与农业育种等多个领域的应用空间。展望未来,随着pegRNA设计、逆转录酶性能提升、DNA修复机制理解加深及递送技术(如纳米载体、靶向病毒载体)创新,PE有望进一步丰富基因组编辑工具箱,为生命健康与可持续发展的挑战提供有力支撑。
参考文献
[1] Anzalone, A. V., Randolph, P. B., Davis, J. R., et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature,2019,576(7785).
[2] Chen PJ, Hussmann JA, Yan J., et al. Enhanced prime editing systems by manipulating cellular determinants of editing outcomes. Cell. 2021 Oct 28;184(22):5635-5652.e29.
[3] Yan J, Oyler-Castrillo P, Ravisankar P., et al. Improving prime editing with an endogenous small RNA-binding protein. Nature. 2024 Apr;628(8008):639-647.
[4] Mao W, Wang P, Zhou L., et al. An upgraded nuclease prime editor platform enables high-efficiency singled or multiplexed knock-in/knockout of genes in mouse and sheep zygotes. Protein Cell. 2025 Jan 20:pwaf006.
[5] Chen PJ, Liu DR. Prime editing for precise and highly versatile genome manipulation. Nat Rev Genet. 2023 Mar;24(3):161-177.
[6] Everette KA, Newby GA, Levine RM., et al. Ex vivo prime editing of patient haematopoietic stem cells rescues sickle-cell disease phenotypes after engraftment in mice. Nat Biomed Eng. 2023 May;7(5):616-628.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划

























 联系电话
联系电话
 投诉电话
投诉电话
