干货|一文了解基因点突变研究常用方法


干货|一文了解基因点突变研究常用方法

自1996年4月人类基因突变数据库(HGMD)首次公开600个基因~约10000个基因突变开始,其逐年持续扩充新的突变信息。截至本文撰写之日(2024年7月24日),已收录了291339种各不相同的基因突变,而这些突变均被认为与人类遗传疾病紧密相关。其中,Missense/nonsense(错义突变)的占比最为突出,高达58%,属于最常见的致病类型。
研究点突变与疾病的关系、筛选治疗点突变疾病的药物或开发针对点突变疾病的新疗法,通常需要先构建点突变细胞系模型。本文以体外细胞实验来介绍常用的3种点突变研究方法,难度从入门到进阶再到高阶,快拿起小本本和小源一起来学习。
入门篇:过表达突变转录本
方法描述
在野生型(未经过任何基因编辑的)细胞中,通过瞬转或稳转的方法引入包含突变基因的表达载体,使突变基因在细胞内表达。通常用于初步筛选,筛选出来的突变还需进一步进行实验验证。
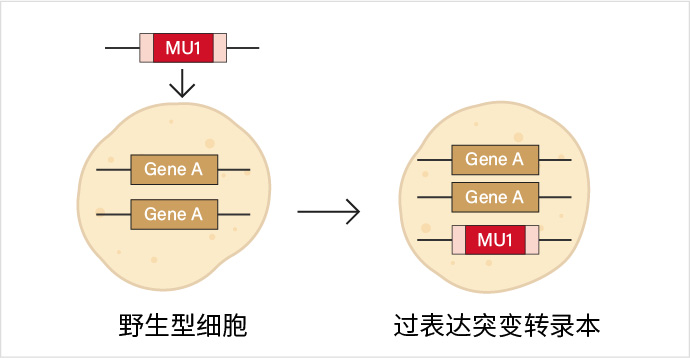
过表达突变转录本示意图
优点
1. 操作简便:无需进行基因敲除等复杂的基因编辑,只需构建表达载体,进行转染或转导,操作难度最低。
2. 周期最短:可以快速获得表达突变基因的细胞系,使用瞬转方法可快至几周即可获得初步筛选结果。
3. 表达量高:一般可以实现较高水平的突变基因表达,便于检测,以及分析高表达条件下的增益效应。
缺点
1. 非生理表达水平:高水平的外源基因表达可能导致非生理性表型,影响结果解读。
2. 内源基因干扰,表型不确定:内源基因正常表达,可能会干扰外源突变基因的表达,不易观察到突变表型。
3. 非编码区不适用:对于研究启动子、内含子等非编码区的点突变,该方法具有局限性。
应用案例
Horsch等人在小鼠成纤维细胞NIH3T3中分别过表达KRAS野生型和12、13位的突变体(KRASOE,KRASG12V,KRASG13D),同时测定了Kras mRNA水平、Ras蛋白和活化Ras蛋白水平。此外,还使用全基因组表达谱分析对3组转染细胞之间的差异进行研究。最后,通过识别和表征由Kras过度表达和不同突变形式所差异调控的基因,从而为理解该致癌基因如何调控细胞转化和肿瘤的发生提供了新见解[1]。
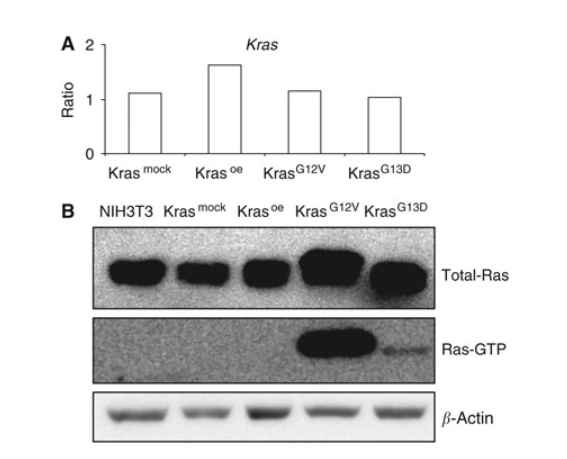
图1.Kras野生型和不同突变体过表达后的检测
进阶篇:过表达突变转录本
方法描述
首先通过CRISPR/Cas9等基因编辑技术将内源基因敲除,然后在敲除背景下引入突变型基因进行过表达。这种方式能够与野生型转录本过表达同步开展,相当于做了rescue实验来验证基因功能。该方法适用于一次研究多个点突变但预算有限的情况或者多个突变位点距离较远、需多次点突变的情况,可作为备选的替代方案。需要注意的是,该方法需防止过表达的转录本被gRNA回切。通常可将gRNA设计在不同的内含子上以敲除整个外显子,或者使用RNP方式进行内源基因KO来避免这一问题。
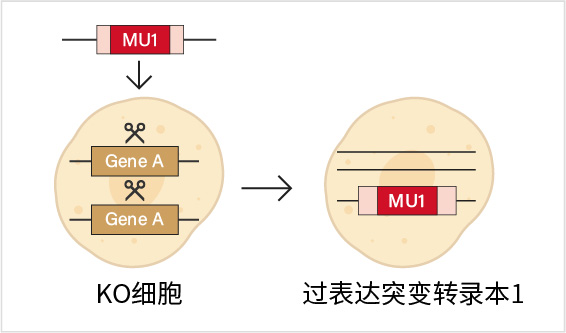
KO+过表达突变转录本示意图
优点
1. 无内源基因干扰:内源基因敲除后,外源突变基因不会受到内源基因的竞争性干扰。
2. 可控表达:对于需要研究野生型和突变型不同表达水平比例的,可以通过表达载体的用量来调控。
3. 难度较低:KO的效率比内源点突变高,技术难度中等。
4. 降低多位点突变成本:研究多个突变位点的,通过先KO再过表达不同突变转录本,可以降低成本。
缺点
1. 周期较长:需要进行两步基因编辑,时间成本较高。
2. 非生理表达水平:突变基因的表达水平与自然生理条件有差异,可能影响结果判读。
3. 非编码区不适用:对于研究启动子、内含子等非编码区的点突变,该方法具有局限性。
应用案例
Chen等人对494例来自中国不同地区的肝细胞癌患者肿瘤组织进行了高深度的全基因组测序(平均120x),深入分析了编码区和非编码区的驱动基因、突变印记、拷贝数变异、聚集式变异事件、染色体外环状DNA以及突变演进规律等特征。此外,还选取了3个新鉴定的潜在驱动事件进行详细功能验证。其中,FGA基因的原位点突变实验失败,作者通过调整方案,先构建了FGA基因敲除的HepG2细胞,再利用慢病毒包装和感染,表达不同点突变的转录本,从而进行功能研究[2]。
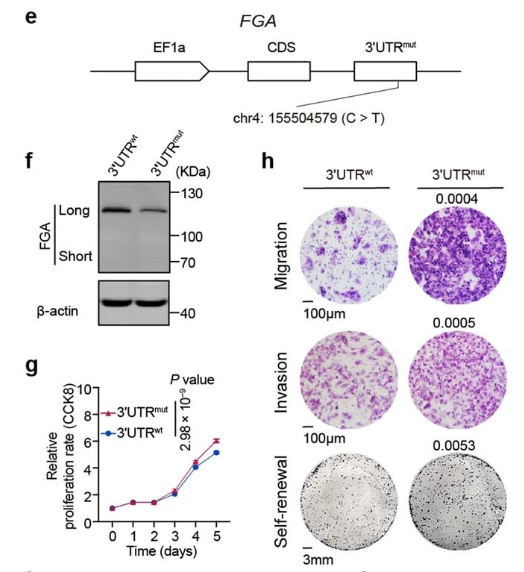
图2.FGA基因3UTR野生型和突变型的表达水平和基因型
高阶篇:内源基因定点突变
方法描述
使用CRISPR/Cas9等基因编辑技术,将gRNA、Cas9蛋白以及携带点突变和同源序列的Donor一起导入细胞内,通过同源重组的修复方式引入特定位点突变,但不改变基因的其他部分。这种方式最接近生理状态,是疾病模型构建的最佳选择。
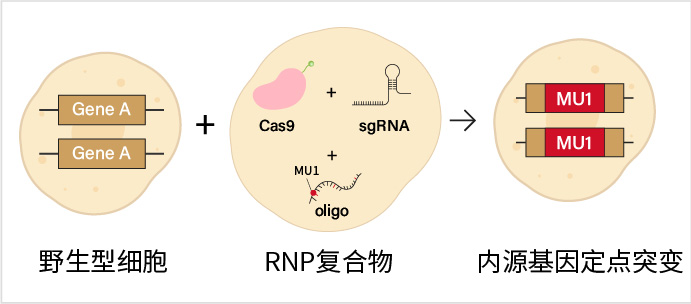
内源基因定点突变示意图
优点
1. 生理相关性高:突变基因在其自然表达背景下工作,更接近生理条件,更适合用于病理机制研究。
2. 单一步骤操作:只需进行一次基因编辑,一步到位。
3. 安全性高:一般采用RNP的方法,脱靶风险小,也没有外源基因随机整合的问题,结果可信度高。
4. 非编码区适用:适用于对于研究启动子、内含子等非编码区的点突变。
缺点
1. 技术难度较高:同源同组的修复效率比较低,需要高效的gRNA和Cas9蛋白,构建过程需要筛选大量的单克隆,经验要求高。
2. 多位点突变成本高:当需要研究多个突变位点,如果同时对多个距离较远的位点进行突变,或者分别突变多个不同位点,则需要进行多次点突变基因编辑实验,因而该方法成本高。
应用案例
甲状腺癌是常见的内分泌恶性肿瘤,PTC是最常见类型,其常见驱动基因改变包括BRAF突变、RAS突变、RET/PTC重排和TERT基因启动子突变。BRAF/RAS突变和TERT启动子突变共存与PTC的不良临床结局相关,但RET/PTC重排在PTC中的临床行为和致癌性质存在争议。Zhang等人通过CRISPR/Cas9技术将含有TERT C228T突变的TPC-1细胞修复为野生型,发现TERT基因表达显著下调,且RET/PTC抑制剂对修复后的野生型TPC-1没有影响,证明RET/PTC作用的TERT启动子突变依赖性。[3]。
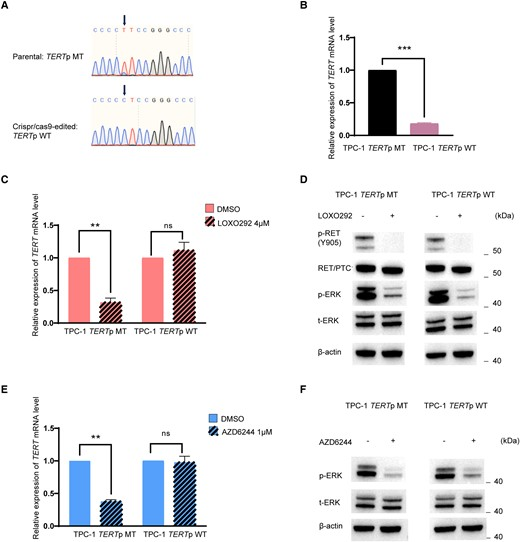
图3.RET/PTC调控具有TERT启动子突变依赖性
综上,内源基因的定点突变是点突变研究的首选方法。然而,如果考虑到成本限制或直接进行多点突变的难度较大,可以选择替代方案:KO+过表达突变转录本,但是需要注意避免gRNA回切问题。在项目早期阶段,如果想要快速筛选多个突变位点,初步了解点突变功能表型,可以在野生型细胞中瞬时过表达这些突变基因,以观察其初步效果。










