源井KO细胞助力揭示PCSK9蛋白互作及对脂质代谢的调控


源井KO细胞助力揭示PCSK9蛋白互作及对脂质代谢的调控

背景
PCSK9(前蛋白转化酶枯草溶菌素/胰蛋白酶类型9)是一种与家族性高胆固醇血症相关的蛋白,其C末端的M2重复序列对其细胞外功能至关重要,可能通过与未知的“蛋白X”相互作用。最近的研究显示,M2重复序列能够与MHC-I类蛋白(如HLA-C)中的R-x-E基序结合,导致其溶酶体降解,暗示PCSK9在免疫系统中可能有新的作用。此外,HFE在脂质代谢中的作用机制尚不清楚,HLA-C被认为可能参与PCSK9对LDLR的降解。
摘要
近日,Nabil G Seidah课题组在Cells期刊上发表了题为“Insights into PCSK9-LDLR Regulation and Trafficking via the Differential Functions of MHC-I Proteins HFE and HLA-C”的原创性研究论文。该研究比较了MHC-I样蛋白对PCSK9细胞外功能的影响,结果表明,HFE是PCSK9的新靶标,能够抑制其对LDLR的活性,而HLA-C则增强其功能。其中,使用了源井生物构建的HLA-C基因敲除HepG2细胞,研究了PCSK9与LDLR(低密度脂蛋白受体)的调控和运输机制,以及MHC-I蛋白HFE和HLA-C在其中的不同功能。
图文导读
该研究探讨了HFE、HLA-C和PCSK9之间的相互作用及其对LDLR功能的影响。作者通过在PCSK9基因敲除HepG2细胞和HLA-C基因敲除HepG2细胞(源井构建)中加入HFE、HLA-C及其伴侣β2M,发现HFE可以作为PCSK9在LDLR上的负调节因子,抑制其对LDLR的降解作用。同时,细胞外PCSK9增强了酸性区室中HFE和LDLR的降解。进一步实验表明,HFE与TfR1的解离可能增加细胞表面HFE的可用性,从而更大程度地抑制PCSK9在LDLR上的功能。
研究还发现HLA-C显著增强了PCSK9的功能,证实了HLA-C是PCSK9诱导LDLR降解的关键因素。在CHO-K1细胞中,过表达HLA-C显著增强了外源性PCSK9对LDLR的降解。在HepG2 CRISPR HLA-C KO细胞中,HLA-C的缺失导致PCSK9对LDLR降解的影响减弱,而过表达HLA-C则恢复了PCSK9的功能。这些结果表明,HLA-C和HFE可能通过不同的机制调节PCSK9的功能,其中HFE主要通过抑制PCSK9在LDLR上的作用,而HLA-C则通过增强PCSK9的功能来促进LDLR的降解。
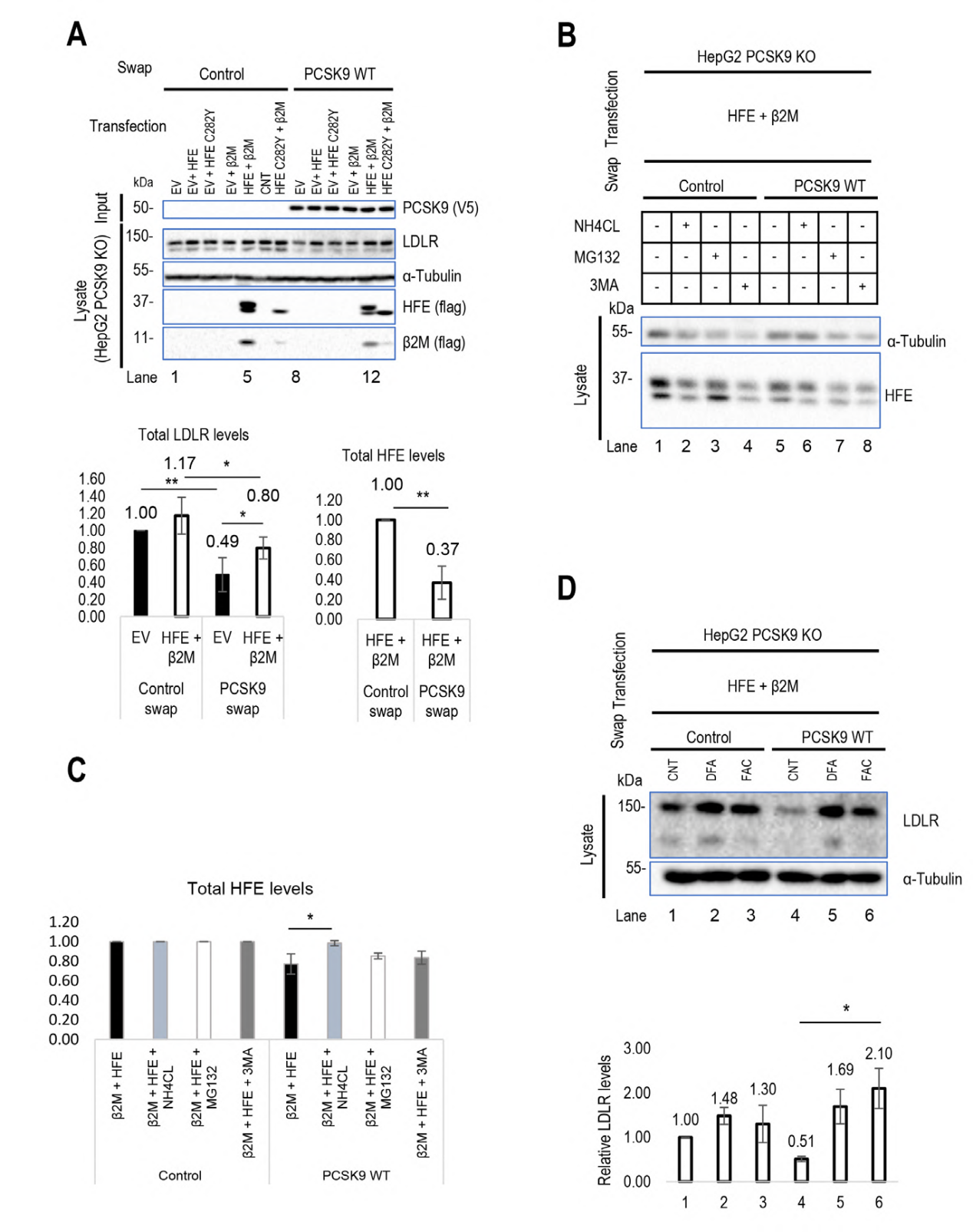
图 1 HLA-C和HFE对PCSK9的调控作用
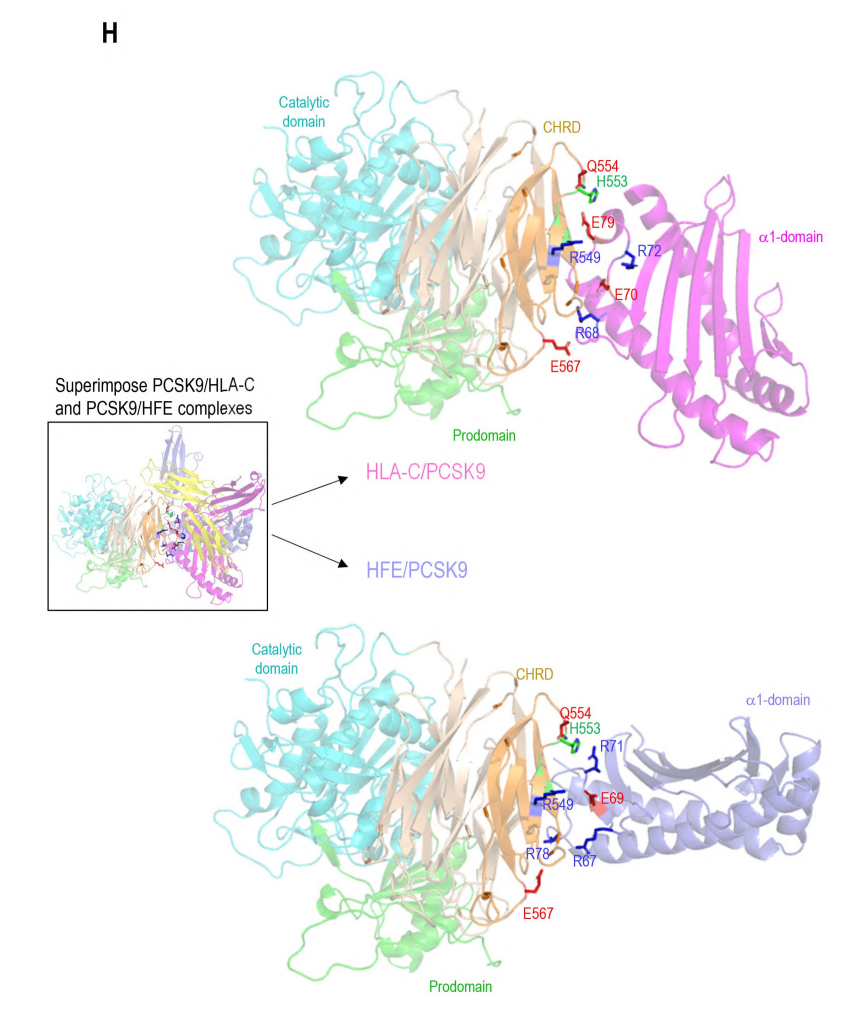
作者通过3D建模揭示了HLA-C和PCSK9相互作用的重要性,并预测了它们在分子层面的结合位点。研究发现,HLA-C上的R68-G-E70基序与PCSK9的M2结构域相互作用,而HFE由于结构相似性,可能通过其R67-V-E69基序与PCSK9的M2结构域结合。通过使用GRAMM-X Web服务器建模,进一步验证了HFE与PCSK9的相互作用。实验中,通过突变或删除PCSK9和HFE的关键结合位点,证实了这些位点在HFE与PCSK9相互作用中的重要性。此外,研究还发现,尽管HFE和HLA-C与PCSK9的相同残基相互作用,但它们可能通过不同的运输途径与PCSK9相遇,从而影响PCSK9在LDLR上的活性。这些发现为理解HLA-C、HFE和PCSK9之间的相互作用及其在脂质代谢中的作用提供了新的视角。
为了探讨LDL受体、HLA-C和HFE的内化途径及其与PCSK9的相互作用,作者使用了敲低小窝蛋白1(siCav1)或网格蛋白重链(siCHC)的方法。结果表明,HLA-C的降解主要通过网格蛋白包被的囊泡进行,而HFE的内化则可能依赖于小窝蛋白和网格蛋白共同作用。实验还发现,HFE的存在似乎抑制了PCSK9对LDLR的功能,但进一步使用CircuLex人PCSK9功能测定试剂盒测试显示,无论HFE是否存在,PCSK9与LDLR的结合亲和力不变。这表明HFE并不与LDLR竞争PCSK9的结合,反而依赖于LDLR的存在来被PCSK9降解。此外,缺乏LDLR会抑制PCSK9对HFE的功能,而HLA-C的降解则不依赖于LDLR。研究还发现,LDLR的胞质尾部对于PCSK9增强LDLR降解并非必需,而HLA-C在PCSK9-LDLR复合物分选到降解区室中起着关键作用。这些发现有助于深入理解LDLR及相关蛋白在脂质代谢中的调控机制。
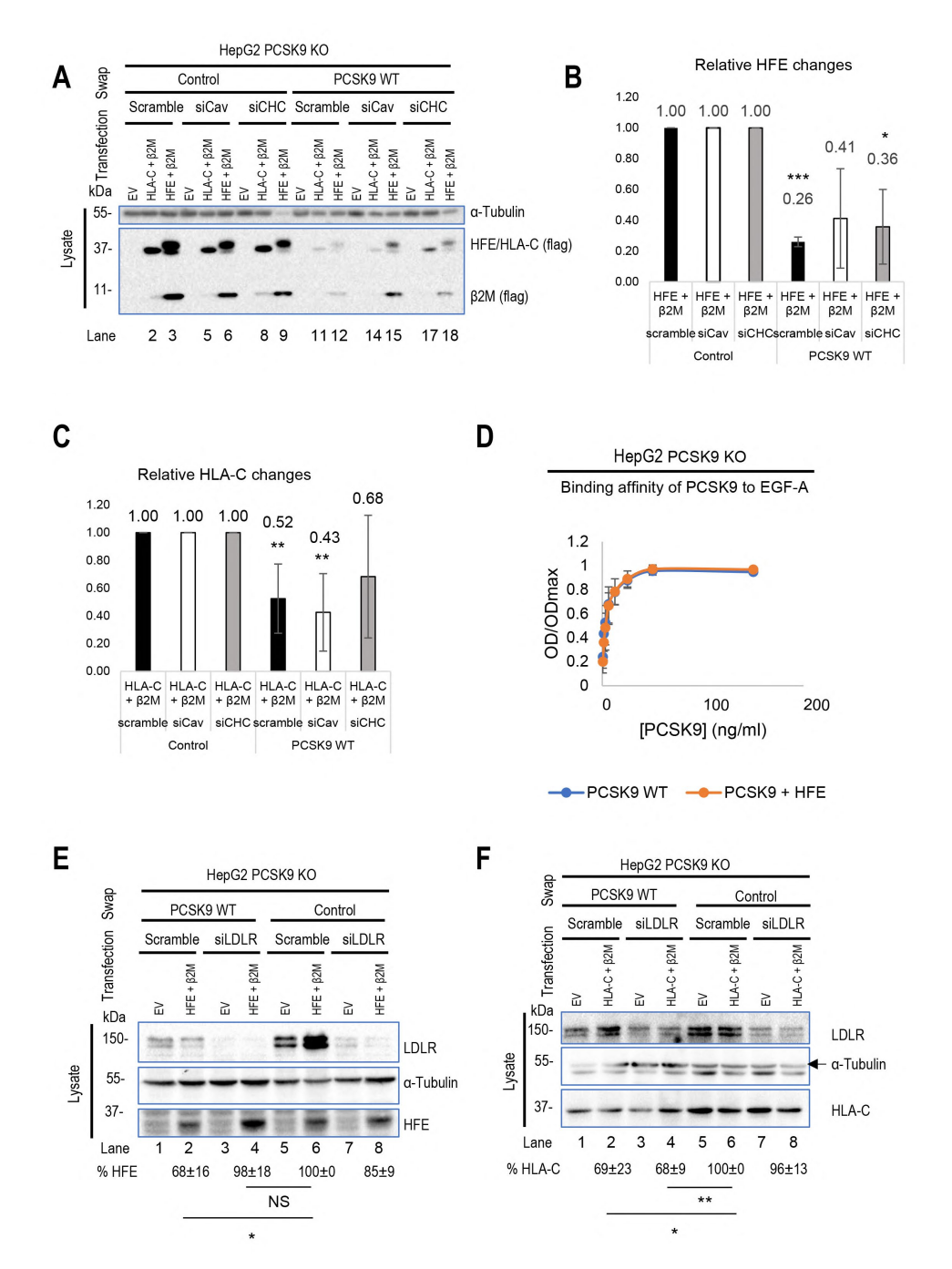
图3 HLA-C与HFE的运输区别
作者还通过3D建模技术深入分析了PCSK9与HLA-C和HFE的相互作用。研究结果表明,HLA-C和HFE都通过其α1链与PCSK9的CHRD区域的特定残基E567和E549结合。尽管两者与PCSK9的结合方式相似,但α1链的取向存在细微差异。同时,PCSK9的N端肽与HLA-C的α1链具有最佳相互作用,这一点通过Alphafold预测和建模得到了证实。PCSK9的非结构化N末端残基与HLA-C的肽结合口袋的相互作用显示出高置信度,且这种结合可能受到PCSK9 N端肽结构的影响。最后,作者还构建了完整的PCSK9/HLA-C α1链/β2-微球蛋白三元模型,支持PCSK9/HLA-C通过CHRD和N端肽进行相互作用的观点。这种相互作用涉及到HLA-C的α1链上的R68和E70残基,以及CHRD的M2模块上的E567和E549残基。此外,研究还评估了HLA-C抗原口袋与其他MHC-I分子的相似性,发现HLA-C抗原口袋中带正电荷的残基普遍存在,这可能支持酸性肽的结合。
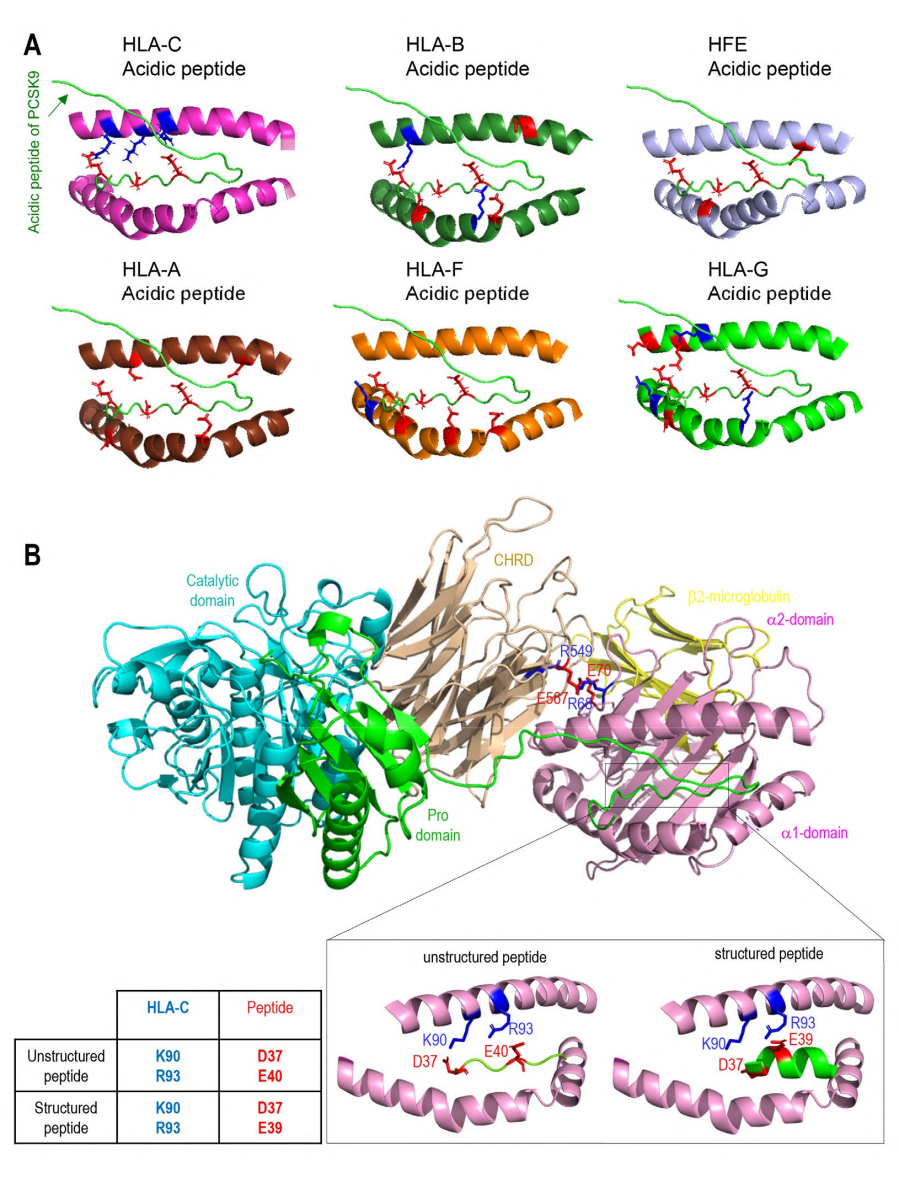
图 4 PCSK9 N 末端与 HLA 成员之间的相互作用建模
结论
本研究聚焦于PCSK9与LDLR溶酶体降解过程中的相互作用,强调了PCSK9的M2结构域和HLA-C分子在这一机制中的重要作用,同时揭示了HFE与HLA-C在调节PCSK9功能时呈现相反的效应,且两者在与PCSK9相互作用时采取了不同的内吞途径。这些关键发现不仅丰富了人们对蛋白质相互作用在细胞运输过程中作用的理解,也为未来的研究提供了新的方向和视角。
参考文献
Nabil G. Seidah, et al. “Insights into PCSK9-LDLR Regulation and Trafficking via the Differential Functions of MHC-I Proteins HFE and HLA-C” Cells 5.1 (2024): 13(10): 857










