一文了解卵巢癌研究常用细胞模型!


一文了解卵巢癌研究常用细胞模型!
卵巢癌是全球范围内女性生殖系统中致死率最高的恶性肿瘤之一,其复杂的生物学特性使得研究难度较大。为了深入理解卵巢癌的发病机制、药物作用及抗药性,研究人员常使用各种体外培养的卵巢癌细胞系。这些细胞系为研究提供了可靠的实验基础,本文将介绍几种常见的卵巢癌细胞系,并列举它们在基因编辑领域中的应用案例。
货号:YC-D019
来源:人卵巢腺癌细胞
特点:该细胞系对激素敏感,表达雄激素受体、雌激素受体和孕激素受体,并对阿霉素(多柔比星)、美法仑和顺铂耐药,是研究卵巢癌耐药性的合适模型系统,有助于评估激素治疗。此外,还具有较强的致瘤性,在体内实验中能够形成肿瘤,常用于卵巢癌的体内外研究,比如研究肿瘤的生长、转移以及免疫逃逸等机制。
应用案例:
为了阐明DCAF13在卵巢癌中的作用,Tang等人通过DCAF13基因敲除OVCAR-3细胞,发现细胞增殖能力显著持续下降,细胞周期被阻滞在G1期,DNA损伤机制激活,迁移能力显著被抑制。将敲除DCAF13的细胞移植到裸鼠体内后,肿瘤大小和重量低于野生型,肿瘤组织中细胞周期、增殖和凋亡相关指标均发生变化,表明体内肿瘤增殖受到抑制。这些结果综合表明DCAF13对OVCAR-3细胞的增殖、周期、迁移以及体内肿瘤生长都有重要影响,为研究卵巢癌的发病机制和治疗靶点提供了重要依据[1]。
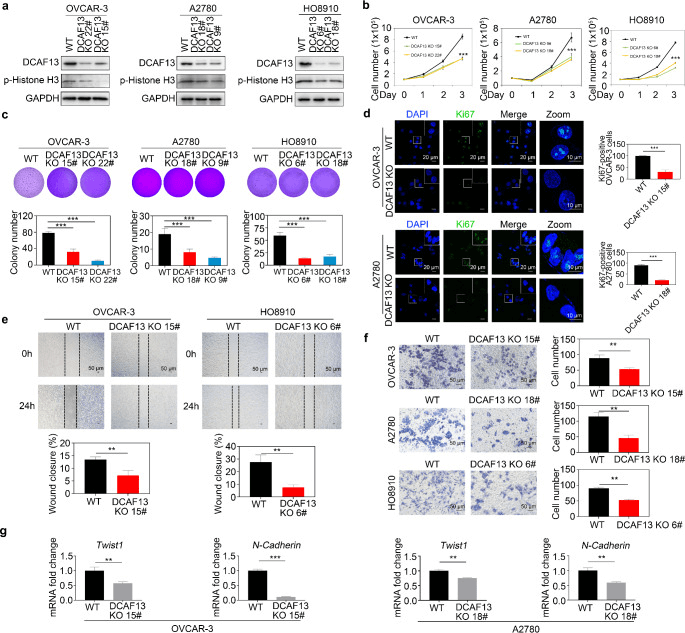
图1 DCAF13 缺失抑制卵巢癌细胞增殖、克隆形成和转移能力。
货号:YC-C157
来源:人卵巢浆液性囊腺癌组织
特点:该细胞系在体外培养中具有相对较高的增殖能力和侵袭性,对肿瘤坏死因子和多种细胞毒性药物(包括白喉毒素、顺铂和阿霉素)具有耐受性。常用于卵巢癌的基础研究,比如研究癌细胞的增殖机制、侵袭转移机制以及药物敏感性等。
应用案例:
Li等人以SK-OV-3细胞为模型,通过全基因组CRISPR/Cas9敲除筛选,发现PCMT1是卵巢癌转移和失巢凋亡抵抗的关键驱动因素。通过构建PCMT1基因敲除SK-OV-3细胞系后,验证了其对细胞增殖、迁移、黏附、侵袭等生物学行为的影响及促凋亡作用,且体内实验中敲除细胞肿瘤形成、腹水及转移能力减弱,将体内外研究关联,有力地证明了PCMT1在卵巢癌发生发展和转移中的重要性[2]。
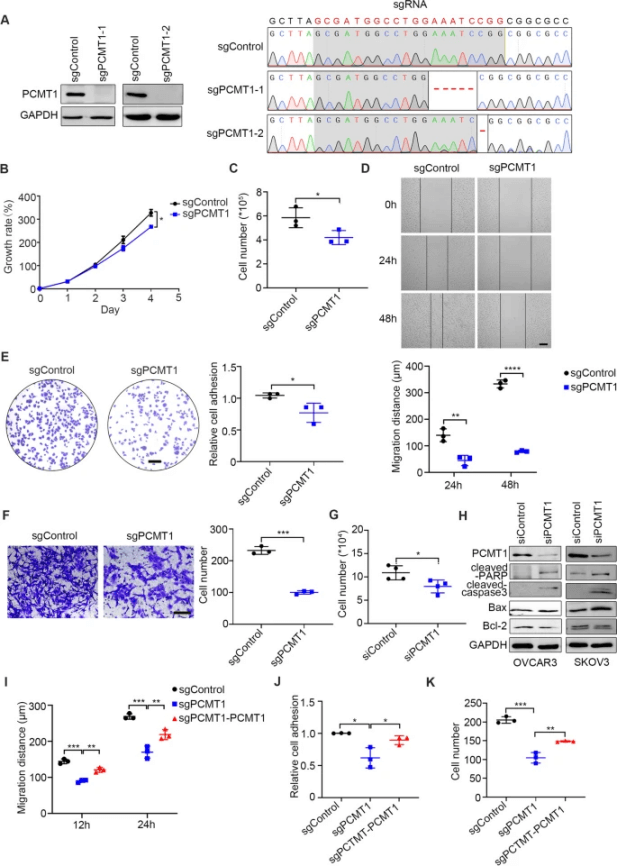
图2 PCMT1 在体外增强了细胞迁移、粘附和球状体形成
货号:YC-C031
来源:人卵巢乳头状囊腺癌组织
特点:Caov-3细胞基因组显示p53基因的无义突变和多个拷贝的卵巢癌基因PIK3CA,该细胞系对长春碱、顺铂和阿霉素敏感。常用于研究卵巢癌的发病机制、基因表达以及细胞信号通路等方面。
应用案例:
睾丸特异性含溴结构域蛋白(BRDT)在人类癌症中异位激活和表达,为了研究BRDT在卵巢癌细胞中的作用,Chen等人构建了BRDT基因敲除Caov-3细胞,发现BRDT基因敲除抑制了卵巢癌细胞的生长、活力、增殖和迁移,并诱导了显著的细胞凋亡激活。相反,通过外源过表达BRDT增强了Caov-3细胞的增殖和迁移。这证明了BRDT过表达会促进卵巢癌细胞进展,提出靶向BRDT可能是治疗卵巢癌的一种新策略[3]。
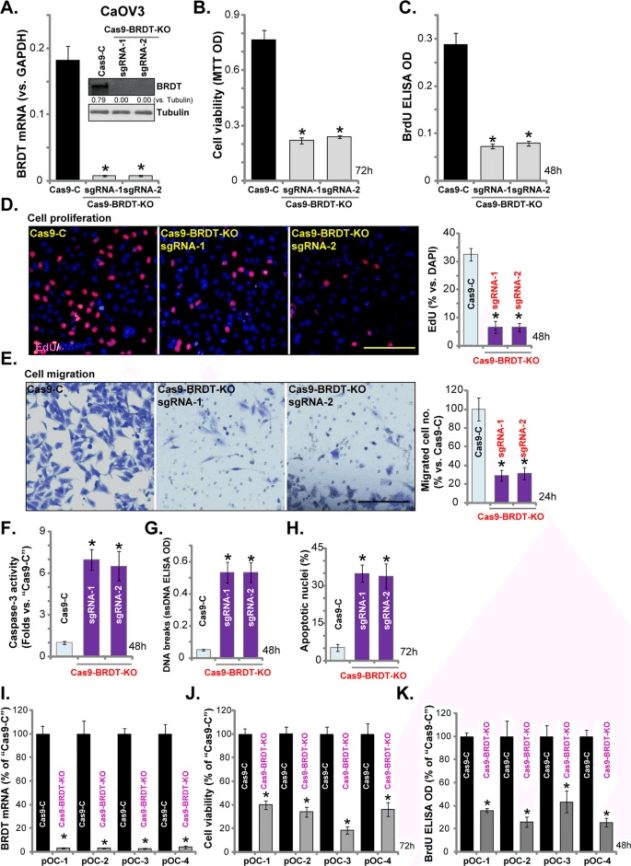
图3 BRDT基因敲除有效抑制卵巢癌细胞进展
货号:YC-C051
来源:人卵巢颗粒细胞瘤组织
特点:该细胞系生长缓慢,具有类固醇激素合成的能力,能表达功能性的促卵泡激素受体。常被用于研究卵巢颗粒细胞瘤的发病机制、激素调节机制以及新型治疗方法的探索。同时,它还可用于研究卵巢癌的分子机制,如激素受体表达、信号传导途径等。
应用实例:
为了阐明岩藻糖基转移酶8(FUT8)在女性生育能力中调节促卵泡激素受体(FSHR)功能的重要性,Wang等人在KGN细胞系基础上建立了FUT8-knockdown(KGN-KD)和FUT8-restored(KGN-KD-Re)细胞,通过检测核心岩藻糖基化水平、FUT8酶活性、FUT8mRNA表达、细胞增殖以及FSHR表达和相关信号通路等指标,发现FUT8对核心岩藻糖基化、细胞增殖以及通过FSHR调节的信号通路有重要作用[4]。
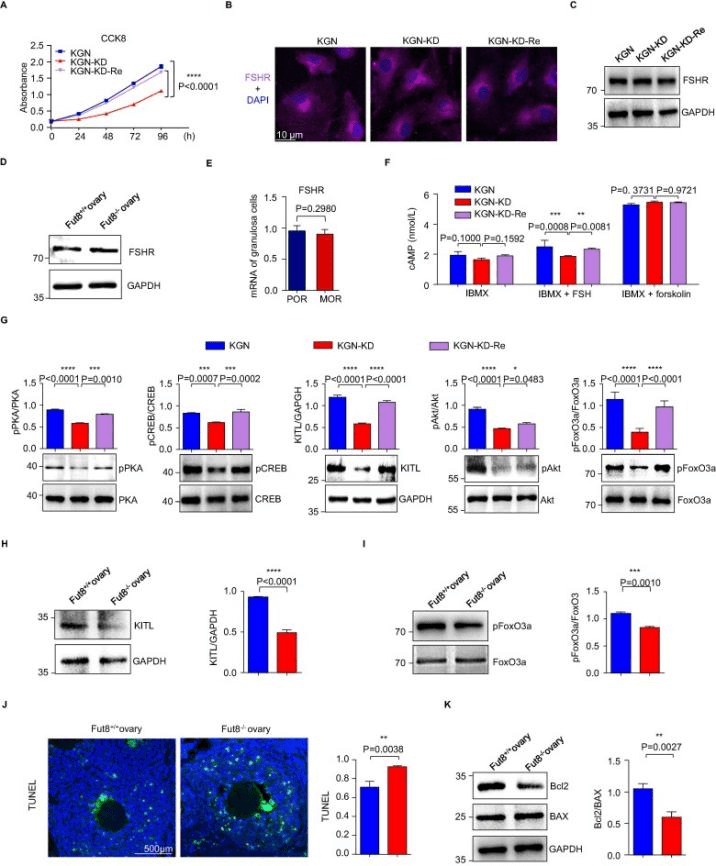
图4 FUT8 敲低减弱 FSH/FSHR 信号通路
这些卵巢癌细胞系各具特色,在卵巢癌的研究中发挥着重要作用,而基因编辑技术的应用更是加速了卵巢癌研究的进展。此外,有些研究还会采用多种卵巢癌细胞系进行交叉验证,以增强研究结果的可靠性。大家可以根据实际的研究目标和实验条件,选择最合适的细胞系开展研究。
参考文献:
[1]Tang, Ze-Yi et al. “DCAF13 promotes ovarian cancer progression by activating FRAS1-mediated FAK signaling pathway.” Cellular and molecular life sciences : CMLS vol. 81,1 421. 5 Oct. 2024, doi:10.1007/s00018-024-05446-2
[2]Zhang, Jingjing et al. “Genome-wide CRISPR/Cas9 library screen identifies PCMT1 as a critical driver of ovarian cancer metastasis.” Journal of experimental & clinical cancer research : CR vol. 41,1 24. 15 Jan. 2022, doi:10.1186/s13046-022-02242-3
[3]Chen, Ling, et al. "BRDT promotes ovarian cancer cell growth." Cell Death & Disease 11.11 (2020): 1021.
[4]Wang, Tiantong et al. “Core fucosylation regulates the ovarian response via FSH receptor during follicular development.” Journal of advanced research, S2090-1232(24)00038-9. 26 Jan. 2024, doi:10.1016/j.jare.2024.01.025










