KO细胞多基因型是怎么回事?


KO细胞多基因型是怎么回事?

很多老师在构建基因敲除(KO)细胞时,基因型鉴定环节可能会遇到一种情况:单克隆靶标位置的测序峰图是套峰,甚至出现不止2个峰型?这是怎么回事呢,这个克隆还能继续用吗?小源今天就来跟大家唠一唠KO细胞多基因型这件事。
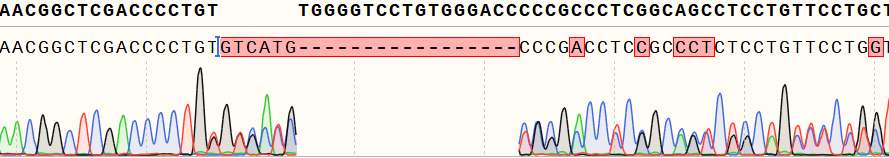
图1 单克隆基因型鉴定,出现套峰
Q1:为什么编辑后会产生不同的基因型?
我们先回顾一下CRISPR Cas9技术的工作原理:CRISPR-Cas9系统通过sgRNA引导Cas9酶到基因组中的特定位置,产生双链断裂(DSB)。由于细胞无法在DNA被切断的情况下存活很长时间,所以一旦DNA断裂,修复断裂的步骤很快就开始了。非同源末端连接(NHEJ)是大多数真核生物修复DSB的主要细胞修复途径[1]。NHEJ修复的过程中容易出错,可能会随机插入或者缺失一些碱基(indels)。如产生非3倍数长度的indels,会引起基因翻译时的移码突变,破坏蛋白功能,从而实现基因敲除。
NHEJ的修复既然是随机的,那么每个等位基因修复后的情况就可能不同。在基因编辑的实际操作中,sgRNA与Cas9酶结合并作用于基因组的过程并非完全一致,存在一定的随机性,可能导致同一等位基因的DNA断裂位置和修复结果存在差异[2]。同时,细胞内的其他分子和环境因素也可能干扰修复过程,进一步增加了基因型多样性的可能性。
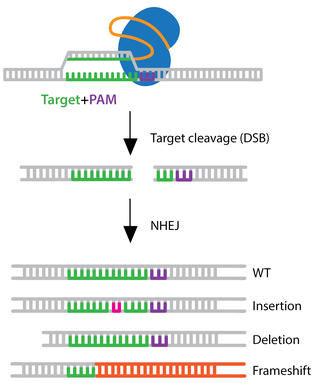
图2 CRISPR Cas9非同源末端连接(NHEJ)示意图[3]
Q2:为什么基因型还有超过2种的情况呢?
哺乳动物正常体细胞是二倍体,但是绝大部分实验用的细胞系是癌细胞,癌细胞在发展过程中可能经历复杂的基因组不稳定性和染色体异常(如染色体重排、复制、缺失或增加等),使其更能适应不同的环境条件,获得生长优势。这些异常导致了非二倍体状态,通常表现为倍体异常(aneuploidy)或多倍体。染色体的异常会导致一些基因的拷贝数发生变化,出现2种以上的等位基因数量。下图是Hela细胞某一种核型,不同编号的染色体数量差异很大,其中5号染色体竟达到8条之多[4]。
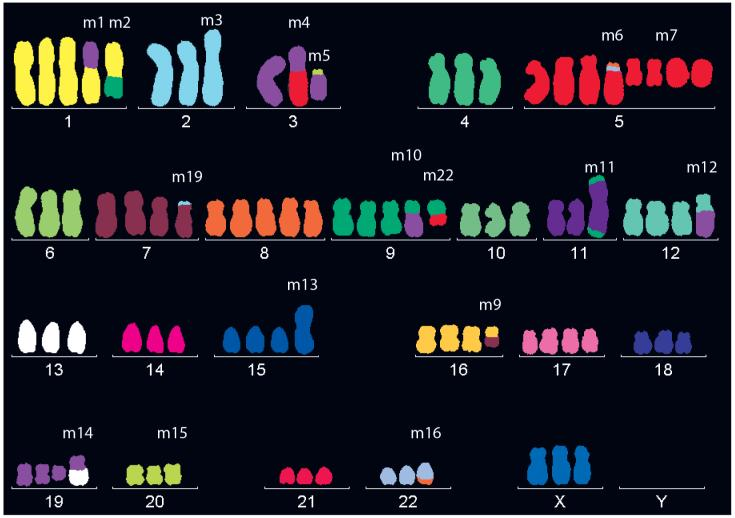
图3 HeLa细胞比正常的细胞有更多的染色体
基因编辑小tips:大家在实验开展前,可以了解一下目标基因在细胞中的拷贝数是多少,这有利于了解KO细胞基因型和获取纯合子的难度。推荐大家使用红棉网站上小工具:基因拷贝数评估系统(网址:https://www.rc-crispr.com/tools/gene_copy_number.html),该工具可以根据基因组测序结果与核型数据,计算出细胞系中不同基因的平均拷贝数。拷贝数越高,获得基因编辑纯合子难度越大,可用于项目综合难度评估。
图4 源井官网基因拷贝数评估工具
Q3:那如何将不同基因型进行区分呢?
小源给大家介绍三种常用方法:
1.Sanger测序+基因型分析工具
对靶标区域进行PCR扩增,将PCR产物进行Sanger测序。然后,可以使用红棉网站上另一个工具:基因型分析系统(https://www.rc-crispr.com/tools/gas.html)对测序结果进行分析。这种方法方便快捷,只需对PCR产物进行测序即可,在基因型分析工具的帮助下快速区分不同的基因型以及编辑效率,大幅度提高了鉴定效率和降低实验成本。
图5 源井官网基因型分析工具
案例分析:二倍体单克隆细胞的两种基因型(两个等位基因均被编辑,但缺失情况不一致)
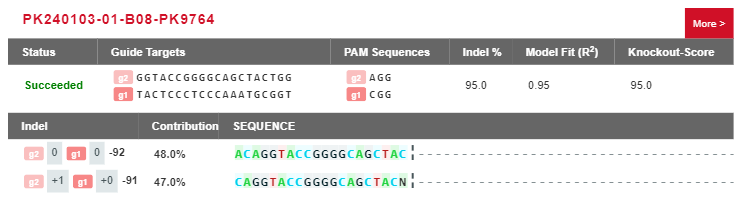
图6 源井基因型分析工具结果
2.TA克隆/Topo克隆+Sanger测序
对靶标区域进行PCR扩增,根据PCR产物的状态选择合适的克隆方法,PCR产物一般5'端没有磷酸化,可以直接进行Topo克隆或者加“A”尾后进行TA克隆[5]。克隆后,筛选克隆子并进行Sanger测序。该方法通过将PCR产物连接到克隆载体上以区分不同基因,但是还需要筛选克隆,步骤较为繁琐。
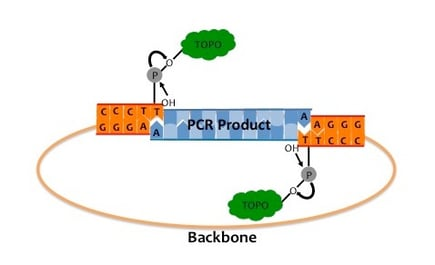
图7 Topo克隆示意图
分子生物学小知识:
TA克隆:利用某些DNA聚合酶(如Taq聚合酶)在PCR产物的PCR产物的3'末端非模板依赖性地添加腺嘌呤(A),这使得可以将该PCR产物可以与线性化载体的3'末端的胸腺嘧啶(T)通过互补配对进行连接[6]。
TOPO克隆:TOPO克隆是一种一步式技术,通过单一酶(拓扑异构酶I)的作用将DNA片段插入线性化载体。TOPO克隆适用于平末端或粘性末端的PCR产物,且无需添加额外的“A”尾。
3. NGS测序
NGS测序可以对靶序列中基因组编辑的定量评估,也可用于检查脱靶效应。首先对靶标区域进行PCR扩增,纯化回收PCR产物,建立NGS文库,上机测序[7]。该方法操作比较简单,可以将PCR产物交给测序公司进行后续步骤,但是成本较高。
![单克隆进行NGS测序[7] 单克隆进行NGS测序[7]](/uploads/allimg/240826/36-240R6143350117.png)
图8 单克隆进行NGS测序[7]
Q4:多基因型KO细胞能用吗?
基因敲除实验中细胞基因型鉴定结果主要有几类:
1)野生型(Wide Type,WT):靶基因的所有等位基因均未产生编辑,和野生型细胞系一致,此类细胞可作为实验阴性对照使用。
2)KO杂合子(Heterozygotne,HE):靶基因部分等位基因为WT,部分为KO移码基因型。此类细胞可以作为敲低细胞使用(类似RNAi的干扰效果),尤其是基因敲除纯合致死的情况下,如果杂合KO有表型,可以直接在文章中使用。
3)KO纯合子(Homozygote,HO):靶基因全部为KO移码基因型,且基因型完全一致,这种是最理想的基因型,无需多说!
4)复合杂合子(Compound Heterozygote):靶基因全部为KO移码基因型,但不同等位基因缺失的情况有所不同,比如一个等位基因缺1个bp,另外一个等位基因缺5个bp。这种情况因为每个等位基因都发生了移码突变,都达到了KO的效果,可以等同于第3种基因型,广义上也可以叫“ko纯合子”,属于可正常交付的KO克隆。
好啦,今天就到这里,大家看完后,是不是对KO细胞多基因型这一现象不再陌生啦?如果您有更多基因编辑细胞相关的疑问,可以联系我们小源哦,问的人多就马上安排!还有可能被我们选中送出精美周边哦!
参考资料:
[1]Chang, Howard H Y et al. “Non-homologous DNA end joining and alternative pathways to double-strand break repair.” Nature reviews. Molecular cell biology vol. 18,8 (2017): 495-506. doi:10.1038/nrm.2017.48
[2]https://blog.addgene.org/crispr-101-validating-your-genome-edit
[3]https://www.addgene.org/guides/crispr/#design-grna
[4]Smirnov, E et al. “NORs and their transcription competence during the cell cycle.” Folia biologica vol. 52,3 (2006): 59-70.










