
CRISPR文库干货
Expert Insights - CRISPR Library
CRISPR筛选发现小鼠肿瘤转移机制的关键靶点
一、背景
癌症转移是一个高度复杂的过程,涉及多基因协同调控,并伴随动态变化和显著的异质性。肿瘤转移不仅受癌细胞自身基因调控的影响,还受到体内复杂生理微环境的调节,这使得简单、稳定的体外培养体系难以真实模拟转移过程。传统的癌症靶点研究通常依赖于已有文献、蛋白功能或临床数据,对单个或少量候选基因进行功能验证。这种策略的优势在于可深入研究已知基因与疾病的关联及其机制,但其局限性也十分明显:研究低通量,需基于假设进行实验,难以发现未知通路或潜在靶点。近年来,CRISPR文库筛选技术作为一项高通量、系统性功能基因筛选手段,已逐渐应用于癌症靶向药物开发领域。相比传统方法,CRISPR 文库筛选具有以下优势:
-
- 高通量:一次可覆盖全基因组或大规模基因集合
-
- 高效率:通过表型直接筛选功能基因
-
- 低脱靶:精确编辑目标基因,减少非特异效应
CRISPR 文库筛选与传统研究思路结合,可在保持对已知靶点深入研究的同时,通过表型筛选发现新的关键基因,加速靶点发现和功能验证。在此背景下,张峰团队于 2015 年发表的《Genome-wide CRISPR Screen in a Mouse Model of Tumor Growth and Metastasis》首次在动物水平开展全基因组 CRISPR 筛选,用于发掘在真实体内微环境中调控肿瘤生长与转移的关键基因,为体内肿瘤转移机制研究提供了系统化的新策略。
二、CRISPR 文库揭示小鼠肿瘤转移核心基因
1. 工具细胞
使用来自小鼠的非小细胞肺癌细胞(KrasG12D-/+;p53 -/- ;Dicer1+/-,简称KPD细胞),首先用Cas9-GFP慢病毒转染KPD细胞,构建Cas9-GFP KPD稳定细胞系。
2. 文库设计
使用小鼠全基因组 sgRNA 文库(mGeCKOa),共计 67,405 个 sgRNA,覆盖 20,611 个蛋白编码基因及 1,175 个 pre-miRNA,同时设置 1,000 个非靶向 sgRNA 作为对照,为高通量筛选奠定基础。
3. 文库转染与阳性筛选
-
- 慢病毒感染:三次独立重复实验,每次覆盖度 >400×,平均 MOI = 0.4±0.02
-
- 阳性细胞获得:感染后使用 2 μg/mL 嘌呤霉素培养 7 天,选择阳性细胞
4. 体内筛选策略
将文库病毒感染后得到的细胞通过原位注射的方式注射进裸鼠的右侧腹部皮下,三次重复感染的文库细胞分别注射四只小鼠,其中一只用于早期原位肿瘤测序,另外三只用于晚期原位肿瘤和远端转移灶的测序,同时以未感染文库病毒的野生型细胞注射小鼠用于对照。
细胞注射6周后处死小鼠,检查小鼠的肿瘤形成和转移灶形成情况。
① 收集注射部位形成的原位肿瘤:用于分析原位肿瘤生长的必需基因;
② 收集不同器官内的远端转移灶:用于分析转移灶形成的必须基因。
5. 筛选逻辑
文章采用负向筛选结合正向筛选的思路,比较文库细胞、原位肿瘤、转移灶中sgRNA的覆盖情况:
① 分析原位肿瘤或转移灶中耗竭的sgRNA→对应的基因在原位肿瘤的发生发展和转移灶形成中是必需的;
② 分析原位肿瘤或转移灶中富集的sgRNA→对应的基因抑制原位肿瘤的发生发展和转移灶形成。
三、主要发现
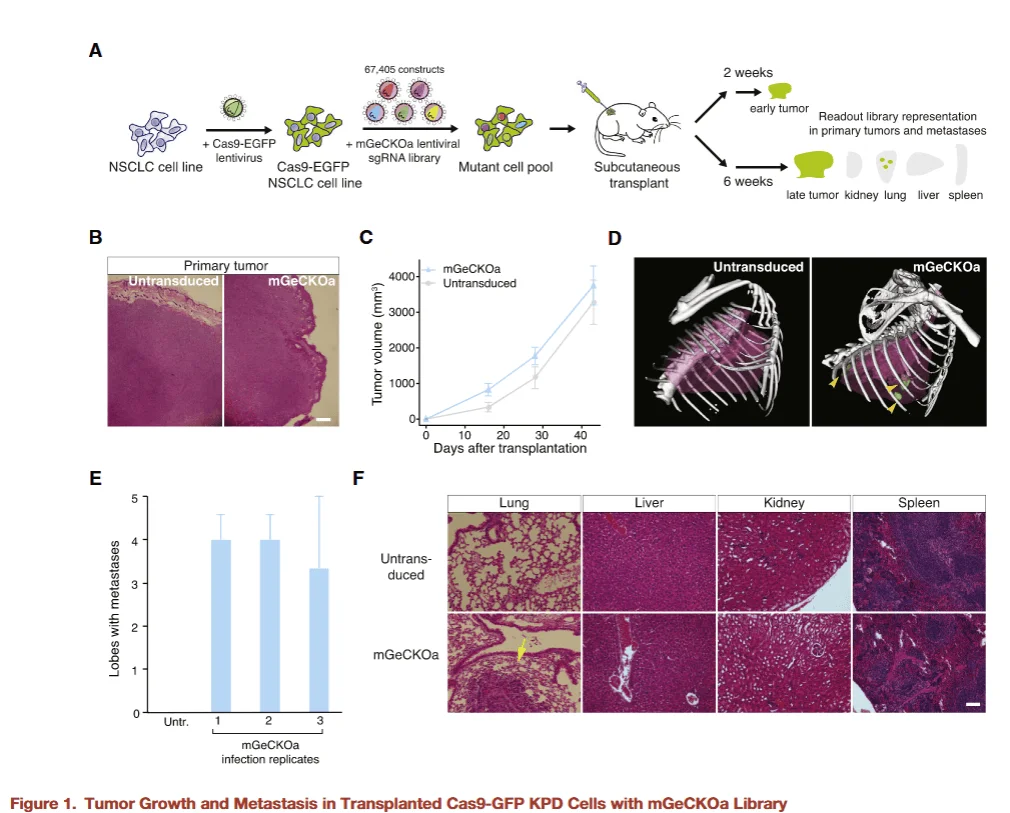
图1
研究者首先构建了小鼠全基因组 KO 文库细胞,并与野生型对照细胞分别注射到小鼠腹侧皮下,以评估基因缺失对原位肿瘤形成及转移能力的影响。实验结果显示:
-
- 原位肿瘤形成:文库细胞组和对照组细胞均能够在注射部位成功形成原位肿瘤,表明基因缺失并未影响肿瘤局部生长能力。
-
- 远端转移:仅在文库细胞注射组的小鼠肺部检测到转移灶,提示全基因组 KO 文库中存在促进肿瘤转移的关键基因。
这一发现首次在动物模型中证明,通过全基因组 CRISPR KO 文库可以系统性筛选出与肿瘤转移密切相关的潜在靶点,为进一步解析转移机制提供了基础。
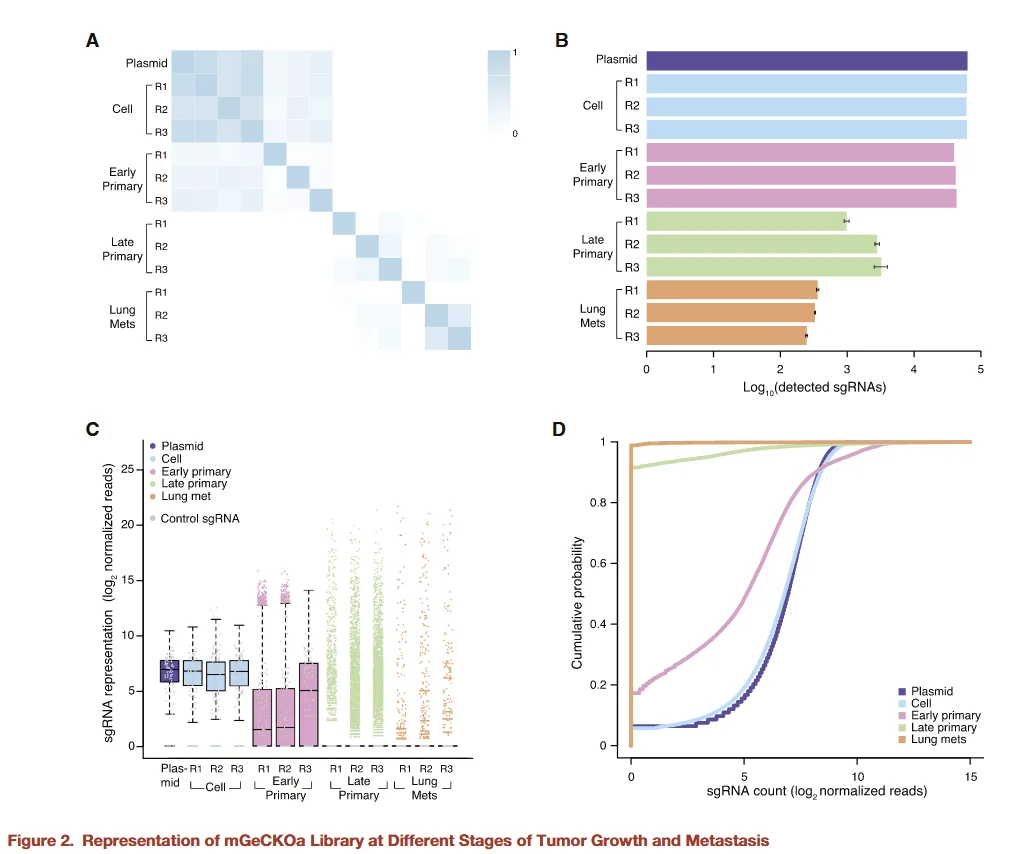
图2
为进一步验证肿瘤从发生到转移过程中 sgRNA 表达水平的动态变化,研究者对文库质粒、文库细胞、早期原位肿瘤、晚期原位肿瘤以及肺转移灶中的 sgRNA 进行了测序分析。结果显示:
-
- 文库质粒与文库细胞:sgRNA 丰度基本一致,说明病毒感染和细胞扩增过程中未出现显著偏倚。
-
- 肿瘤发生与转移过程中:随着肿瘤从早期原位发展到晚期原位再到肺转移灶,部分 sgRNA 的丰度逐渐下降(早期原位肿瘤 > 晚期原位肿瘤 > 肺转移灶),提示在肿瘤发生、发展及转移过程中,部分基因敲除细胞经历了 选择压力,导致对应 sgRNA 的富集或损耗。
这一动态变化为后续识别肿瘤生长与转移的必需基因提供了实验依据,并揭示了体内微环境对肿瘤细胞基因功能选择的重要作用。
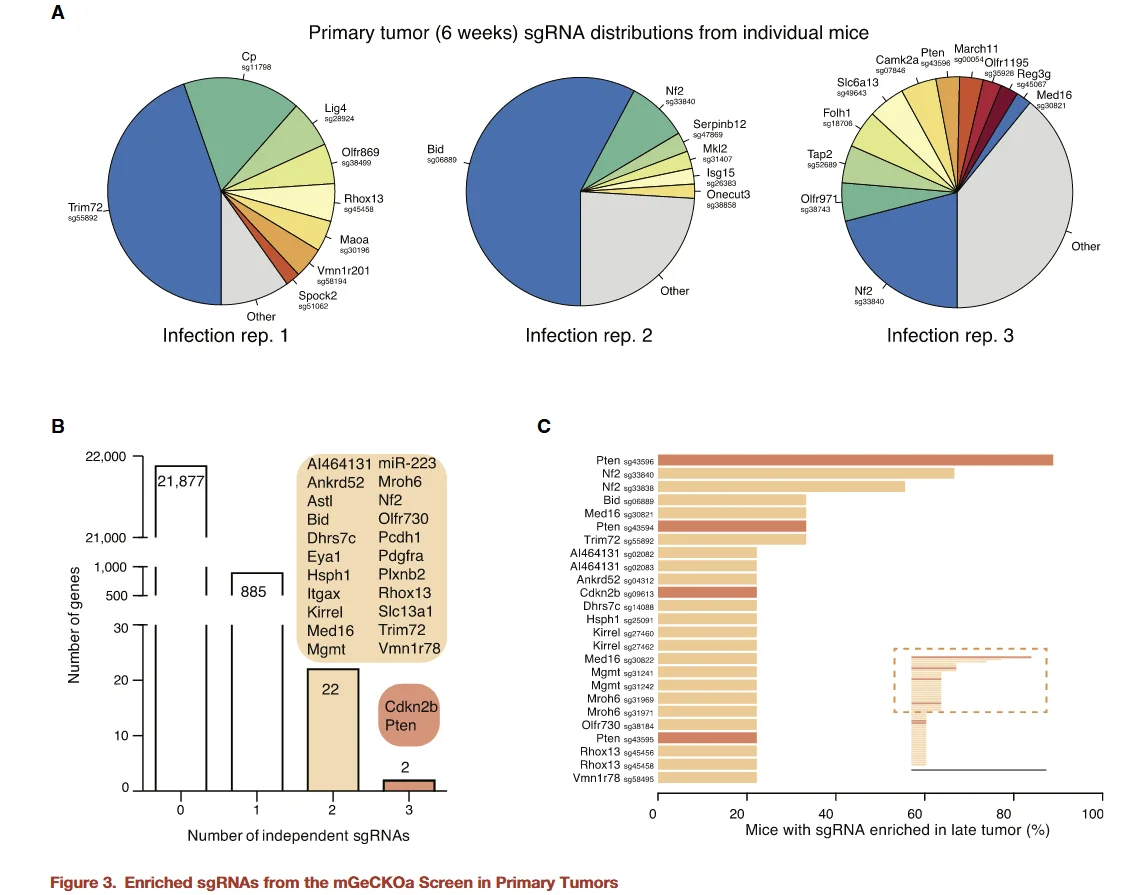
图3
在获得小鼠原位肿瘤的测序数据后,研究者首先对原位肿瘤中的 sgRNA 进行了分析。以非靶向 sgRNA 作为对照,并采用FDR < 0.2%作为筛选标准,对三只小鼠的原位转移瘤中的 sgRNA 进行统计。结果显示:
-
- 富集的sgRNA:共计 935 个 sgRNA 在至少一只小鼠中显著富集,靶向 909 个基因。
-
- 功能特征:这些基因中有许多与 细胞凋亡 相关,提示它们可能在肿瘤原位生长及转移过程中发挥关键作用。
-
- 高度一致的基因:其中 24 个基因的 sgRNA 在两只及以上的小鼠中同时富集,显示出较高的重复性和潜在的生物学重要性。
这一分析为后续进一步验证关键基因在肿瘤转移中的作用提供了依据,同时揭示了凋亡通路相关基因在肿瘤转移中的潜在核心功能。
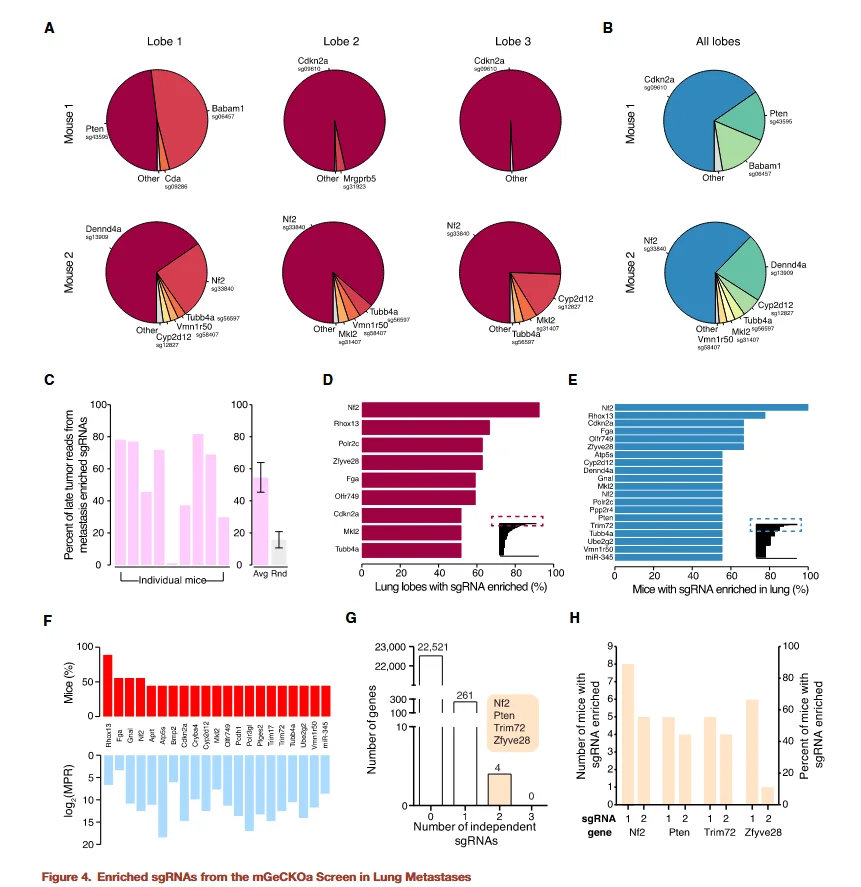
图4
研究者进一步分析了转移灶中的 sgRNA,同样以非靶向 sgRNA 作为对照,并采用FDR < 0.2%作为筛选标准。分析结果显示:
-
- 富集的 sgRNA 总数:共有 147 个 sgRNA 在至少一个肺叶中显著富集,其中 105 个 sgRNA 在至少一只小鼠的肺叶中被检测到。
-
- 关键基因:富集的 sgRNA 靶向基因包括 Nf2、Pten、Cdkn2a、Trim72、Fga、Zfyve28、Rhox13、Babam1、miR-345 和 miR-152 等。
-
- 特异性分析:部分基因的 sgRNA 在转移灶中的丰度高于原位肿瘤(MPR > 1),提示这些基因对 肿瘤转移过程 而非单纯细胞增殖具有特异性必需作用。
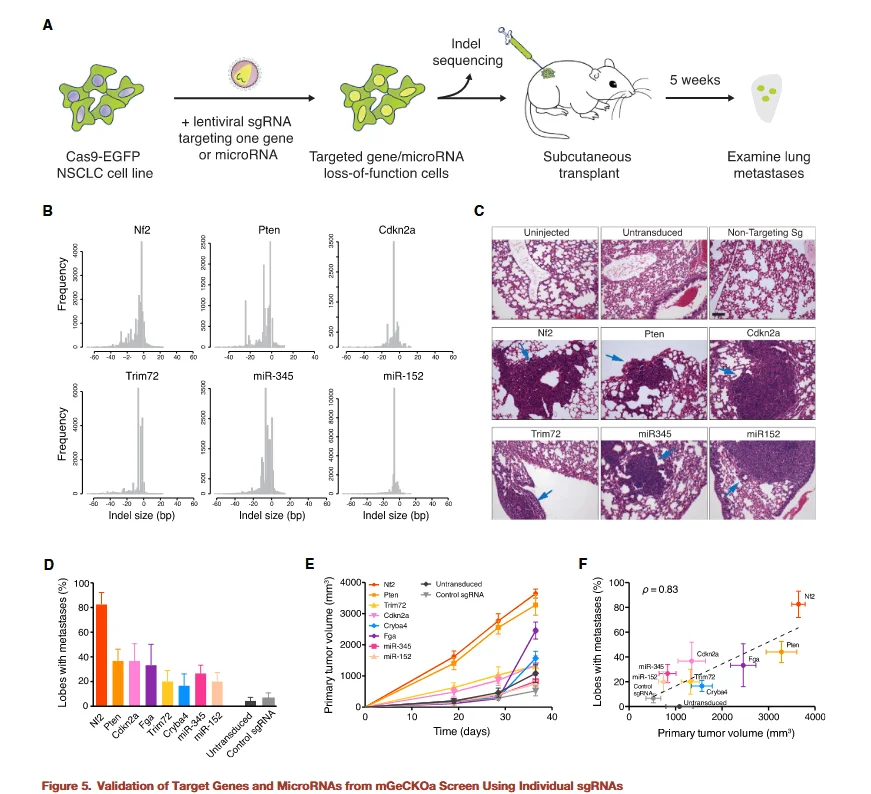
图5
为了验证筛选出的候选靶基因的功能,研究者分别构建了单基因 KO 细胞株,并将其注射入小鼠体内以评估肺部转移灶的形成情况。同时,野生型细胞株和非靶向 sgRNA KO 细胞株被用作对照。
实验结果显示:
-
- 所有候选基因的缺失均显著促进肿瘤细胞在肺部形成转移灶。
-
- 部分基因缺失不仅促进原位肿瘤增殖,同时也增强了转移灶的形成能力。
-
- 这些观察结果与全基因组 CRISPR 文库筛选结合生物信息学分析的预测高度一致。
这一验证充分证明了CRISPR 文库筛选结果的可靠性和可重复性,并进一步确认了候选基因在肿瘤转移过程中的关键作用。
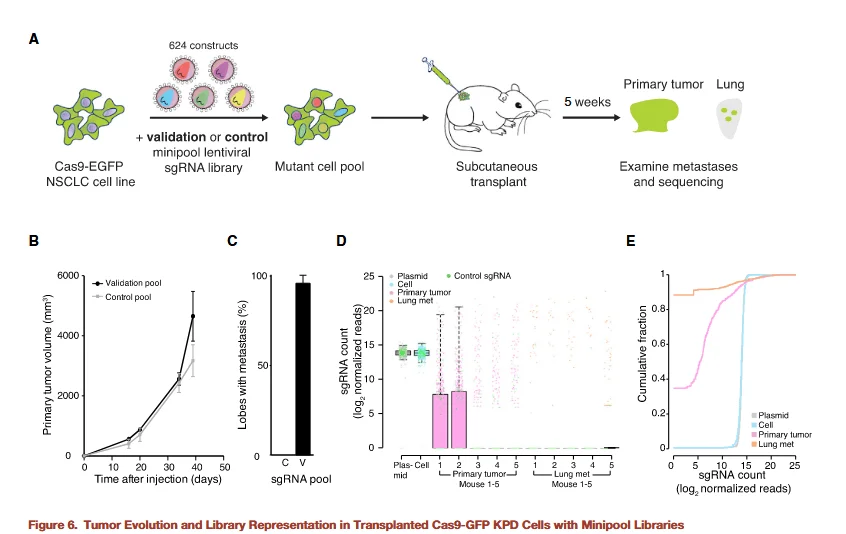
图6
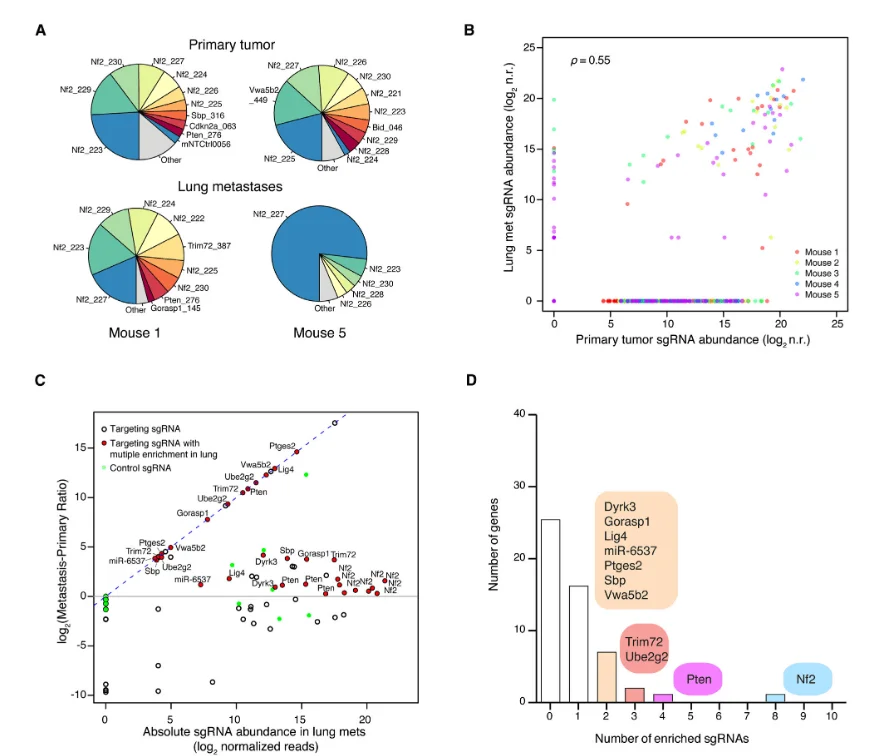
图7
图8
为进一步验证筛选出的候选基因,研究者构建了一个小规格文库,旨在提高筛选深度,同时降低脱靶率及全基因组文库过大可能引入的背景噪声。该小文库仅靶向 53 个候选基因,并为每个基因设计了更多的 sgRNA,以增强验证的可靠性。利用这一小文库的实验结果再次证明,促进原位肿瘤增殖的功能缺失细胞同样能够增强转移灶的形成能力,从而进一步验证了全基因组筛选结果的准确性。
为了评估这些发现的临床相关性,研究者将小鼠筛选得到的候选基因对应的人源同源基因在 TCGA数据库中进行了检索。结果显示,这些基因在非小细胞肺癌(NSCLC)患者的转移灶肿瘤中大多存在表达下调(61%–75%),提示小鼠模型中获得的筛选结果在临床上具有一定的参考价值,可为人类癌症转移机制研究和靶点开发提供借鉴。
四、临床意义
本研究从全基因组 CRISPR 文库出发,通过高通量筛选并对比原位肿瘤与转移灶中 sgRNA 的富集情况,筛选出多个候选基因并进行了单基因功能验证。随后,研究者构建小规格文库对候选基因进一步验证,最终将实验结果与已有数据库中的人源基因表达情况进行比对,形成了一套完整的思路闭环。
这一研究思路不仅为后续基因功能研究或靶向药物开发提供了直接参考,也可作为范本应用于其他疾病或生理过程的系统性功能基因筛选。
五、主要亮点
-
- 创新方法:首次证明了在体内开展全基因组 CRISPR 筛选的可行性,为肿瘤研究提供了全新的技术路线。
-
- 潜在癌症转移靶点:识别出 Nf2、Pten、Cdkn2a、Trim72、Fga、miR-345、miR-152 等基因,其功能缺失可加速肿瘤转移灶形成。
-
- 临床转化价值:这些基因不仅有望作为癌症患者的 预后监测标志物,也可能成为 抗肿瘤转移的治疗靶点。
六、核心思路总结
利用 CRISPR-Cas9 技术在全基因组范围内设计功能缺失筛选,在体内环境下高通量地识别在肿瘤发生、发展和转移中发挥关键作用的基因。CRISPR 文库筛选具有高通量、低脱靶、无偏倚等优势,使得研究者能够系统性发现所有潜在功能基因。通过将 CRISPR 文库筛选与体内实验相结合,本研究精确找到了在真实生理环境下与肿瘤发生、发展和转移相关的基因,不仅提供了新的肿瘤相关靶点,也为后续相关研究提供了可借鉴的技术路线和研究范本,为癌症机制研究和药物开发提供了强有力的支持。
源井生物CRISPR文库筛选服务
为助力科研人员在肿瘤及免疫等领域高效发现功能基因,源井生物提供全套 CRISPR 文库筛选服务,涵盖 体外筛选、体内筛选 及 数据分析 全流程。依托 iScreenAnlys™ 文库分析平台,科研人员可实现高通量、低脱靶、可视化的数据处理和靶点分析。从实验设计到结果分析,源井生物为高校、研究所及医药研发机构提供全方位支持,让 CRISPR 文库筛选变得高效、可控且可重复,加速科研突破与靶点发现。
参考文献
[Chen S, Sanjana NE, Zheng K, et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 2015;160(6):1246-1260. doi:10.1016/j.cell.2015.02.038]
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划































 联系电话
联系电话
 投诉电话
投诉电话
