一文了解荧光素酶(Luciferase)报告基因实验


一文了解荧光素酶(Luciferase)报告基因实验

一、 实验原理
荧光素酶(Luciferase)是一类能够通过氧化荧光素底物而产生生物发光信号的酶,如萤火虫荧光素酶(Firefly luciferase,FLuc)、海肾荧光素酶(Renilla luciferase,RLuc)、高斯荧光素酶(Gaussia luciferase,GLuc)等。荧光素酶报告实验广泛运用在各个生物学研究领域,如基因表达与调控的研究、肿瘤细胞示踪等。FLuc需利用ATP和Mg2+来催化底物荧光素发生反应,产生黄绿光,波长在550-570nm;而RLuc仅需氧气便可催化底物腔肠素,产生蓝色光,波长在480nm左右;Gluc的底物也是腔肠素,且Gluc为分泌性蛋白,收集细胞上清即可用于后续发光检测。
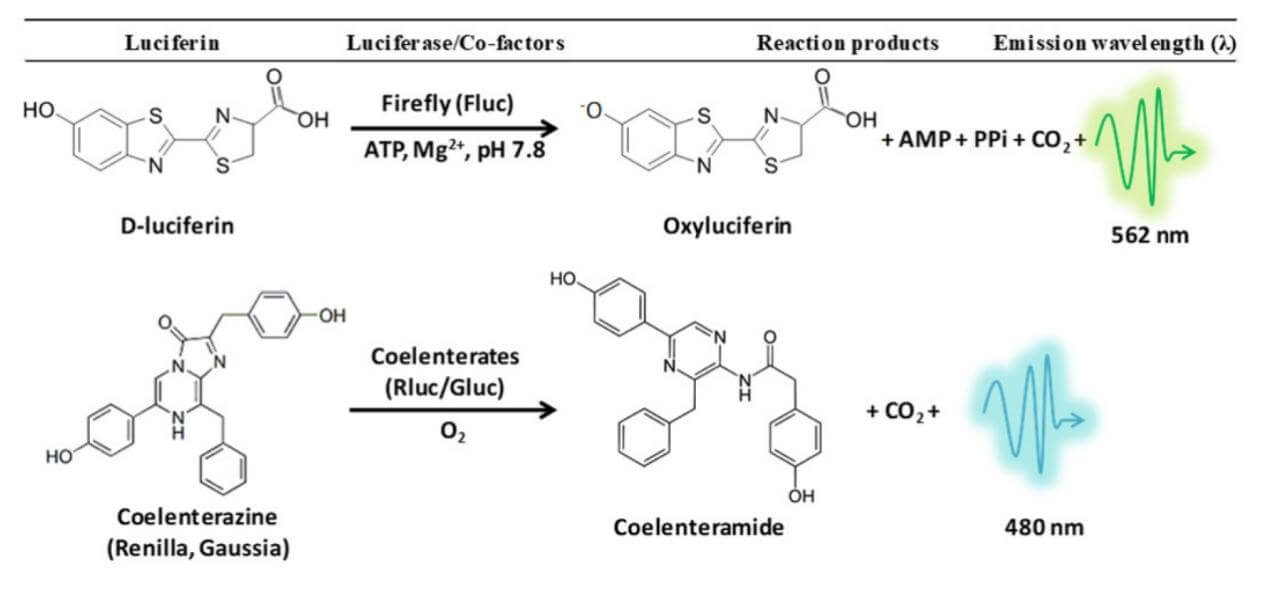
图 1 荧光素酶报告基因实验原理
荧光素酶报告基因实验,通常是指以荧光素酶活性检测基因调控元件调控能力的系统,包括单荧光素酶报告基因检测系统和双荧光素酶报告基因检测系统。单荧光报告系统操作简便,常用于研究稳定转染细胞中基因调控元件的功能。但单荧光报告系统无法区分不同实验组之间结果差异是来自报告基因的特异调控,还是细胞整体事件导致(如增殖、凋亡、坏死等)。在分析实验结果之前,需对数据进行归一化处理。对于瞬时转染实验,转染效率可能引入的显著变异,无法通过细胞数量等进行归一化处理,需可引进“内参”评估转染效率,使得实验数据更准确,该系统称为双荧光报告系统。FLuc和RLuc常用在双荧光报告系统中,这是因为两种酶半衰期短,催化的底物和发光颜色均不同,而且RLuc不易受到细胞环境的影响,常作为内参基因。
不同的报告基因系统具有不同的特点,适用于不同应用场景。在氯霉素乙酰转移酶(Chloramphenicol Acetyltransferase,CAT)测定实验中,CAT在真核细胞中不表达,且蛋白十分稳定,检测灵敏度高。但CAT测定实验操作繁琐,线性范围较窄。大肠杆菌β-半乳糖苷酶通常作为校正其他报告因子的内参,但其活性在细菌和血清中较高。在荧光蛋白报告基因系统,在激发光的作用下可以直接观察,可用于长期监测活细胞蛋白的定位和定量。但生物体内的许多物质在受到激发光激发时,会产生非特异性的荧光(如老鼠的毛皮、肌肤等),影响检测灵敏度。而荧光素酶报告基因实验是依靠酶与底物的特异性反应发光,不需要激发光的激发,而且荧光素酶在绝大多数细胞是不表达的,拥有极低的背景。并且萤火虫荧光素的发光具有很强的“穿透性”,可用于检测动物体内移植细胞的定位和定量。
| 报告基因 | 适用场景 |
| 氯霉素乙酰转移酶 | 体外实验:基因表达。 |
| 大肠杆菌β-半乳糖苷酶 | 体外实验:内参、免疫组化 |
| 荧光素酶 | 双荧光报告系统;体内实验。 |
| 荧光蛋白 | 活细胞观察。 |
表1 不同的报告基因系统的比较分析
二、 实验目的
荧光素酶报告基因实验具有广泛的应用前景,可用于研究转录因子与靶基因启动子的互作、microRNA与mRNA的互作、检测信号通路的活性以及高通量筛选化学小分子对蛋白表达的影响等。
转录因子与靶基因启动子的互作:将靶基因的启动子区域(~2000bp)克隆到FLuc的启动子端,并共转相应的转录因子,检测荧光素酶的活性。
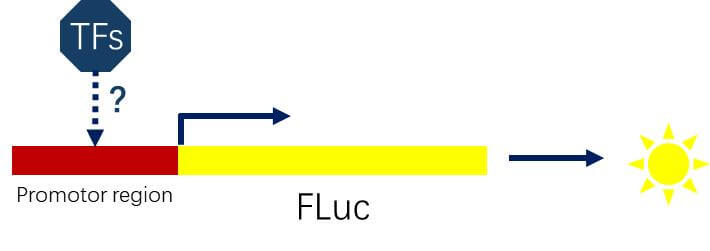
图 2 研究转录因子与靶基因启动子的互作的示意图
microRNA与mRNA的互作:将待测基因的3‘UTR克隆到FLuc的3’UTR区域,并共转相应的调控microRNA,检测荧光素酶活性。
检测信号通路的活性:将信号通路的响应原件(Response Element,RE)序列克隆到有最小启动子(minimal Promoter,minP)前,并共转相应的上游调控元件(Upstream Regulatory Element,URE),研究信号通路是否被活化。
高通量筛选小分子对蛋白表达的影响:利用CRISPR-CAS9的技术,将luciferase基因敲入到靶基因3’端,luciferase与靶蛋白形成融合蛋白。通过荧光素酶活性指征特定的小分子对靶蛋白表达的影响,适用于微量表达蛋白的研究。
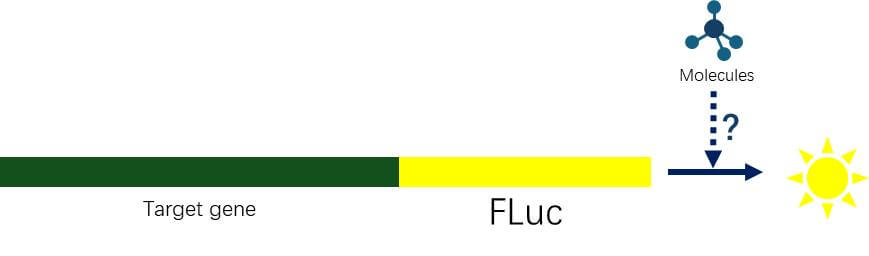
图 3 高通量筛选小分子对蛋白表达的影响示意图
三、 实验步骤
1. 质粒构建:根据研究目的选择合适的质粒。在研究转录因子对基因表达的影响时,通常选用20载体和pRL载体(图6),其中pGL4.20载体的FLuc基因上游无启动子,为多克隆位点,可插入感兴趣的启动子序列。pRL系列载体主要是启动子不同,可依据不同实验需要,选择合适的启动子,通常选择活性较弱的TK启动子。
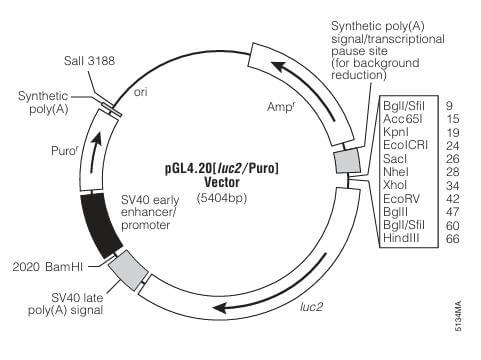
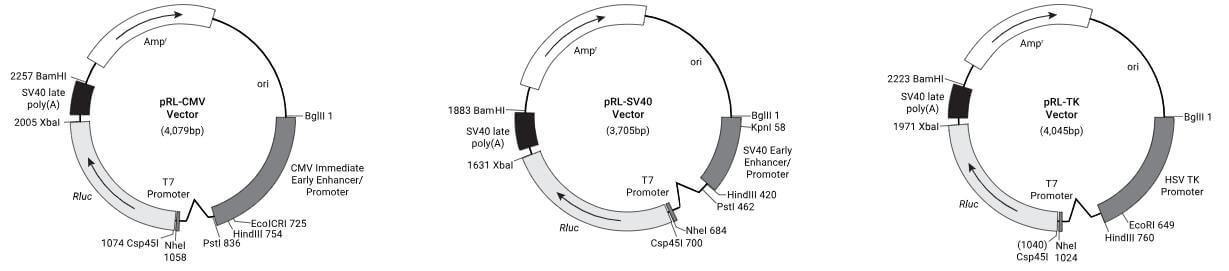
图 4 pGL4.20载体与pRL系列载体示意图
在研究microRNA和mRNA互作时,可选用pMIR-REPORT Luciferase,其中FLuc的3’UTR端有多克隆位点,可将靶基因的3’UTR插入到该位点。该质粒的内参是pMIR-REPORT™ β-半乳糖苷酶报告基因对照载体。此外,还可将内参基因和报告基因放在同一个质粒上,该质粒名称为pmirGLO,用于评估miRNA的活性。
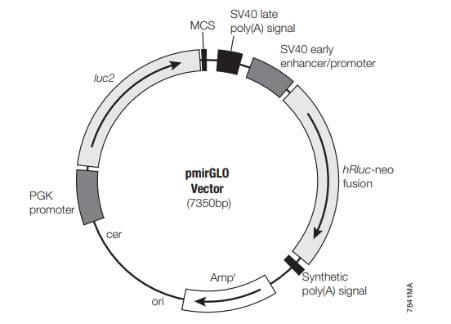
图 5 pmirGLOP载体示意图
2. 细胞转染:转染试剂可为PEI、氯化钙、lipofectamine2000等。若使用双质粒系统,内参基因质粒与报告基因质粒的比值大概为1:10,确保内参基因不影响报告基因的表达。转染后的24-36h,进行相应检测。
3. 报告基因检测:裂解细胞,离心取培养基上清,加入到96孔板内。加入相应的FLuc缓冲液,检测荧光值。再加入STOP+RLuc缓冲液,并检测荧光值。
四、 数据分析
1. 计算出每孔的Firefly Luciferase/ Renilla Luciferase 的荧光强度的比值。
2. 计算对照组多个复孔的平均值Average-control,并用实验组的荧光值比值除以该平均值得出“归一化”后的值,相当于将对照组的值当作“1”进行数据分析。
3. 将对照组和实验组“归一化”的值做柱状图分析。
五、 疑难解答
1. 荧光值过高:荧光值过高可能会超出仪器检测范围,建议降低转染质粒量和接种细胞数量,或稀释裂解上清等。
2. 荧光值过低:荧光值过低接近背景值,会导致结果误差较大,建议提高转染质粒量和细胞数量或减少裂解液的体积等。因为荧光素酶报告实验是酶促反应,反应过程要确保底物过量,而且反应过程中各个组分需平衡至室温(最适反应温度)。
3. 复孔间差异较大:若用排枪加样,确保每个枪头插稳,操作过程应避免气泡产生。若为裂解产物,需离心后取上清,确保样品的均一性。
热门Luc细胞现货,欢迎咨询!










