前列腺癌研究常用的细胞系有哪些?


前列腺癌研究常用的细胞系有哪些?

前列腺癌是男性中最常见的癌症之一,占全球所有确诊病例的26%,占估计死亡人数的11%[1]。目前,标准的前列腺癌治疗是基于雄激素受体(AR)剥夺。然而,当疾病发展到转移阶段时,由于雄激素抵抗,这是无效的。且获得性耐药是一个重大问题。前列腺癌细胞模型在前列腺癌研究中有着重要作用,可用于探究发病机制、研究细胞生物学特性、进行药物筛选和作用机制研究、发现新的前列腺癌生物标志物等。接下来,跟随小源来了解3个常用的人前列腺癌细胞系是怎样为前列腺癌研究提供有力支撑的。
货号:YC-C009
来源:一名50岁白人男性患者(血型B+)的左锁骨淋巴结针刺活检中分离而来。
特点:细胞呈现轻微贴壁增长特征,在裸鼠中具有致瘤性,对5-α-二氢睾酮(生长调节子和酸性磷酸酯酶产物)有响应,表达人前列腺酸性磷酸酶,并表达AR(腺体形成和管腔分化标志物雄激素受体)和PSA(前列腺特异性抗原),其生长受到雄激素撤退的抑制,类似于人类前列腺腺癌。神经内分泌标记物和干细胞相关标记物 CD44呈阴性(-)。[2]
应用案例:
为了确定恩杂鲁胺(enzalutamide)在治疗前列腺癌过程中导致其敏感或抗性的原因,作者用LNCaP细胞做了一个全基因组敲除文库(Genome-wide CRISPR knockout screen)的筛选[1]。由此发现,参与表观遗传调控与干细胞生物学的重要基因是导致恩杂鲁胺耐药的关键因子。同时还发现HOXA9缺失会促进恩杂鲁胺的敏感性,而其过表达则会导致耐药性。最后,作者通过实验验证了HOXA9的抑制剂对恩杂鲁胺有增效作用,除此之外,该抑制剂还能恢复RB-p53双突变细胞对恩杂鲁胺的反应性。由此推断,抑制HOXA9可能是治疗恩杂鲁胺耐药前列腺癌患者的一种方法。[3]
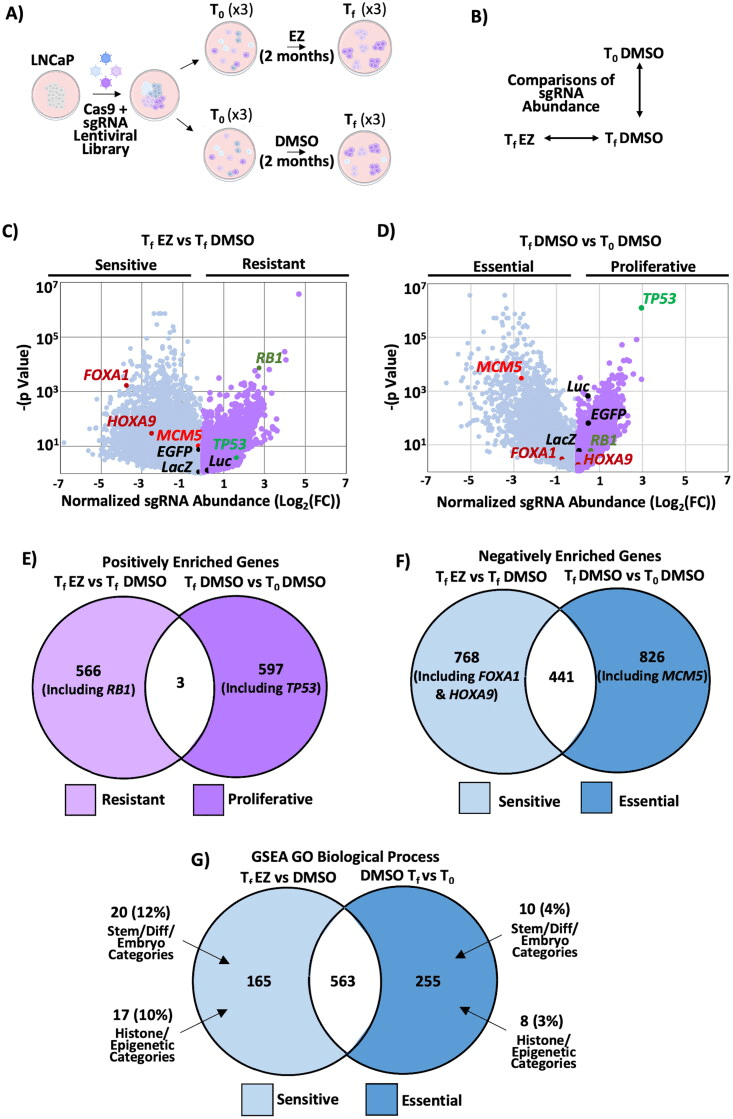
图1 全基因组CRISPR敲除筛选发现,在恩杂鲁胺处理下,干细胞和表观遗传相关基因对细胞活力至关重要
货号:YC-C010
来源:源于一位62岁白人男性Ⅳ级前列腺腺癌患者的骨头转移灶。
特点:细胞的酸性磷酸酶活性和5-α-睾丸激素还原酶活性都低,不表达AR和PSA,其增殖不依赖于雄激素,与前列腺小细胞神经内分泌癌(SCNC)类似。神经内分泌标记物和干细胞相关标记物 CD44呈阳性(+)。[2]
应用案例:
为了设计新的PC治疗干预措施,应用CRISPR/CAS9介导的同源重组基因编辑,对PC-3前列腺癌细胞进行定位淘汰,以证实BLM对DEPS的影响。采用病理扫描法测定PC组织中节蛋白的磷酸化反应。用免疫组织化学和自动化西方斑(WES)分析来验证这些结果。作者研究了BLM是否调节一系列原基因信号通路的磷酸化以促进PC的进展。发现在PC-3细胞中沉默BLM可显著降低其增殖能力。此外,BLM下降调节显著降低了磷酸化蛋白激酶B(AKT(SR473))和富含普罗氨酸的AKT底物40kda(PRAS40(ThR246))的水平,并伴随着活性氧种(ROS)水平的提高。另外,还发现AKT和PRAS40的抑制作用降低了BLM,提高了ROS水平,并诱导了PC细胞的凋亡[4]。
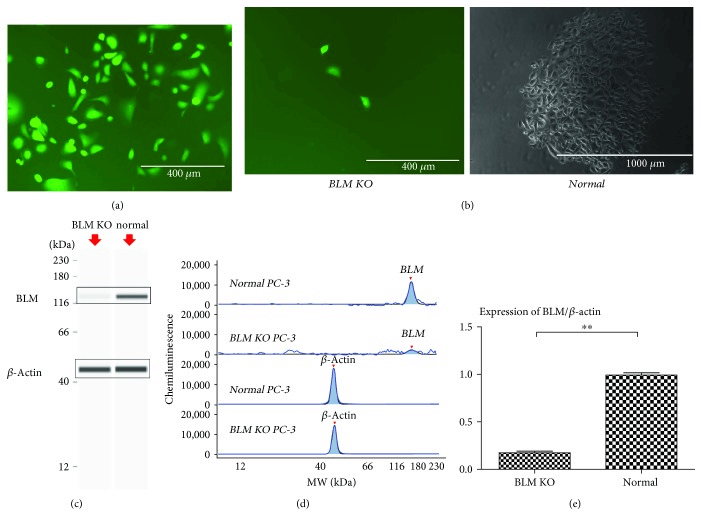
图2 在PC-3细胞中定向敲除BLM基因
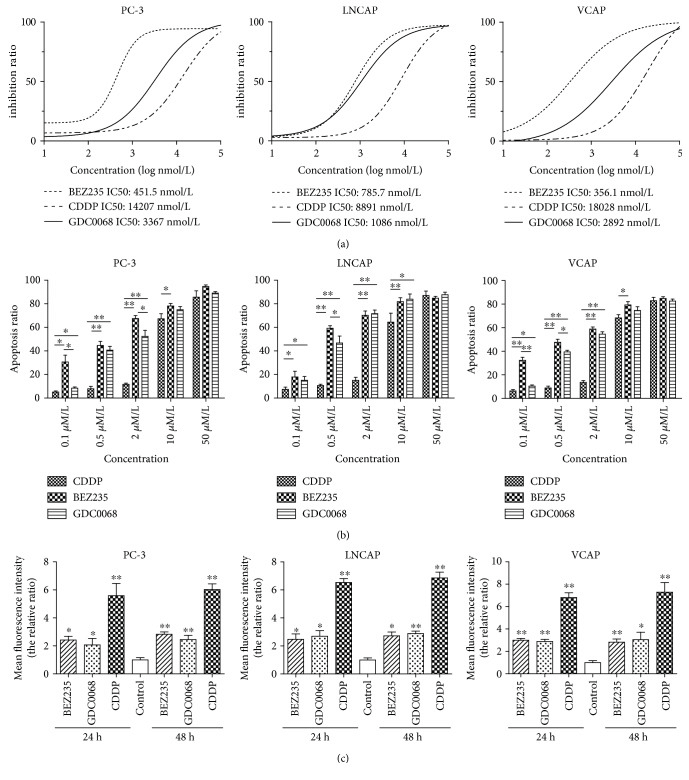
图3 BEZ235和GDC-0068在PC细胞中比CDDP更能减少增殖并诱导凋亡。
货号:YC-C012
来源:22RV1是一种人类前列腺癌上皮细胞系,来源于人前列腺癌异种移植物(CWR22R)。该移植物源于在阉割诱导的亲本雄激素依赖性CWR22异种移植物,肿瘤消退后又复发,在裸鼠体内连续增殖而成。
特点:该细胞系代表一个超DNA二倍体干细胞系,进化为细胞遗传学亚系。基本核型与祖代异种移植CWR22相近,且相对简单,含有50条染色体。在裸鼠上具有致瘤性。生长受到双氢睾酮的微弱刺激,并通过WB分析与雄激素受体抗体发生免疫反应。生长受到表皮生长因子的刺激,但不受转化生长因子β1的抑制。该细胞系还表达AR和PSA;细胞生长可较弱地受双氢睾酮激活, 较强地被EGF激活,但不受TGF-beta-1的抑制调节;最近发现,22RV1细胞系可产生高滴度的人XMRV逆转录病毒。[5]
应用案例:
为了研究治疗去势抵抗性前列腺癌的新机制和潜在靶点,通过用22RV1细胞构建PRDX5基因敲除细胞系(源井构建),证明了抑制PRDX5可抑制培养中的DTP细胞增殖,减缓动物模型中的CRPC发展,并稳定患者PSA进展和转移病变[6]。
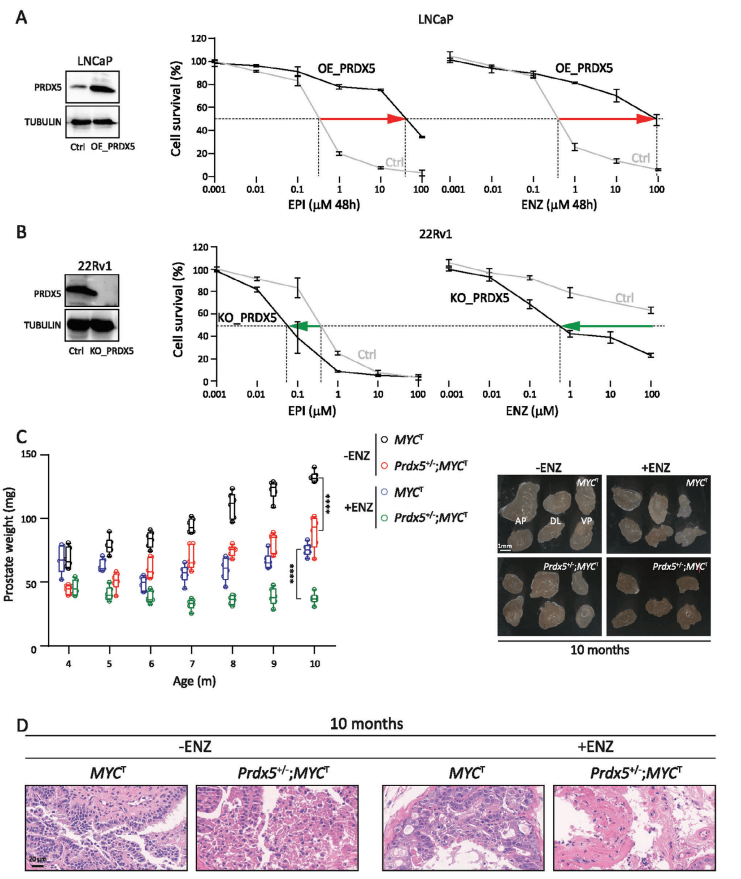
图3 PRDX5在AR抑制剂耐药和CRPC发展中的关键作用
从上述案例来看,前列腺癌的研究主要还是集中在发现新的治疗措施,而基因编辑技术及大规模筛选的应用更是加速了前列腺癌治疗研究的进展。此外,有些研究还会采用多种前列腺癌细胞系进行交叉验证,以增强研究结果的可靠性。大家可以根据实际的研究目标和实验条件,选择最合适的细胞系开展研究。
参考文献:
[1]Juliana A Camargo et al. “The Effect of Gene Editing by CRISPR-Cas9 of miR-21 and the Indirect Target MMP9 in Metastatic Prostate Cancer.” Int J Mol Sci. 2023 Oct 3;24(19):14847. doi: 10.3390/ijms241914847.
[2]Sheng Tai et al. “PC3 Is a Cell Line Characteristic of Prostatic Small Cell Carcinoma.” Prostate: 2011 Mar 22;71(15):1668–1679. doi: 10.1002/pros.21383.
[3]Michael V Roes et al. "A Genome Wide CRISPR Screen Reveals That HOXA9 Promotes Enzalutamide Resistance in Prostate Cancer." Mol Cell Biol. 2024 Sep 20;44(12):529–542. doi: 10.1080/10985549.2024.2401465.
[4]Kun Chen et al. “Bloom Syndrome Protein Activates AKT and PRAS40 in Prostate Cancer Cells.” Oxid Med Cell Longev: 2019 May 9;2019:3685817. doi: 10.1155/2019/3685817
[5]R. Michael Sramkoski et al. "A new human prostate carcinoma cell line, 22Rv1." In Vitro Cell Dev Biol Anim. 1999 Jul-Aug;35(7):403-9. doi: 10.1007/s11626-999-0115-4.
[6] Wang, R., Mi, Y., Ni, J., Wang, Y., Ding, L., Ran, X., Sun, Q., Tan, S.Y., Koeffler, H.P., Feng, N., and Chen, Y.Q. (2023). Identification of PRDX5 as A Target for The Treatment of Castration-Resistant Prostate Cancer. Adv Sci (Weinh), e2304939. 10.1002/advs.202304939.










