CRISPR文库筛选|一文教你搭建功能筛选体系


CRISPR文库筛选|一文教你搭建功能筛选体系

CRISPR筛选是一项革命性的技术,能够高通量、精准、系统性地在大规模基因乃至全基因组范围内鉴定出与特定生物学表型或功能相关的基因。在此过程中,从“广撒网”地去进行基因调控,转向特定表型与功能的精准剖析,搭建出能够精准模拟自己研究模型的功能筛选体系就变得至关重要。
功能筛选:细胞世界的“优胜劣汰”实验
简单来说,功能筛选就是对构建好的细胞集群(cell pool)施加特定的“压力”,诱导其产生目标表型(如耐药、迁移、激活、死亡等),再通过巧妙的方式将符合要求的细胞群体“富集”出来的过程。
核心机制:
在筛选压力下,经过基因编辑(如 敲除/激活/抑制)后获得优势(如更耐药、增殖更快)的细胞会茁壮成长,而处于劣势(如更敏感、生长停滞)的细胞则被淘汰。这个过程如同“自然选择”,最终通过分析富集后细胞携带的 sgRNA,就能锁定符合条件的关键基因靶点。
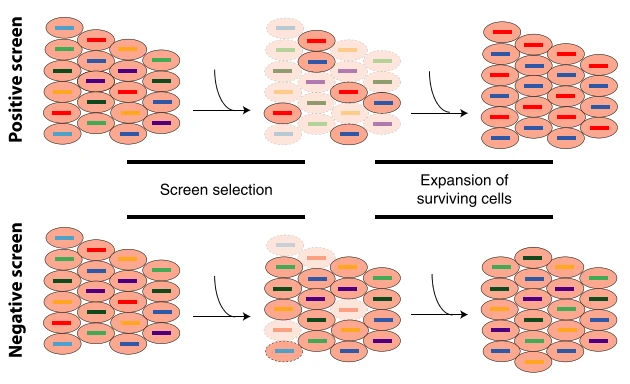
图1. 功能筛选的核心机制——“优胜劣汰”[1]
功能筛选体系的搭建
功能筛选体系是基于我们个性化的科研需求和目的表型来搭建的。一个系统的功能筛选体系由“压力施加”和“表型富集”两大部分组成。
压力施加——模拟“战场环境”
“压力施加”是指根据研究目的,我们为细胞设计并施加精准的筛选压力,诱导目标表型的产生。源井生物提供多样化的“压力源”选择:
- 1. 传代培养——“自然演化”:通过细胞的长期自然培养和传代,使携带适应性基因变异的细胞获得生长优势而逐渐富集,携带敏感性/致死性基因变异的细胞则失去生长特性而逐渐减少或死亡。
- 2. 药物处理——“药物考验”:通过加入特定药物处理细胞,诱发其产生相应表型,携带耐药性基因变异的细胞获得生长优势而逐渐富集,携带敏感性/致死性基因变异的细胞则失去生长特性而逐渐减少或死亡。
- 3. 病毒感染——“病毒攻防”:通过加入特定的病原体或病毒感染细胞,使其出现相应表型,携带适应性基因变异的细胞获得生长优势而逐渐富集,携带敏感性/致死性基因变异的细胞则失去生长特性而逐渐减少或死亡。
- 4. 功能细胞共培养——“细胞竞争”:在培养体系中加入特定的功能细胞,如在肿瘤细胞中加入相应的效应性免疫细胞,通过共培养的形式致使目的细胞出现相应表型,携带适应性基因变异的细胞获得生长优势而逐渐富集,携带敏感性/致死性基因变异的细胞则失去生长特性而逐渐减少或死亡。
- 5. 细胞因子刺激——“信号风暴”:通过加入特定生长因子或小分子化合物处理细胞,诱发其产生相应表型,携带适应性基因变异的细胞获得生长优势而逐渐富集,携带敏感性/致死性基因变异的细胞则失去生长特性而逐渐减少或死亡。
- 6. 其他处理方式——“极限挑战”:其他的压力施加方式,如缺氧条件或者营养剥夺等,可以联系小源寻求技术支持,我们可以根据客户的个性化需求为其设计和搭建合适的功能筛选体系。
表型富集——精准“选拔精英”
“表型富集”是指针对压力施加后产生的目的表型,挑选相应的富集方式捕获筛选后的细胞。源井生物提供目前主流的富集方式:
- 1. 一定时间段内培养后的细胞收获(基于细胞增殖/凋亡):根据压力施加后细胞在增殖/存活能力上的变化,在经过特点时间段培养后收获细胞,基于细胞数量评估sgRNA的富集与耗竭情况。
- 2. 基于流式分选/磁力分选的细胞收获(基于细胞特异性标志物表达水平):根据压力施加后细胞在其特定标志物表达水平上的变化,通过流式分选或者磁力分选,筛选出标志物表达水平高和表达水平低的细胞群体,从中评估sgRNA的富集与耗竭情况。
- 3. 基于特定介质分离作用的细胞收获(基于行为学表型):根据压力施加后细胞在行为学表型上(如细胞迁移、细胞贴壁)的差异,通过特定介质分离的方式,筛选出目的细胞群体,从中评估sgRNA的富集与耗竭情况。
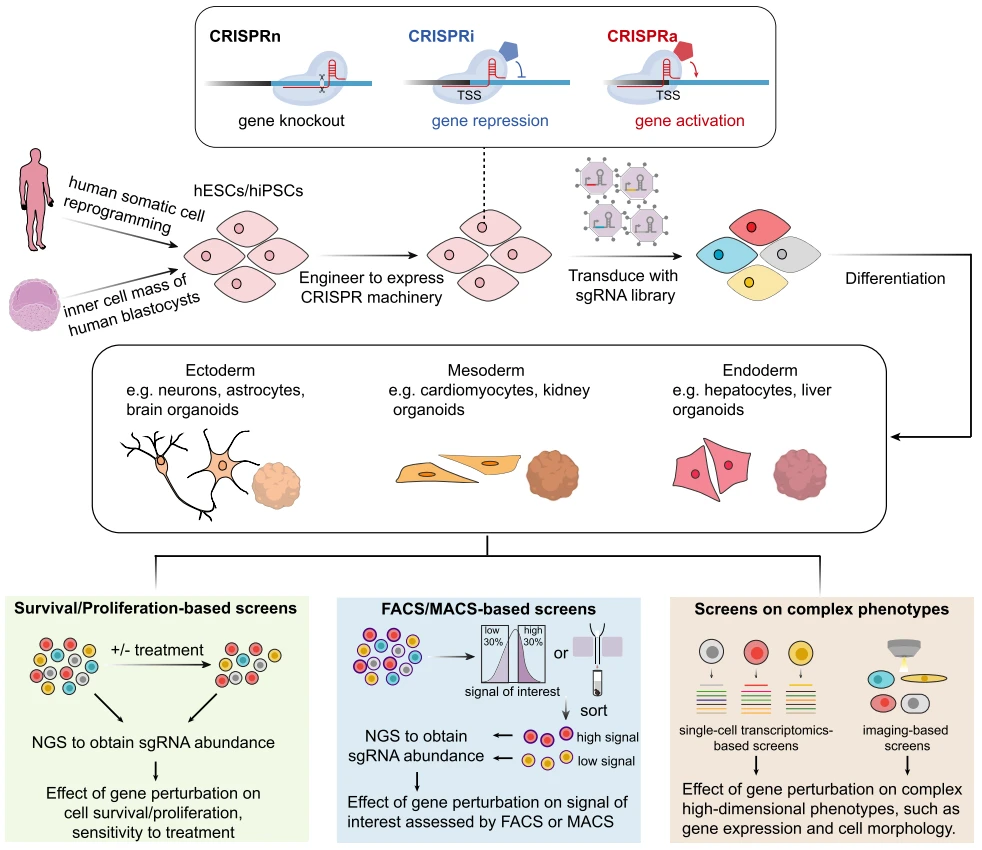
图2.CRISPR筛选流程与功能筛选体系[2]
理清了功能筛选的核心机制和搭建思路,各位老师是不是已经初步形成大致的研究框架啦?然而,功能筛选虽作用强大,但也面临实验规模大、条件摸索难、技术门槛高等挑战。
功能筛选的主要难点:
- 1. 细胞培养规模较大,培养设备和耗材需求量大;
- 2. 筛选条件需要大量预实验摸索;
- 3. 对细胞培养技术和条件要求较高;
- 4. 依赖功能筛选体系相关的专业知识和操作经验;
- 5. 需要精细化实验工艺的支撑;
- 6. 需考虑CRISPR筛选各流程节点的衔接;
源井多样化表型筛选/分析平台
通过不同压力种类和富集方式的正交组合,能够衍生出多种多样的功能筛选体系,我们可以根据自己的科研需求,选择合适的“压力施加”和“表型富集”的方式,个性化定制我们的功能筛选体系。应对各类科研需求,源井生物已搭建出多样化的表型筛选/分析平台,能够为我们的客户提供各类功能筛选的精细化服务。

图3. 源井生物CRISPR-iScreen™功能筛选平台
技术路线:
技术路线
应用场景(范例)
组合:传代培养+基于细胞增殖/凋亡的富集方式
该筛选体系通常可用于:
- 1. 细胞生长/存活必需基因的筛选;
- 2. 合成致死靶点的筛选。
组合:传代培养+基于细胞特异性标志物表达水平的富集方式
该筛选体系通常可用于:
- 1. 抗原表位识别;
- 2. 信号通路调控机制研究;
- 3. 单基因调控机制研究。
组合:传代培养+基于行为学表型的富集方式
该筛选体系通常可用于:
- 1. 细胞迁移相关调控因子;
- 2. 细胞贴壁相关调控因子;
组合:药物处理+特定富集方式
该筛选体系通常可用于:
- 1. 肿瘤耐药基因筛选;
- 2. 药物协同作用基因筛选;
- 3. 药物作用靶点/机制研究。
组合:感染病毒+特定富集方式
该筛选体系通常可用于:
- 1. 病毒感染宿主相关因子的探索;
- 2. 疫苗协同作用基因筛选;
- 3. 疫苗作用靶点/机制研究。
组合:功能细胞共培养+特定富集方式
该筛选体系通常可用于:
- 1. 鉴定调控免疫细胞持久性/耗竭抵抗的基因;
- 2. 鉴定调控肿瘤细胞对免疫杀伤敏感性的基因;
- 3. 鉴定调控免疫细胞活化诱导细胞死亡的基因;
- 4. 鉴定影响细胞因子/营养竞争生存优势的基因。
组合:细胞因子刺激+特定富集方式组合:细胞因子刺激+特定富集方式
该筛选体系通常可用于:
- 1. 细胞特定生物学过程促进/抑制因子的探索;
- 2. 2.信号通路调控机制研究;
- 3. 鉴定调控免疫细胞活化诱导细胞死亡的基因;
虽然目前体外功能筛选体系的使用相对更为广泛,稳定性与灵活性也相对较高,通常在初步筛选、机制探索、大规模靶点发现阶段发挥高效优势,但如果希望在转化研究、验证关键靶点、评估复杂表型(免疫、转移、耐药、系统性效应)等方面获得更接近临床实际的数据,体内筛选将是不可或缺的环节。体内功能筛选的核心优势在于其无可比拟的生理和病理相关性。它能够揭示基因功能在完整生物体、复杂微环境和动态系统作用下的真实情况,尤其是在研究免疫互作、肿瘤转移、药物体内反应(PK/PD)、系统性效应和宿主因素方面,是体外筛选无法替代的关键环节。相对于体外筛选而言,它具有以下核心优势:
- 1. 模拟真实的生理和病理环境;
- 2. 整合免疫系统的作用;
- 3. 更准确的药物反应和耐药性研究;
- 4. 评估体内适应性和选择压力;
- 5. 发现与转移、定植相关的基因;
- 6. 评估活体治疗窗口和潜在毒性;
- 7. 鉴定活体宿主因素;
需要注意的挑战:
当然,体内筛选也存在挑战:成本更高、周期更长、技术操作更复杂(如sgRNA文库递送、动物实验伦理要求等)、数据分析更困难(背景噪音、异质性)、通量通常低于体外筛选。因此,体内筛选的搭建,往往需要根据实验需要,进行更加周详、完善的设计,以保证筛选体系的稳定性和准确性。
更多功能筛选体系的应用场景可联系小源,我们将为您提供更加详尽的材料与解答。
![体外与体内功能筛选体系[3]](/uploads/allimg/250717/36-250GG52026292.webp)
图4. 体外与体内功能筛选体系[3]
应用案例
1 CRISPR-Cas9 knockout screening in human cells, Science.
功能筛选体系:传代培养(压力种类)+细胞存活/增殖(富集方式)
应用:鉴定人黑色素瘤细胞与多能干细胞的生长必需基因
就目前而言,此类功能筛选体系已经并不多见,这是由于该方法在CRISPR筛选体系建立之初曾被大量使用,用于鉴定多种类型的细胞生长或增殖必需基因,如在该研究工作中,作者通过该功能筛选体系成功筛选出人黑色素瘤细胞与人多能干细胞生长必需的基因,对CRISPR筛选技术的推动以及肿瘤生物学领域提供了十分宝贵的指导作用和理论基础。
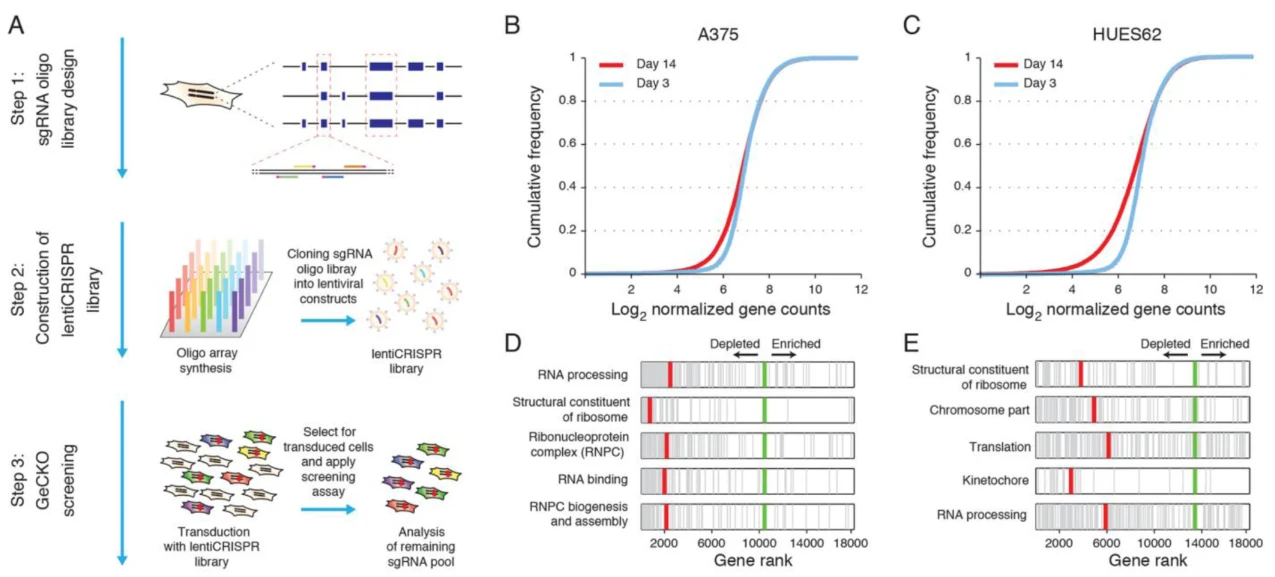
图1. 用于探索细胞生长/增殖必需基因的功能筛选体系
2 CRISPR screening identifies the deubiquitylase ATXN3 as a PD-L1-positive regulator for tumor immune evasion, J Clin Invest.
功能筛选体系:传代培养+基于细胞特异性标志物表达水平的富集方式
应用:单基因调控机制研究
作者构建了一个涵盖96个去泛素化酶家族成员的CRISPR筛选平台,通过分析PD-L1低表达和高表达细胞群体,鉴定出ATXN3是PD-L1转录的正调控因子。ATXN3缺失的肿瘤对低剂量抗PD-1治疗反应更好,其抑制可增强免疫检查点阻断治疗效果。
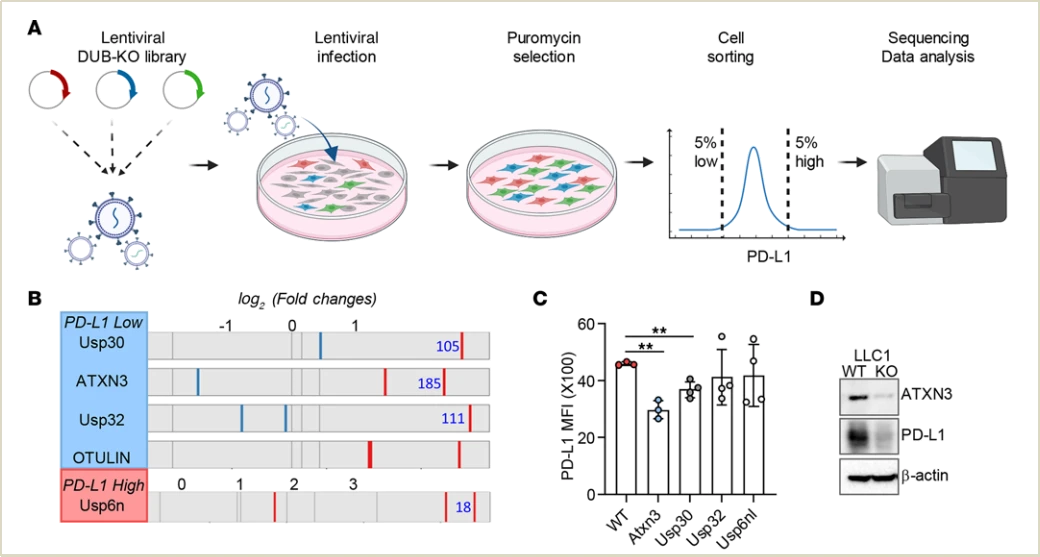
图2. 用于研究基因上游调控靶点的功能筛选体系
3 Gliocidin is a nicotinamide-mimetic prodrug that targets glioblastoma, Nature.
功能筛选体系:药物处理(压力种类)+细胞存活/增殖(富集方式)
应用:探索抗脑癌化合物Gliocidin的作用机制
在该项研究中,作者采用小鼠全基因CRISPR敲除文库(Brie),在NG2-3112实现CRISPR筛选。随后,作者通过不同浓度的Gliocidin(IC50和IC80)处理细胞,并在给药后的第0天和第14天收集细胞。正向筛选与负向筛选的结果显示,mTORC1的正向调节因子和负向调节分子分别会导致该肿瘤细胞对Gliocidin的敏感性在一定程度上发生相应的降低和增加,暗示了mTORC1通路在Gliocidin抗脑瘤药效作用上的重要性。
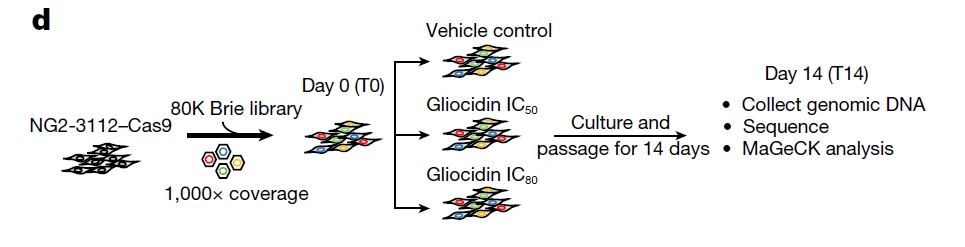
图3. 用于研究药物作用靶点的功能筛选体系
4 An E3 ligase network engages GCN1 to promote the degradation of translation factors on stalled ribosomes, Cell.
功能筛选体系:药物处理(压力种类)+ 流式分选(富集方式)
应用:筛选Ternatin-4介导eEF1A降解的作用机制
在本研究中,作者构建mCherry-eEF1A融合蛋白过表达细胞系,并通过CRISPRi抑制文库对该细胞系进行UPS基因集的筛选。基于前期对Ternatin-4促进eEF1A降解的发现,作者在体系中加入Ternatin-4,并根据mCherry的荧光强度高低对处理后的细胞进行富集,最终成功发现RNF14和RNF25对eEF1a和核糖体蛋白泛素化的关键介导作用。
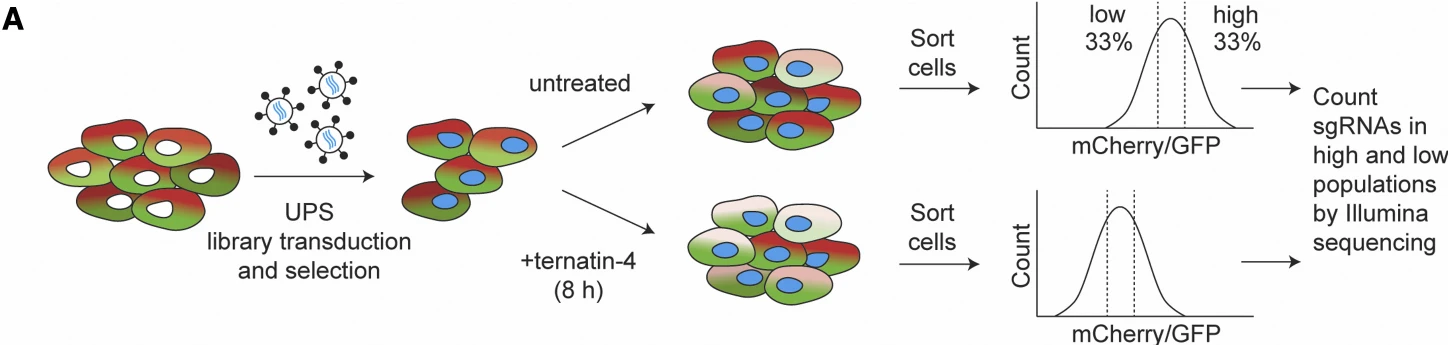
图4. 药物处理联合流式分选解析信号通路作用机制
5 Whole-genome screens reveal regulators of differentiation state and context-dependent migration in human neutrophils, Nature Communications.
功能筛选体系:药物处理(压力种类)+行为学特性(富集方式)
应用:探索参与粘附依赖性与非粘附依赖性细胞迁移、蛋白质运输和肌动肌肽细胞骨架调节的相关基因。
在这项研究中,作者采用全基因组CRISPRi文库,并设计了三种实验模型以研究与中性粒细胞不同迁移运动相关的关键调控因子。在其中两种模型中,作者将细胞接种到具有3μm直径孔的径迹蚀刻膜上方的顶部储液器内,通过在储层不同部位添加10%的热灭活胎牛血清以调整化学引诱梯度,分别用于进行细胞有序趋化性和无序性趋化运动能力的评估。而最后一种模型则将细胞嵌入合成细胞外基质中来探测细胞变形虫样的三维迁移,用来模拟细胞通过组织间隙的迁移。通过此类模型,作者最终确定了344个敲低后能抑制细胞迁移比例的基因和31个敲低后能增加细胞迁移比例的基因,并成功揭示了mTORC1信号在HL60细胞分化中的作用,它影响中性粒细胞丰度,存活和迁移行为。
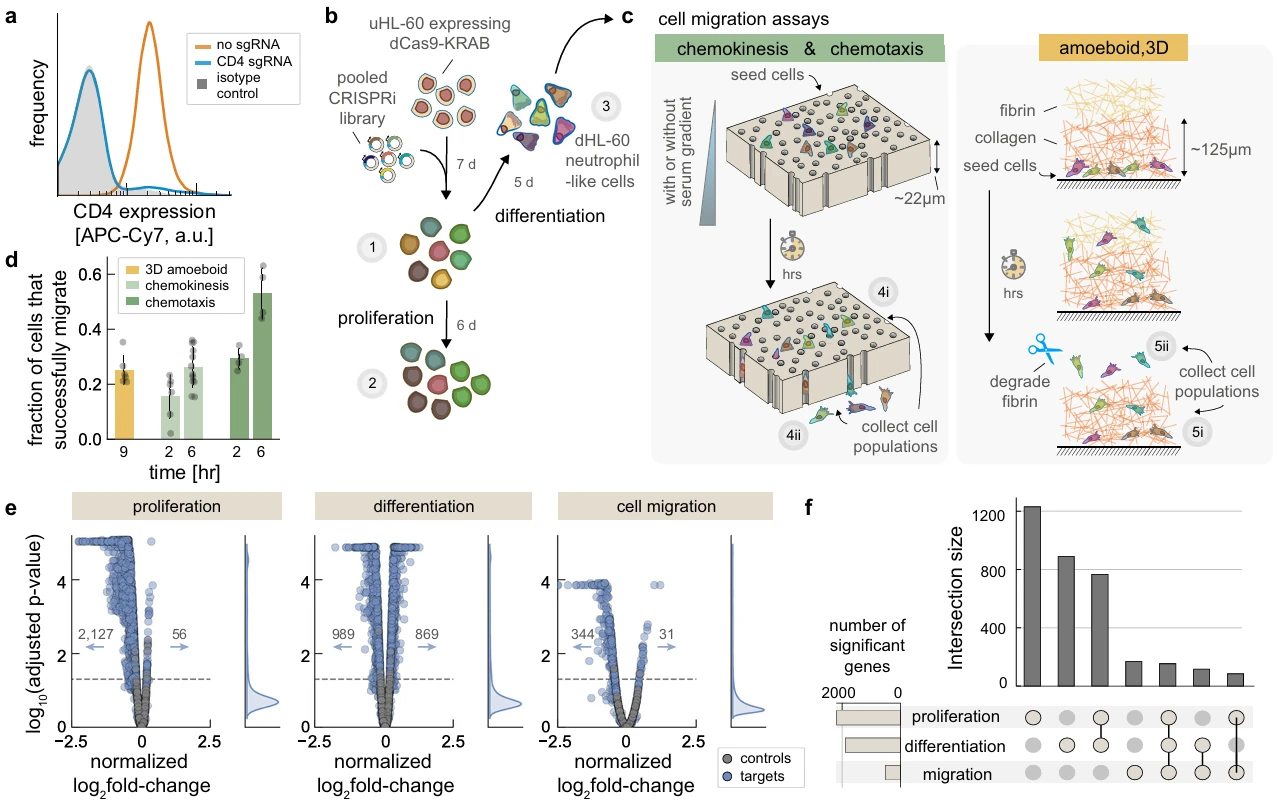
图5. 针对细胞迁移研究的功能筛选模型
6 Replication competent HIV-guided CRISPR screen identifies antiviral factors including targets of the accessory protein Nef
功能筛选体系:功能筛选体系:病毒感染(压力种类)+细胞存活/增殖(富集方式)
应用:探索细胞抗病毒靶点
作者构建1500多种表达sgRNA的复制型HIV-1病毒,靶向500多个基因,筛选增强HIV-1复制适应性的sgRNA。通过在Cas9表达的CD4+ T细胞中传代和NGS分析,发现多个抗病毒因子(如GRN、CIITA、EHMT2等),限制HIV-1复制周期。
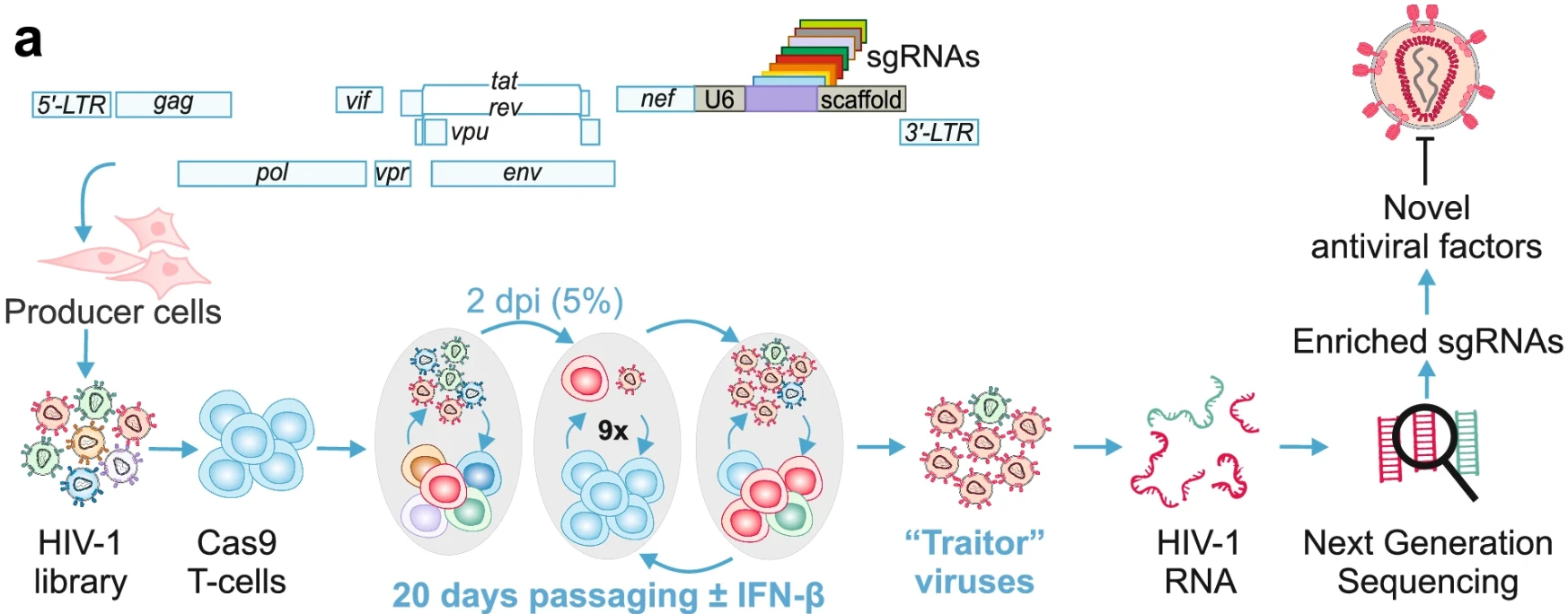
图6. 抗病毒因子研究模型
7 Integrating genome-wide CRISPR immune screen with multi-omic clinical data reveals distinct classes of tumor intrinsic immune regulators, J Immunother Cancer.
功能筛选体系:肿瘤/免疫细胞共培养(压力种类)+细胞存活/增殖(富集方式)
应用:筛选免疫抵抗调节因子
在该工作中,作者通过小鼠结肠癌细胞(MC38)与PmelT细胞共培养这种压力施加方式,旨在找到在免疫治疗中对治疗效果起到重要调控作用的未知基因。在功能筛选过程中,对于T细胞处理组,作者以效应细胞:靶细胞(E:T)比例为0.3:1和1:1加入培养的PmelT细胞处理16小时。对于非T细胞处理组,加入等量的T细胞生长培养基,检测对T细胞介导的细胞毒性的体外敏感性或抗性。研究揭示了两种不同的免疫抵抗调节器,并展示了它们作为治疗靶点提高免疫疗法疗效的潜力。在这些调节器中,PRMT1和RIPK1分别被确定为一种双重免疫抵抗调节器和一种细胞毒性抵抗调节器。尽管不同类型的免疫疗法之间的影响程度有所不同,但基因靶向PRMT1和RIPK1能使肿瘤对T细胞杀伤和抗PD-1/OX40治疗更为敏感。
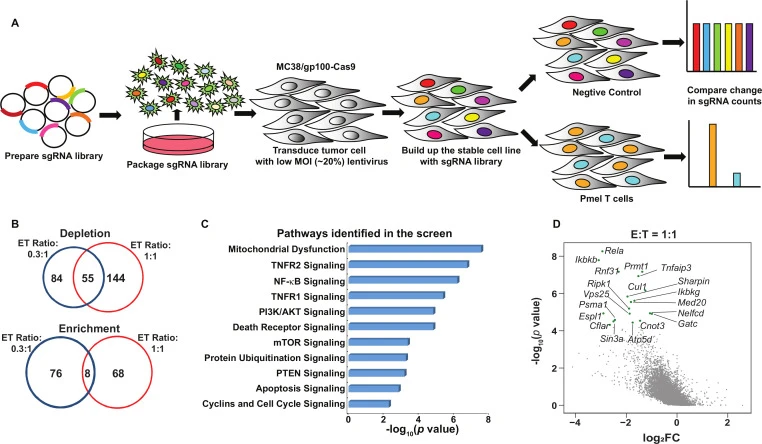
图7. 肿瘤/免疫细胞共培养体系揭示免疫治疗关键调节因子
8 CRISPR–Cas9 screens reveal regulators of ageing in neural stem cells, Nature.
功能筛选体系:细胞因子刺激(压力种类)+细胞存活/增殖(富集方式);
细胞因子刺激(压力种类)+流式分选(富集方式)
应用:从体外层面上寻找与衰老神经干细胞激活相关的重要调控基因
在该项研究中,作者通过全基因组敲除文库对年轻与衰老小鼠中分离出来的原代神经干细胞进行CRISPR筛选,在对静息态的神经干细胞进行文库病毒感染后,通过加入相关细胞因子,诱导神经干细胞从静息态到激活态的转换,增强神经干细胞的活性和增殖能力。在富集方式上,作者分别采用了两种方式,第一种方式是在激活后的第4天通过流式分选的方式分选出Ki67+的细胞以评估sgRNA的数量;而另一种则是基于激活态神经干细胞在增殖能力上的优势,在激活后第14天收集细胞,对sgRNA的数量进行检测。在这两种功能筛选体系的使用和配合下,作者成功找到了301个在敲除后能够在体外特异性地促进衰老神经干细胞激活的关键基因。
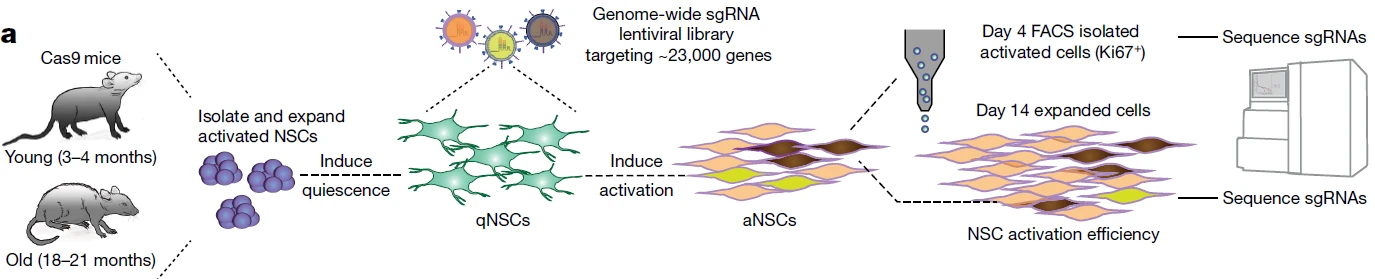
图8. 双功能筛选体系联用锁定衰老神经干细胞活化关键调控因子
9 CRISPR–Cas9 screens reveal regulators of ageing in neural stem cells, Nature
功能筛选体系:体内天然环境生长(压力种类)+行为学表型(富集方式);
应用:从体内层面上寻找与衰老神经干细胞激活相关的重要调控基因
为了检验在体外平台中筛选得到的这些在敲除后能够促进NSC激活的功能靶点,作者进一步开发了针对老年小鼠大脑的体内功能筛选平台。脑室下区的qNSC能够在体内这种天然的环境下激活并产生子代,这些子代细胞会迁移至嗅球区域并分化为新生神经元,这个再生区域的天然特性为体内筛选提供了良好的模型。作者向老龄小鼠的侧脑室注射sgRNA文库病毒,感染脑室下区的神经干细胞,然后对感染5周后嗅球区域组织的基因组DNA进行测序分析。考虑到体内可用于筛选的细胞数量有限,所以作者利用这个体内筛选平台对体外平台中一些具有显著效果的功能靶点进行高效验证。
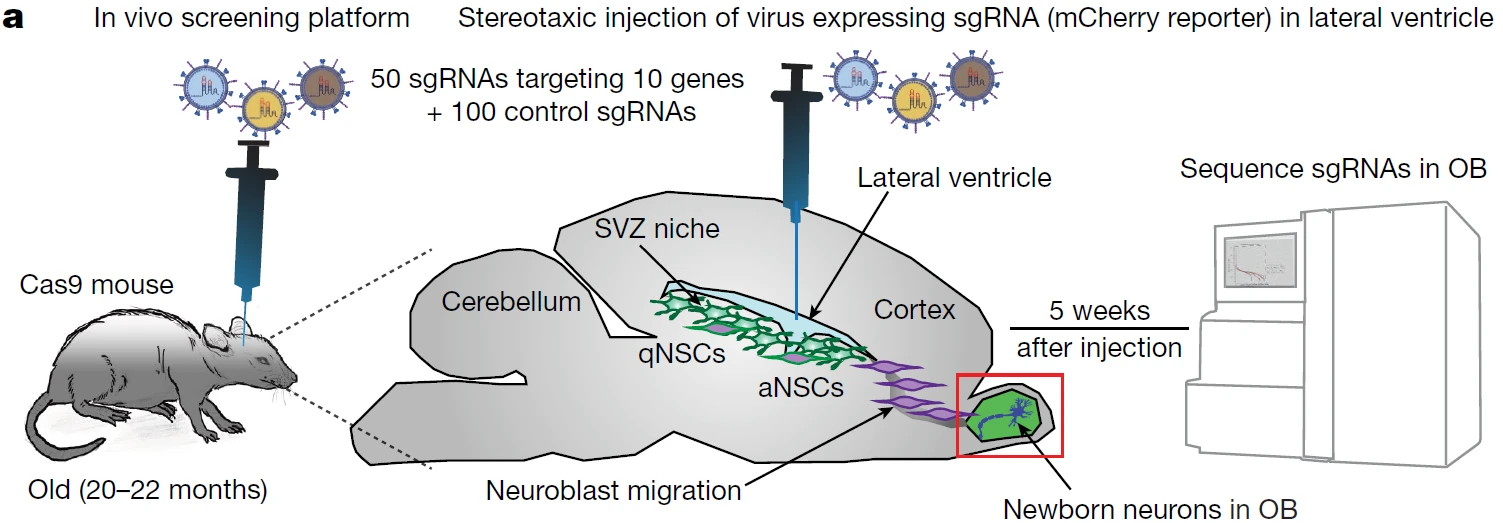
图9. 使用体内功能筛选对衰老神经干细胞活化关键因子进行高效验证
您的研究,我们赋能!
无论您是探索未知机制、筛选药物靶点、破解耐药难题,还是优化免疫治疗策略,源井生物的功能筛选技术平台和专业服务团队,都是您值得信赖的伙伴。我们致力于为您提供:
- 个性化方案设计: 根据您的具体科学问题,量身定制最合适的筛选策略(压力+富集);
- 高效稳定的筛选执行: 依托成熟平台和精细工艺,确保数据质量;
- 筛选全流程无缝衔接: 轻松衔接CRISPR文库筛选全流程,保证稳定性与准确性;
- 专业的数据解读支持: 助力您从海量数据中挖掘生物学洞见。
欢迎咨询交流。
参考文献
[1]Miles LA, Garippa RJ, Poirier JT. Design, execution, and analysis of pooled in vitro CRISPR/Cas9 screens. FEBS J. 2016 Sep;283(17):3170-80.
[2]Li K, Ouyang M, Zhan J, Tian R. CRISPR-based functional genomics screening in human-pluripotent-stem-cell-derived cell types. Cell Genom. 2023 Apr 18;3(5):100300.
[3]Chow RD, Chen S. Cancer CRISPR Screens In Vivo. Trends Cancer. 2018 May;4(5):349-358. doi: 10.1016/j.trecan.2018.03.002.










