肝癌研究常用细胞模型知多少?


肝癌研究常用细胞模型知多少?

肝癌,即原发性肝癌,是一种全球范围内普遍存在的恶性肿瘤。该病在早期阶段通常无明显症状,病情进展迅速,确诊时多数患者已处于晚期。肝癌可能表现为肝区疼痛、乏力、体重下降、黄疸和腹水等症状。肝癌细胞模型对于研究肝癌的发生、发展及其生物学特性至关重要,它们为药物筛选、治疗方案评估和新药开发提供了重要的实验平台。今天,小源给大家介绍一下肝癌研究中常用的细胞模型以及应用案例吧~
人肝癌细胞(Hep G2)
货号:YC-C001
来源:Hep G2细胞系源于一名 15 岁白人男性的肝母细胞瘤。
分子表达:Hep G2细胞保留了许多正常肝细胞的基因表达特征,它能够表达多种肝脏特异性基因。
生长特性:形态特征与正常肝细胞相似,贴壁生长。
应用:在众多肝脏相关研究领域,如药物毒性评估、生物人工肝系统构建以及乙型肝炎病毒模型研究等方面,具有广泛的应用。
应用案例:
Dawn S. Chandler等运用CRISPR-Cas9技术在Hep G2细胞中成功构建了模拟特定遗传性代谢疾病——苯丙酮尿症(PKU)的细胞模型。研究人员在利用同源定向修复(HDR)机制,精确引入预定的点突变,以模拟PKU疾病的剪接缺陷。此方法不仅显著提升了对疾病机制的理解程度,同时为新型治疗方法的开发提供了极具价值的实验模型,为后续相关研究奠定了坚实基础,有助于开发此类疾病的有效干预策略[1]。
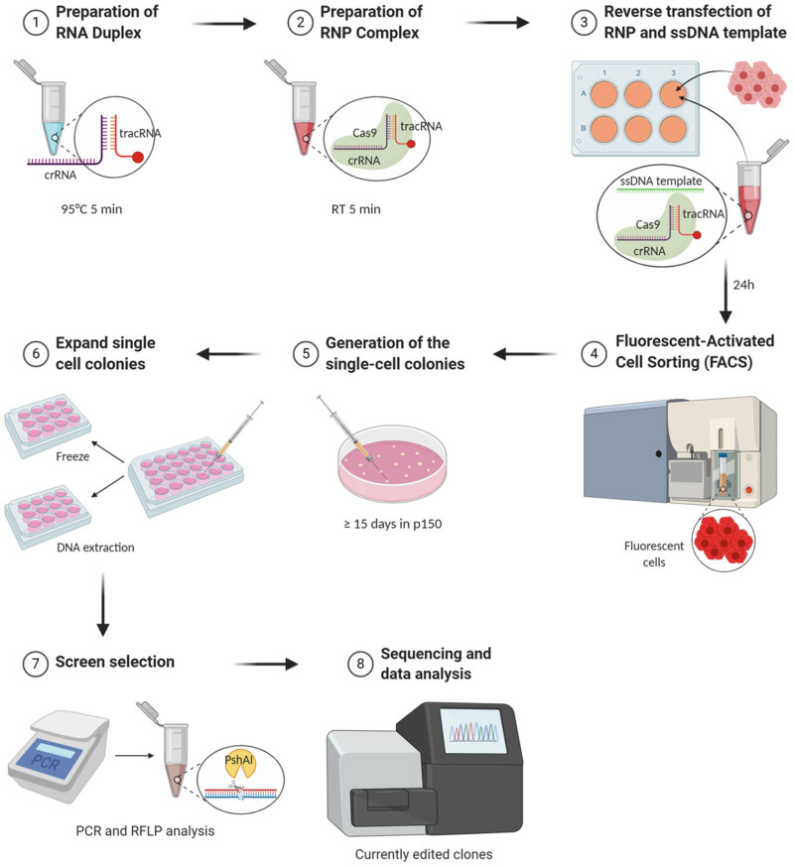
图1基因编辑实验方案大纲
人肝癌细胞(Huh7)
货号:YC-D001
来源:Huh7细胞是一种人类肝细胞癌衍生的细胞系,最初由Nakabayashi等人在1982年从一位57岁日本男性的肝肿瘤中建立。
分子表达:Huh7 细胞表达多种与肝脏功能相关的基因。除此,该细胞还可以表达与病毒感染和免疫相关的基因。例如,Huh7细胞表达的某些宿主因子基因对HCV的感染和复制至关重要。
生长特性:具有上皮样形态,贴壁生长。对多种化疗药物表现出耐药性。
应用:Huh7 细胞是丙型肝炎病毒(HCV)研究的经典细胞系。除此,还常用于肝癌发生机制的研究。
应用案例:
Ajay K Israni等人采用CRISPR/Cas9技术对Huh7细胞中的CYP3A5基因位点进行精确编辑,以研究其基因表达和药物代谢功能。首先,研究人员选择了Huh7细胞作为宿主,并设计了特定的导向RNA(gRNA)来针对CYP3A5基因的3位点,通过成功敲除3位点,获得了表达CYP3A51基因型的细胞系。药物代谢分析显示,这些细胞系对咪达唑仑和他克莫司的代谢活性增强,表明CYP3A5对药物代谢有显著影响。CYP3CIDE实验进一步证实了这些细胞系在药物代谢方面具有不同的活性,为研究CYP3A5基因型在药物代谢中的作用提供了新的实验模型[2]。
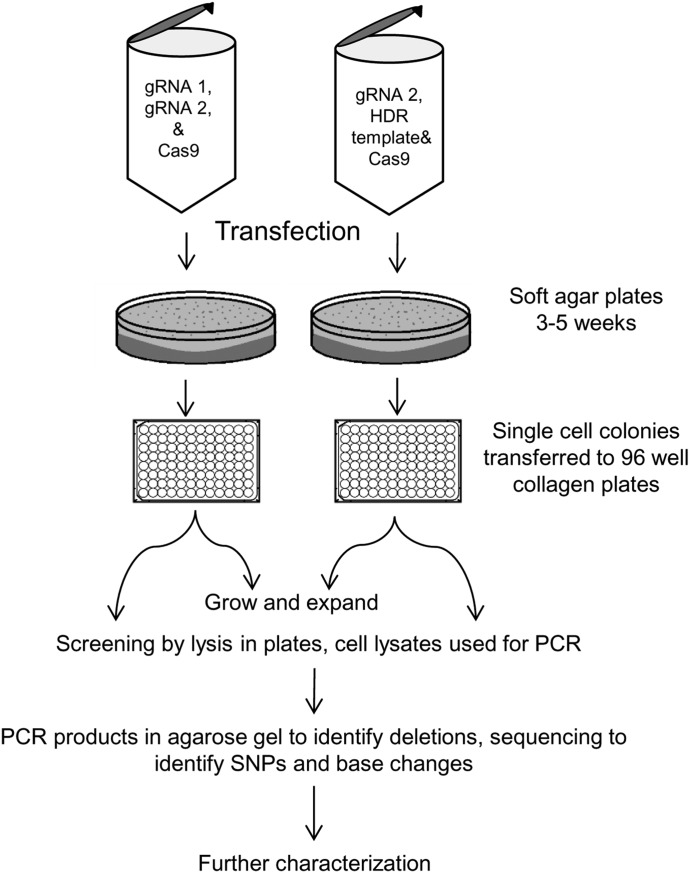
图2 使用CRISPR/Cas9和克隆选择开发CYP3A5基因修饰细胞系的工作流程
人肝癌细胞(SK-HEP-1)
货号: YC-C007
来源:来源于人肝脏组织。
分子表达:SK-Hep1细胞表达多种与肿瘤相关的基因,如:c-Myc基因。此外,SK-Hep1细胞显著表达表皮生长因子受体(EGFR)。
生长特性:具有上皮样形态,贴壁生长。SK-Hep1细胞表现出高度转移能力,具有肿瘤形成性。
应用:SK-Hep1细胞是研究肝癌发生机制的重要模型,同时也常用于筛选和评估抗肿瘤药物。
应用案例:
Shuhua Zhang等利用CRISPR-Cas9基因编辑技术构建了NSD1基因敲除SK-HEP-1细胞系。实验结果显示,NSD1在SK-HEP-1细胞中高表达,并与肝癌患者预后不良相关。敲除NSD1后,SK-HEP-1细胞的增殖、迁移和侵袭能力受到抑制,同时促进了H3K27me3的甲基化,并抑制了Wnt10b的表达,进而抑制了Wnt/β-catenin信号通路,这些变化在裸鼠移植瘤模型中得到了验证,表明NSD1、H3和Wnt10b可能是肝细胞癌的潜在治疗靶点。[3]。
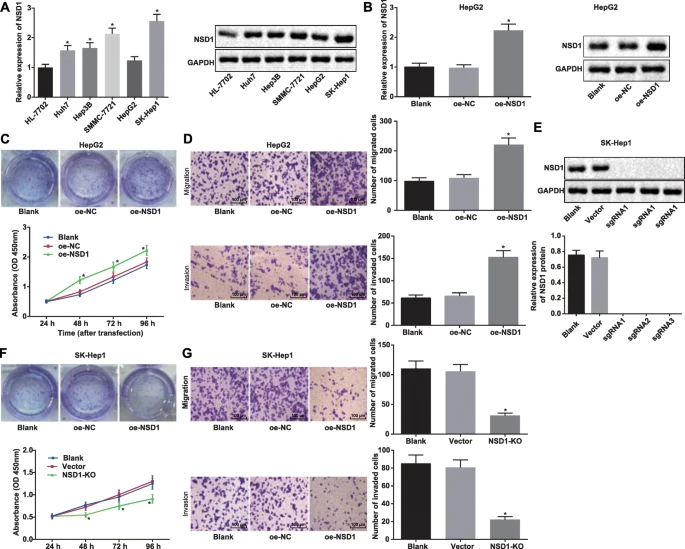
图3 NSD1敲除抑制HCC细胞系的细胞增殖、迁移和侵袭能力
除了以上这些细胞系,还有其他肝癌细胞模型,如Hep3B、SMMC-7721、和MHCC97H等,大家可以根据研究目的、细胞系的遗传背景、生物学特性和药物代谢特性等因素来选择最合适的细胞模型,为肝癌治疗策略的开发和新药筛选提供实验平台。
参考文献:
[1] Montes M, Sanford BL, Comiskey DF, Chandler DS. RNA splicing and disease: animal models to therapies. Trends Genet. 2019;35(1):68-87. https://doi.org/10.1016/j.tig.2018.10.002
[2] Lim KH, Ferraris L, Filloux ME, Raphael BJ, Fairbrother WG. Using positional distribution to identify splicing elements and predict pre-mRNA processing defects in human genes. Proc Natl Acad Sci U S A. 2011;108(27):11093-11098. https://doi.org/10.1073/pnas.1101135108
[3] Zhang S, Zhang F, Chen Q, Wan C, Xiong J, Xu J. CRISPR/Cas9-mediated knockout of NSD1 suppresses the hepatocellular carcinoma development via the NSD1/H3/Wnt10b signaling pathway. J Exp Clin Cancer Res. 2019;38:467. https://doi.org/10.1186/s13046-019-1462-y










