iPSC基因编辑过程状况百出?这些实践中屡试不爽的方法分享给你!


iPSC培养、iPSC单克隆形成难点
iPSC基因敲除/点突变/敲入效率低的原因
iPSC基因编辑过程状况百出?这些实践中屡试不爽的方法分享给你!
8月份小源给大家介绍了iPSC在CRISPR/Cas9技术加持下,广泛应用于疾病建模、药物筛选和基因治疗的相关案例(图1),没有看过的小伙伴可以点击回顾原文>>当iPSC与CRISPR/Cas9完美相遇,会碰撞出哪些火花?)。文章发布后,收到不少粉丝的咨询,比如自己想要构建iPS基因编辑细胞,但是感觉困难重重,光是细胞培养就耗费了九牛二虎之力,单克隆制备也是尝尽各种方法才获得寥寥数几,更不用说千辛万苦养大的克隆做完基因型鉴定才发现没有阳性,真是欲哭无泪……
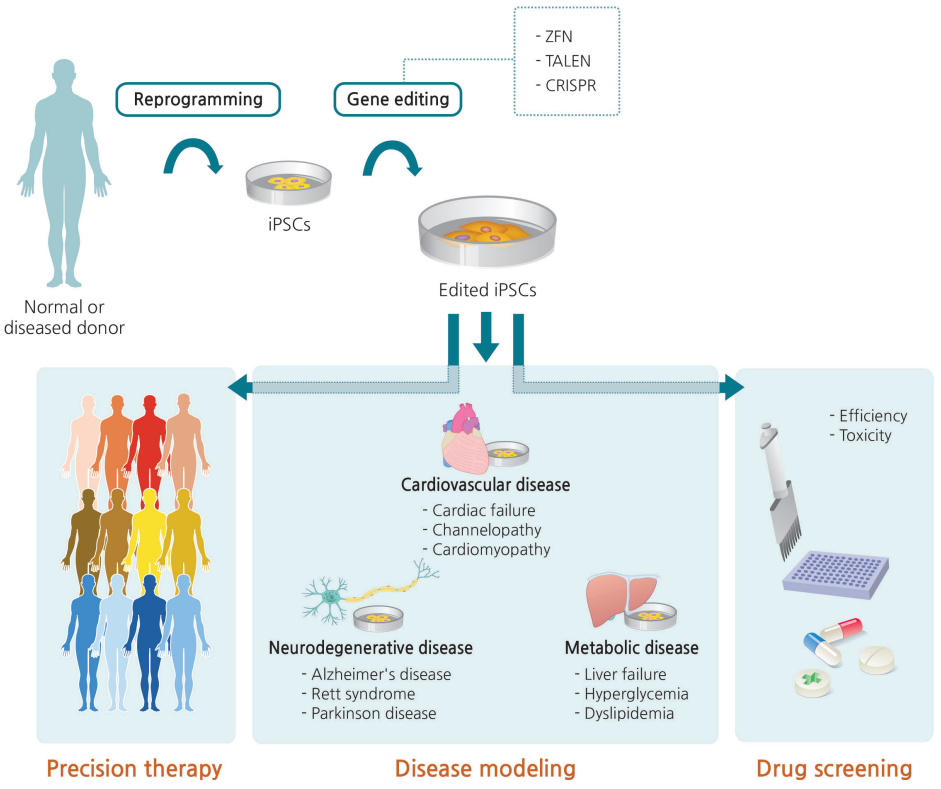
图1、可编辑的诱导多能干细胞(iPSC)及其临床应用
作为也曾在实验室奋战到凌晨2点的生物科研汪,小源真是太了解这种感受了,这不快马加鞭地整理了iPS细胞基因编辑难点与如何提升效率的方法分享给大家,希望可以帮到大家。
iPS细胞培养难
1)iPS细胞活力较差,容易分化而失去干性;
iPS细胞比较娇贵,不能像肿瘤细胞一样“散养”,以下是维持细胞活力和干性的一些技巧:最基础的问题是培养基和基质的选择,在这一点上必须选择高质量的试剂以确保能提供足够的营养和舒适的生长环境。复苏时使用的培养体系建议与冻存前一致,如果考虑更换培养基或基质替代品,则只能在传代期间进行更换,且需要给细胞一些时间来适应。再者,不同于其他可以两三天更换一次培养基的细胞,iPS细胞需要每天更换新鲜的培养基,并及时传代以免集落生长过大或相互接触导致细胞活性差、易分化,传代时也要注意细胞不能被酶过度消化。不仅如此,iPS细胞的培养还需要不断的关注与呵护,这包括但不限于每天在相差显微镜(4x、10x、20x和40x放大倍数)下观察iPSC细胞系,监测iPSC集落形态、是否出现分化以及汇合度(图2)。iPSC理想的集落应该是内部紧实、大小均匀且边缘清晰,如果边缘出现少量分化细胞,应及时干预以维持iPSC的多能性及对数期生长。

图2. iPSC集落评分与不同分化水平(来源:sigmaaldrich)
2)单克隆制备复杂,克隆形成率较低。
单克隆生长与扩增是获得阳性克隆的关键阶段,此过程本身既耗时又费力,如果单克隆形成率低,工作量又是翻倍。铺克隆前的细胞状态非常重要,细胞状态越好,单克隆形成率越高。此外,iPS被消化为单个细胞后容易凋亡,必须添加合适的凋亡抑制剂才能让单克隆更好的生长。
针对这一需求,源井生物研发了EZ-Stem 干细胞完全培养基套装,该套装不仅适用于iPS细胞的常规培养,更适用于基因编辑iPS细胞培养及铺单克隆前的状态调整,充分保护iPS单细胞,显著提升单克隆形成率。
iPS细胞基因编辑效率低
1)方案设计与转染率
iPS基因编辑项目的成功与否,CRISPR/Cas9方案设计至关重要,对敲除项目而言,敲除大小的选择、sgRNA的特异性和切割效率都影响着项目的阳性率,而对点突变或基因敲入而言,还需要优先考虑切割位置与突变位置/敲入位置的距离、PAM位置的同义突变引入和Donor同源臂的设计和修饰等,一套好的编辑方案是项目成功开展的基础。另外,不同个体和组织来源的iPS差异较大,转染方法和参数都可能不一样,需要针对每一株iPS进行预实验,优化转染条件,提高转染率,转染率的提升也可以大大增加基因编辑成功率。
2) HDR效率
相比敲除,iPSC在点突变和基因敲入时更难以编辑,主要原因在于:与永生细胞系相比,iPSC细胞中定向同源重组修复(HDR) 的效率低[1]。而HDR是外源供体DNA用于修复CRISPR诱导的双链断裂的主要方法。为了克服低HDR效率,研究人员采用了几种策略,例如:在CRISPR质粒或供体DNA上加入抗性基因,这种方法虽然有效但会将外源DNA插入到基因组中[2];将阳性选择标记基因与允许切除可选择标记基因(例如 Cre/lox 系统或PiggyBAC转座子系统)相结合可以提高HDR效率,但其构建周期也显著延长[3];单链寡核苷酸(ssODN)供体分子的方法虽然避免了较大的双链DNA分子存在随机整合的问题,但依然受到受到修复成功率低和双链断裂位点周围的序列错乱的问题[4];还有使用已知的细胞周期化学抑制剂同步细胞周期以达到Cas9 RNP复合物定时投送的目的[5]以及使用小分子化合物抑制非同源末端直接连接(NNHEJ)等方法。其中,添加NHEJ抑制剂的操作比较方便,效率提升也比较明显,是比较常用的改进方法。
3)基因型分析
前面提到iPSC单克隆制备的工作量非常庞大,那么在进行单克隆铺板前,应该对pool细胞进行严格的质量控制,确保pool细胞水平有效果后再进行单克隆操作。源井GAS基因型分析系统,可以用于pool基因型分析,确认编辑效率,指导是否铺板以及需铺板的数量,还可以实现单克隆基因型读取高通量自动化,自动筛选阳性克隆,节省大量的人工。
案例:在ipsc细胞中用RNP的方法对APP基因进行c.G2149T点突变,转染后先检测pool重组效率,根据sanger测序结果可以看出gRNA有显著切割效果(图3),根据EZ-editor GAS小工具分析出同源重组基因型占比14%(图4),效率较高,可以进行单克隆铺板。
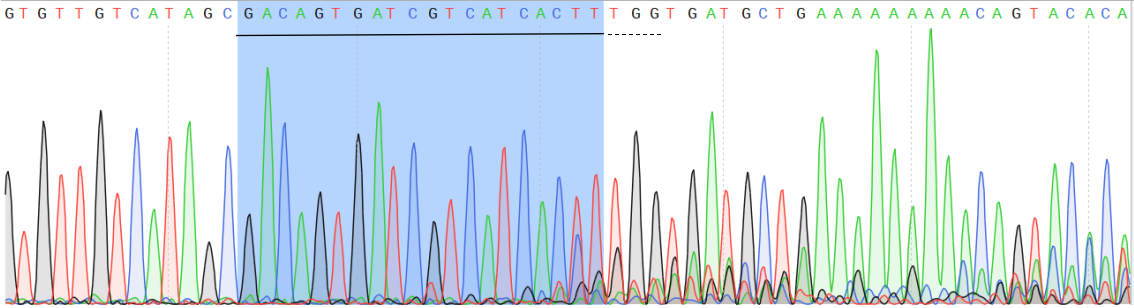
图3.pool细胞sanger测序结果
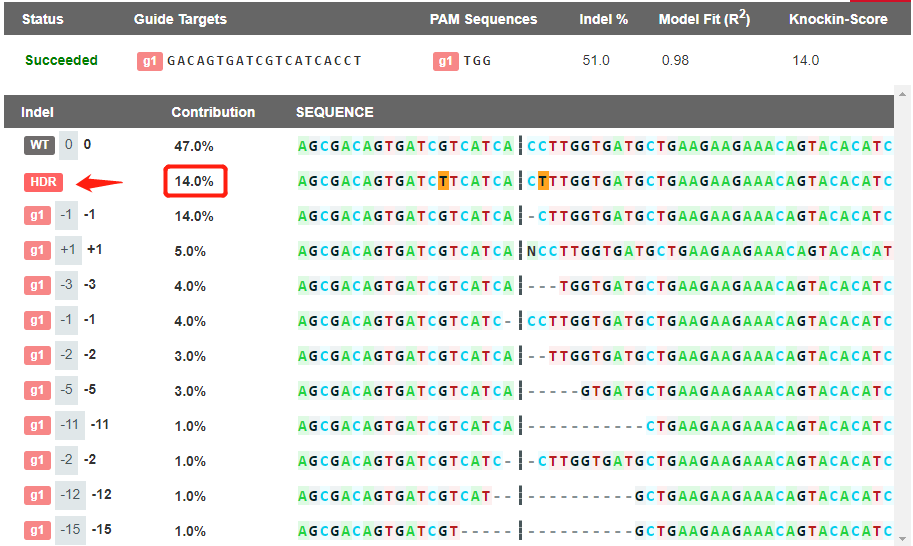
图4.EZ-editor GAS小工具分析出同源重组基因型分析结果
难点和解决方法都给你盘好,请大胆实操吧!
若仍是没有把握,源井生物能为你提供iPS基因编辑/细胞敲除/敲入/点突变定制服务,丰富的iPS细胞基因编辑经验保证交付优质iPSC基因编辑细胞株:精研干细胞相关培养基轻松驾驭iPSC细胞培养,对于不同来源的iPS细胞至少测试3种转染方案确保转染效率,加上独特的EZ-editor™单克隆鉴定技术,可快速实现高通量阳性克隆筛选。
相关推荐:
单克隆鉴定试剂盒>>仅需30-50cells,支持单克隆生长早期基因型鉴定,15分钟处理的样品可直接进行PCR,目的片段扩增长度达10kb!
参考文献:
[1] Hockemeyer D, Jaenisch R. Induced pluripotent stem cells meet genome editing[J]. Cell stem cell, 2016, 18(5): 573-586.
[2] Zhang Y, Schmid B, Nielsen T T, et al. Generation of a human induced pluripotent stem cell line via CRISPR-Cas9 mediated integration of a site-specific homozygous mutation in CHMP2B[J]. Stem cell research, 2016, 17(1): 151-153.
[3] Yusa K, Rashid S T, Strick-Marchand H, et al. Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells[J]. Nature, 2011, 478(7369): 391-394.
[4] Yang L, Guell M, Byrne S, et al. Optimization of scarless human stem cell genome editing[J]. Nucleic acids research, 2013, 41(19): 9049-9061.
[5] Lin S, Staahl B T, Alla R K, et al. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery[J]. elife, 2014, 3: e04766.










