看CRISPR/Cas9基因编辑技术如何玩转药物靶点(一)——GPCR特辑


使用GPRC6A敲除细胞验证前列腺癌拮抗剂潜在靶点
使用GIPR敲除细胞及GLP-1R敲除细胞对GIPR/GLP1R双激动剂的不同受体进行活性验证
使用ADRB2敲除细胞对经典的β2AR靶点进行验证,补充强有力的药理学证据
Amgen' s erenumab, shown in blue. Image courtesy of Amgen.
强光使人闭眼、花香使人愉悦、美食使人垂涎三尺、黑暗使人心跳加速……在人体的深处,细胞的表面,存在着大量能感知外界信号的G蛋白偶联受体(Gprotein-coupled receptor, GPCR),它们参与调节人类生命活动的方方面面。
GPCR是一类具有7次跨膜螺旋的膜蛋白受体,有非常保守的空间结构,其起始端位于细胞膜外侧,而末端位于细胞内侧(图1)。配体与跨膜螺旋组成的“口袋”进行结合,通过跨膜构象的变化,将信息传递到细胞内。配体的性质决定GPCR的状态,起激活作用的配体(激动剂)使受体活化,受体进一步与G蛋白异源三聚体偶联,将配体信号转导进细胞内;而起抑制作用的配体(抑制剂/拮抗剂)使原本活化的受体功能受到抑制。
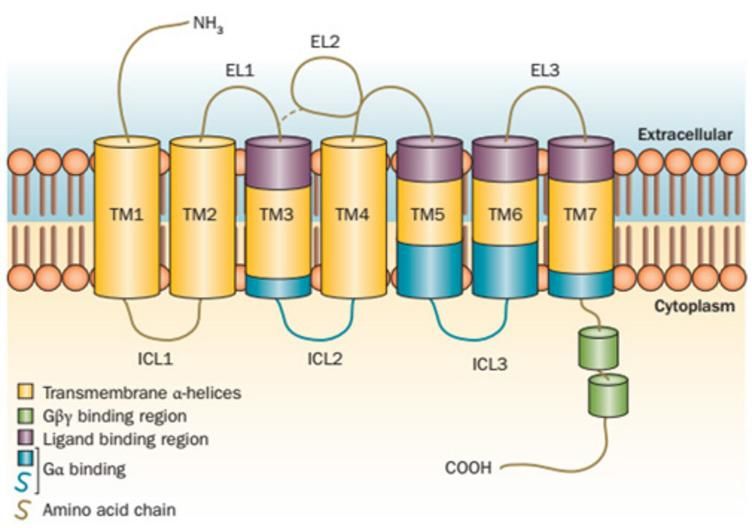
图1.GPCR的7次跨膜结构示意图
在人体内有超过800个GPCR家族成员,GPCR是最重要的现代药物靶点家族,癌症、糖尿病、心脏病、免疫和感染性疾病、神经与精神疾病等疾病都与之相关,属于药物开发领域的“明星”。目前FDA批准的药物中,约1/3是靶向GPCR的,但是涵盖的GPCR靶点只有100多个,除去另外一半负责嗅觉的靶点,还剩下约300个GPCR潜在药物开发靶点。对这些GPCR进行深入研究和筛选,未来有可能开发出更好的靶向药物。2017年nuture上一篇关于GPCR药物研发的长文中提到现成的GPCR药物靶点均被10.3个不同的药物靶向,这意味着已有靶点空间接近饱和,开发新药需要发现新的能够成药的受体。该文前景与展望中都提到,未来GPCR药物研发要解决的关键问题之一是需要改进疾病模型和借助如CRISPR/Cas9基因编辑技术[1]这样的基因编辑系统来进行药物靶标确认(target validation)。作为近年来最炙手可热的基因编辑技术,CRISPR/Cas9与GPCR药物靶点的研究与发展有哪些联系呢?今天小源给大家介绍一些相关的应用案例。
验证GPRC6A是开发前列腺癌拮抗剂的潜在治疗靶点
前列腺癌是最常见的癌症之一,也是美国男性中癌症相关死亡的第二大原因。雄激素去势疗法 (ADT) 是这种疾病的初始治疗方法,但该疾病通常会发展为更具临床侵袭性的去势抵抗性前列腺癌 (CRPC)。因此需要进一步了解CRPC的分子发病机制和确定新的药理学靶点以设计新的前列腺癌治疗方法。GPRC6A 与前列腺癌的发病机制有关,但其作用仍不确定,研究人员通过使用CRISPR/Cas9技术创建的GPRC6A缺陷型PC-3细胞,与野生型PC-3细胞分别在基础水平和配体刺激下细胞的增殖和迁移变化,结果表明敲除了GPRC6A的PC-3细胞中,可以显著抑制ERK、AKT和mTOR信号通路的骨钙素激活,以及抑制体外细胞增殖和迁移。且体内异种移植模型中,GPRC6A敲除的细胞相比野生型PC-3细胞,肿瘤生长明显减小,表明对骨钙素诱导的前列腺癌的生长具有抵抗性。研究结果支持GPRC6A和骨钙素在前列腺癌中的作用,并确定了抑制前列腺癌的潜在治疗靶点[2]。
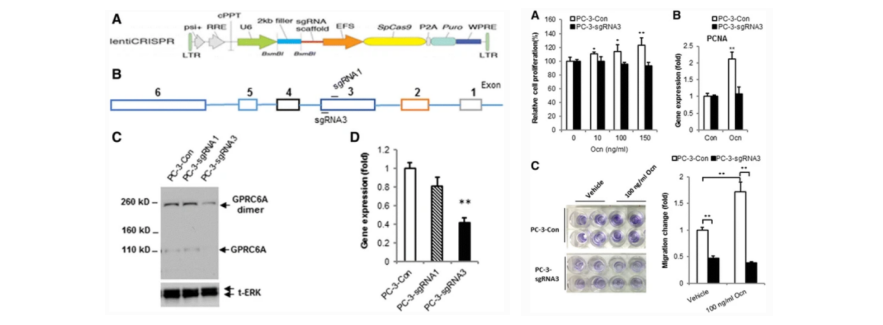
图2.使用CRISPR/Cas9技术在PC-3细胞中敲除GPRC6A基因并检测增殖与迁移能力
ERK、AKT、mOTR在内的25种热门信号通路的KO细胞现货就在源井独家KO细胞库,覆盖上千种基因,低至¥6800,1周交付优质纯合子,点击即可入库搜索>>
通过基因编辑对GIPR/GLP-1R双激动剂的不同受体进行活性验证
在摄入营养物质后,肠内L细胞和K细胞分别分泌胰高血糖素样肽-1 (GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP),这些“肠促胰岛素”通过增加胰腺β细胞的葡萄糖刺激胰岛素分泌(GSIS)降低血糖水平。这就确立了GLP-1R和GIPR这两个受体作为糖尿病治疗的重要药物靶点,研究表明GLP-1和GIP联合使用可以产生有益的效果,但由于两种受体的下游信号通路有重叠,在开发潜在的新疗法时,需要确定双激动剂在每个受体上的相对活性。研究人员通过在INS-1 胰腺β细胞系中,利用CRISPR/Cas9技术分别靶向GIP 受体 (GIPR) 和 GLP-1 受体 (GLP1R) ,成功获得GIPR-KO和GLP1R-KO克隆。并将获得的细胞系用于测试不同双激动剂的活性。双激动剂A在野生型INS-1细胞和GIPR-KO细胞中检测到相当的效力,但在GLP1R-KO细胞中效力低了20倍,表明GLP-1在双激动剂A中贡献更大,双激动剂B的结果则是GIP成分更显著,平衡双激动剂C在体外和体内均参与GLP-1R和GIPR。这是CRISPR/ Cas9技术首次被用于检测体内GLP-1R/GIPR双激动剂活性,不仅如此,该技术还可以应用于β细胞和其他相关细胞系中许多其他共表达靶点[3]的研究。
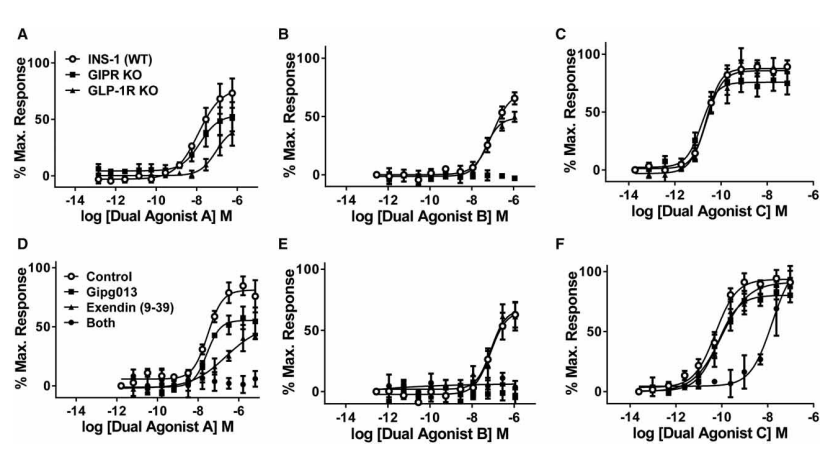
图3.双激动剂肽中GIPR或GLP-1R成分的测定
对经典的β2AR靶点用遗传方法进行验证,补充强有力的药理学证据
β 肾上腺素能受体 (βAR) 是一种G蛋白偶联受体,对于在神经系统和全身中发现的激素/神经递质肾上腺素和去甲肾上腺素的生理反应至关重要,是许多被广泛使用的药物的靶标,其中研究最广泛的是βAR和β2AR,其配体用于哮喘和心血管疾病治疗。βARs通过Gαs G蛋白和通过激活腺苷酸环化酶和 cAMP 依赖性蛋白激酶发出信号,为了给β2AR在Ca2+释放过程的作用补充强有力药理学证据,研究人员在基因层面对其进行了研究。通过CRISPR/Cas9系统创建ADRB2基因缺失的HEK293细胞,用对照载体或表达HA-β2AR的构建体分别转染该敲除系并测试其对ISO的Ca 2+反应,结果表明在不存在β2AR 的情况下,细胞中没有可检测到对ISO 的 Ca 2+响应,在高得多的浓度下仅观察到非常微弱的非特异性反应,转染β2AR的表达质粒可以对其进行挽救[4]。
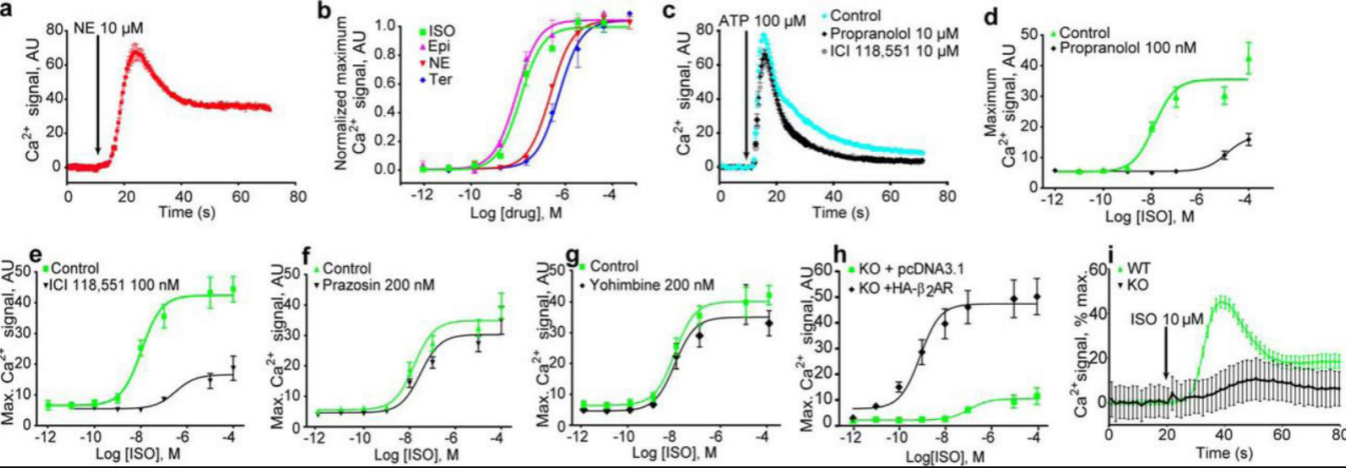
图4.HEK293细胞质中Ca 2+信号测定
基因编辑技术应用于GPCR研究的案例还有很多,比如通过GPCR的sgRNA敲除文库负向筛选促进病毒感染的基因,又如通过CRISPR/Cas9技术在感兴趣的GPCR基因上打上一个标签。Horioka等人[5]在HEK293细胞CXCR4基因N端敲入NLuc的一个片段—LgBiT (an 18-kDa protein),同时在β-arrestin2的C端敲入了NLuc的另一个片段-SmBiT (an 11-amino-acid-residue peptide),两者靠近后可以发出荧光,用于筛选CXCR4的激动剂配体。
GPCR家族仍有许多秘密未被我们探知,在药物靶点研发方面有着巨大潜力,有望为各大疾病治疗提供新希望。而随着CRISPR/Cas9技术的发展,我们可以借助其更快捷地获得细胞模型以研究GPCR、进行药物靶点验证及高通量筛选,加快GPCR开发步伐。
源井生物拥有超100种GPCR-KO现货细胞,可点击此处入库查询>>
同时源井还提供快至4周的KO定制服务、GPCR表达稳转株构建平台及低至¥3.88万的敲入定制服务,为您带来极速优质的构建体验,助力药物靶点高通量筛选!点击进行咨询了解服务详情>>
[1] Hauser A S, Attwood M M, Rask-Andersen M, et al. Trends in GPCR drug discovery: new agents, targets and indications[J]. Nature reviews Drug discovery, 2017, 16(12): 829-842.
[2] Ye R, Pi M, Cox J V, et al. CRISPR/Cas9 targeting of GPRC6A suppresses prostate cancer tumorigenesis in a human xenograft model[J]. Journal of Experimental & Clinical Cancer Research, 2017, 36(1): 1-13.
[3] Naylor J, Suckow A T, Seth A, et al. Use of CRISPR/Cas9-engineered INS-1 pancreatic β cells to define the pharmacology of dual GIPR/GLP-1R agonists[J]. Biochemical Journal, 2016, 473(18): 2881-2891.
[4]Galaz-Montoya M, Wright S J, Rodriguez G J, et al. β2-Adrenergic receptor activation mobilizes intracellular calcium via a non-canonical cAMP-independent signaling pathway[J]. Journal of Biological Chemistry, 2017, 292(24): 9967-9974.
[5]Horioka M, Huber T, Sakmar T P. Playing Tag with Your Favorite GPCR Using CRISPR[J]. Cell Chemical Biology, 2020, 27(6): 642-644.










