【文献解读】源井基因编辑THP-1细胞助力揭密促炎因子CypA作用机制


【文献解读】源井基因编辑THP-1细胞助力揭密促炎因子CypA作用机制
背景
Cyclophilin A(CypA)是一种由PPIA基因编码的在各种组织中广泛存在的肽基脯氨酰顺反异构酶,参与流感病毒复制、抗病毒天然免疫及流感病毒继发的细菌共感染。有报道称,CypA能够通过调控RIG-I/MAVS/NF-κB信号通路和IL-6反式信号通路促进IL-1β等炎症因子的表达,但CypA在炎症的不同阶段发挥怎样的作用仍然未知。孙蕾和刘文军研究员带领团队十多年来对CypA进行了系统性的研究,就CypA在炎症激活、炎症消退以及组织修复过程中的作用及其作用机制进行了深入探讨,并在Cell Reports上,发表了题为“Delicate regulation of IL-1β-mediated inflammation by cyclophilin A”的研究进展。接下来我们就跟着杨文贤博士来看看,促炎因子CypA的研究都用到了哪些材料与方法。

从Ppia-/-小鼠模型确定炎症反应中关键细胞因子
作者从Jackson实验室购买了Ppia-/-小鼠,与野生型小鼠(WT)一起,经过脂多糖(LPS)0、6h、12h、24h、3d、5d、7d的诱导,形成了不同时间点的小鼠肺炎模型。首先通过组织病理学染色实验(图1A),对不同时间点小鼠的肺部切片进行了病理性评分(图1B),同时,对相同时间点的肺干湿质量变化(图1C)和肺指数(图1D)进行统计,发现他们的结果惊人相似,由此说明Ppia编码的CypA在炎症的不同阶段发挥着不同的作用。
由于细胞因子在炎症反应中起着重要作用,为了检测这些细胞因子在炎症模型中的表现情况,作者分别提取了Ppia-/-和WT小鼠肺部、支气管肺泡灌洗液(BALF)、血清中的mRNA,通过qPCR、ELISA以及免疫组化实验,分别检测了肺部细胞因子Il1b(图1E),以及BALF(图1F)、血清(图1G)和肺部(图1H和图1I)的分泌细胞因子IL-1β的表达量,发现WT小鼠不同部位中这两个细胞因子在6h、12h、24h时的表达量均高于Ppia-/-小鼠,而到3d、5d、7d后的表达量出现了反转。除此以外,作者还检测了其他细胞因子在不同部位的表达量。总而言之,所有实验结果表明,在LPS诱导的炎症小鼠模型中,CypA主要通过调节IL-1β的表达量来控制其在炎症不同阶段中的作用。
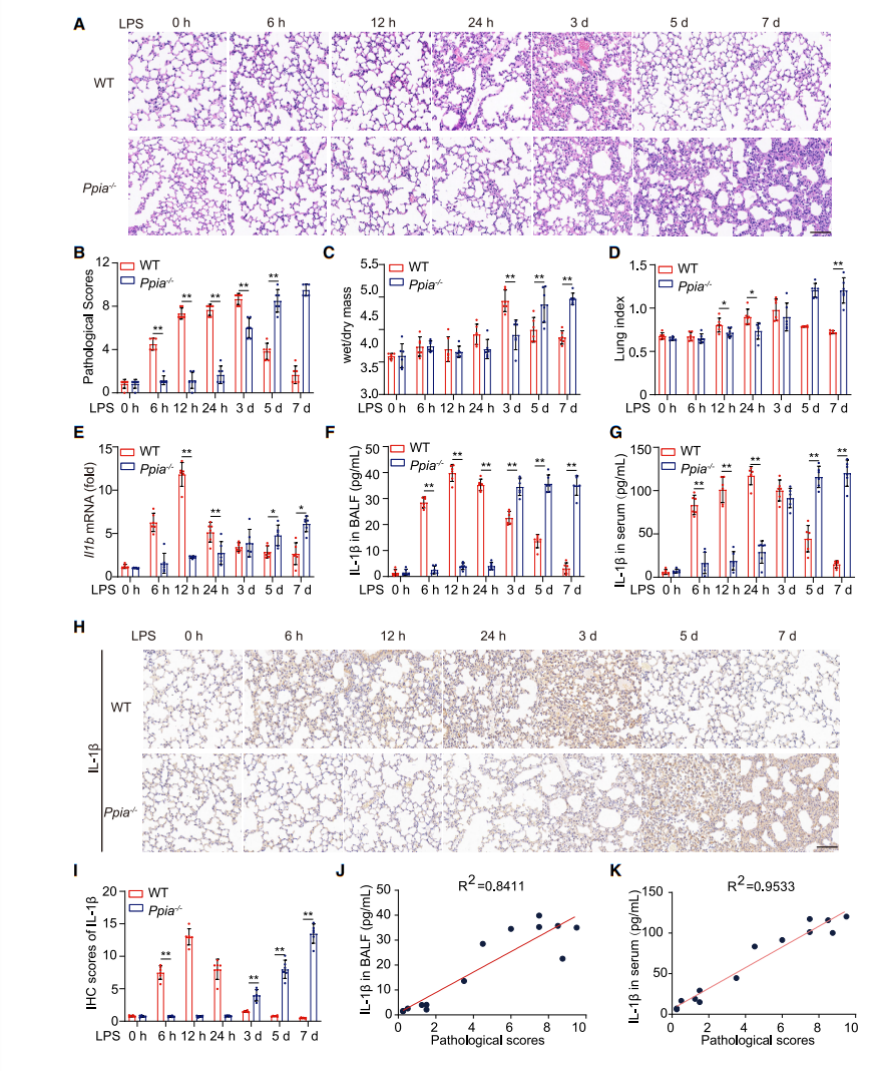
图1
关键细胞因子在肺炎典型细胞系中的机理研究
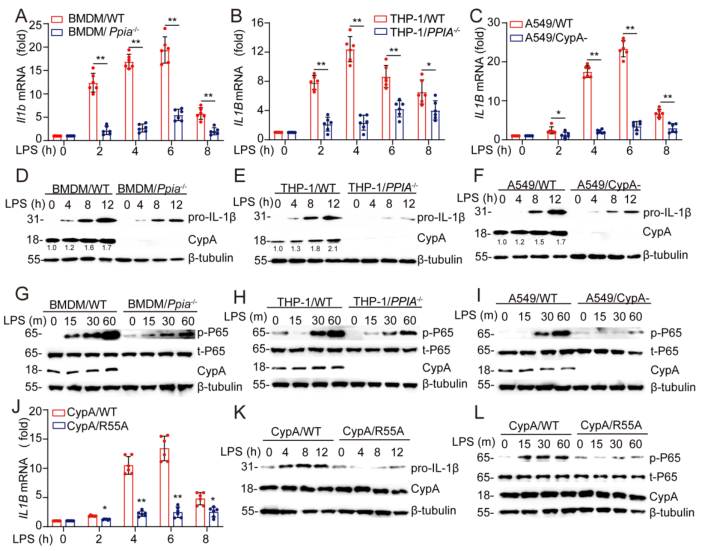
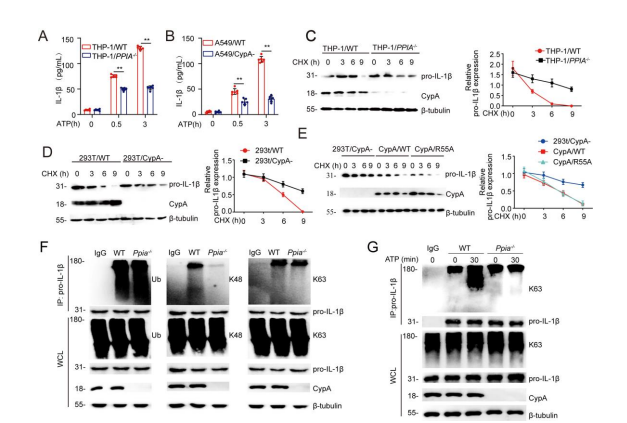
为了进一步确定CypA为什么能在炎症早期促进IL-1β的表达,首先查阅文献可知,CypA可以通过调节NF-κB中的p65来促进促炎细胞因子的产生。这里作者选择了经典的小鼠原代细胞系——骨髓来源巨噬细胞(BMDM),人源非小细胞肺癌细胞系A549和炎症研究的人源经典细胞系THP-1(THP-1/PPIA-/- 细胞由源井提供),通过CRIPR-Cas9、干扰等方法,获得对应的PPIA敲除或敲降的突变细胞系。随后,通过LPS对这些WT和突变细胞系进行处理来模拟肺炎,分别在0、2h、4h、6h、8h检测并比较了在小鼠模型中检测过的细胞因子Il1b或IL1B的mRNA表达量(图S2A-C);又通过免疫印迹,分析了0、4h、8h、12h时CypA、pro-IL-1β的蛋白表达量(图S2D-F),以及0、15min、30min、60min时磷酸化的p65的表达量(图S2G-I)。由此说明,CypA是通过增加p65的磷酸化水平来提高Il1b和IL1B的表达,以及pro-IL-1β的含量。为了进一步确定CypA是怎么促进IL-1β的表达,作者对CypA的PPIase活性功能域进行了突变(R55A),检测了与PPIA敲除细胞系相同的成分(S2J-L),显示出与PPIA敲除时一致的结果,由此说明,在炎症早期阶段,CypA介导的IL-1β表达的增强需要其酶的活性。
THP-1基因编辑细胞作为研究免疫和炎症的典型工具细胞,却时常面临转染难、单克隆生长率低等困难,源井生物历经上百例真实项目摸索总结,对THP-1细胞的基因编辑体系进行针对性优化,大幅提升THP-1的基因编辑成功率。点击查看更多基因编辑细胞服务细节,助您进行疾病的病理生理学研究和高通量药物筛选>>
图S2
根据前人研究结果可知,IL-1β最初是作为一种不活跃的促细胞因子(pro-IL-1β)合成的,一旦二级信号被激活,pro-IL-1β则被NLRP3/ASC/caspase-1炎性小体切割成有活性的IL-1β。因此,作者进一步研究了CypA是否对pro-IL-1β的加工具有影响。首先通过在BMDM/Ppia-/-(图2A)、THP-1/PPIA-/-(图S3A)、A549/CypA-(图S3B)模型中的ELISA实验可知,当ATP刺激炎症小体激活时,CypA突变型细胞系中IL-1β的表达是显著低于对应WT细胞系的。
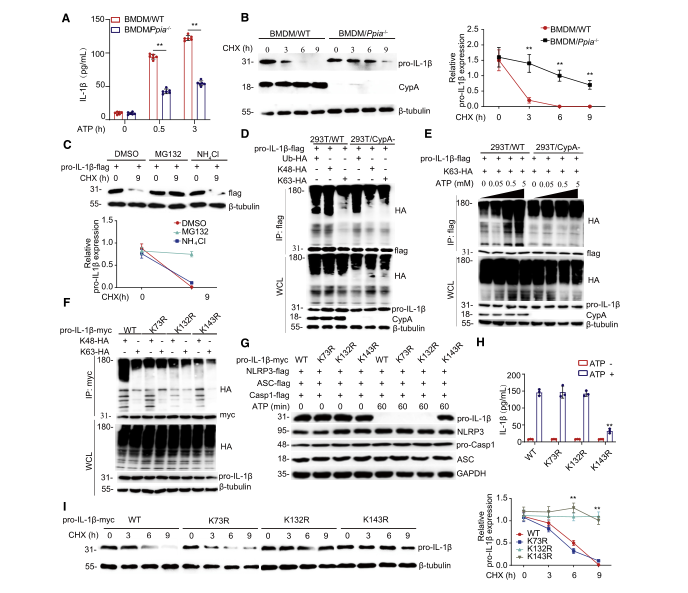
图2
图S3
(2)LPS诱导的炎症消退阶段中,CypA的抑制作用
有报道指出,在没有如ATP的二级信号的刺激下,IL-1β的加工和释放是低效的,且大多数合成的产物都被留在细胞内,要么不被处理,要么被降解。为了探究CypA为什么能在炎症晚期阶段抑制IL-1β的表达,作者随后研究了CypA对pro-IL-1β稳定性的影响。首先还是利用免疫印迹法,直接检测了BMDM/Ppia-/-(图2B)、THP-1/PPIA-/-(图S3C)、293T/CypA-、模型中pro-IL-1β的表达量,结果表明,CypA能加速上述三个WT细胞中内源pro-IL-1β的降解。随后,将带有FLAG标签的pro-IL-1β表达载体转染到293T,并用DMSO、MG132和NH4Cl处理(图2C),比较发现,MG132能促进pro-IL-1β的降解,由此说明pro-IL-1β的降解是由泛素-蛋白酶体途径降解,且这个过程不依赖于CypA的PPIase活性(图S3E)。
(3)CypA影响pro-IL-1β泛素化
有研究报道,K63连接泛素化的pro-IL-1β对炎性小体的激活和IL-1β的分泌具有重要作用。因此,为了验证CypA是否影响pro-IL-1β的泛素化,作者实施了泛素化实验,通过免疫印迹的方法,在293T和BMDM细胞中发现,在没有ATP刺激下,CypA对pro-IL-1β的K48连接泛素化具有显著影响(图2D、图S3F),但当ATP单独作用时,CypA则逐渐增加pro-IL-1β的K63连接泛素化(图2E、图S3G)。
(4)pro-IL-1β关键泛素化位点验证
为了进一步验证pro-IL-1β的关键泛素化位点,通过质谱分析,找到了K73、K132、K143这三个潜在的泛素化位点。免疫印迹实验证明,K73R、K132R和K143R突变导致pro-IL-1β的K48连接泛素化减少,而K132R、K143R突变导致pro-IL-1β的K63连接泛素化减少(图2F)。仍不能确定哪个才是pro-IL-1β加工的关键泛素化位点。于是作者将NLRP3、ASC和caspase-1与pro-IL-1β的野生型或突变型共转染293T细胞,并用ATP刺激,通过免疫印迹(图2G)和ELISA(图2H)实验发现,K143R突变会阻止pro-IL-1β剪切成活性的IL-1β,从而判断K143是pro-IL-1β加工的关键位点。随后再次通过免疫印迹检测转染了编码野生型pro-IL-1b-myc及其不同突变基因载体的293T(图2I),发现K132和K143是pro-IL-1β降解的关键位点。
综上所述,这些数据表明,在炎症激活期,有高浓度ATP的刺激下,CypA主要通过增强K143位点的K63连接泛素化来促进pro-IL-1β的加工;而在炎症缓解期,低浓度ATP环境下,CypA主要通过促进pro-IL-1β在K132和K143位点处K48泛素化来加速pro-IL-1β的降解。
当然,作者的研究不止步于此,后续利用类似的方法,通过精心的实验设计与对比,对IL-1β诱导的炎症模型进行了更加系统的研究,揭示了CypA加剧IL-1β诱导的炎症机制,阐明了CypA在IL-1β诱导的II型上皮间质转化(EMT)肺修复中作用,为未来对与炎症相关疾病的治疗提供了更系统的理论基础,及相关靶点筛选的方向。
在作者的研究中我们可以看到,几乎所有的研究方法里都用到了大量的基因敲除细胞系,工欲善其事必先利其器,现成优质的敲除细胞系则是加快研究进展的利器。源井近3000种KO细胞系现货,覆盖8大信号通路和40种疾病,如本文使用的THP-1、A549、293T,可为科学研究提供丰沛的资源和服务,低至8000元,快至1周交付,点击入库搜索KO细胞 >>










