NF-κB究竟“何许人也”?肿瘤治疗的潜力股!


NF-κB究竟“何许人也”?肿瘤治疗的潜力股!

背景
自1986年Sen和Baltimore首次在活化的B细胞中鉴定了与免疫球蛋白增强子结合的新转录因子——NF-κB,此后科研人员对NF-κB的研究不断深入,证明了其对肿瘤细胞的炎症、增殖、存活、凋亡、血管生成、上皮-间质转化、转移、干细胞性、代谢和治疗耐药性等均有影响(图1)。病毒和细胞的感染、坏死细胞的产物、DNA损伤、氧化应激和促炎细胞因子都能快速且短暂的诱导NF-κB。值得注意的是,NF-κB在恶性肿瘤细胞和肿瘤微环境中,具有组成性活性,极少会因为其相关基因的改变而被激活。因此,NF-κB成为一种具有巨大潜力的肿瘤治疗转录因子。下面让我们来认识NF-κB以及其在肿瘤治疗上的进展。
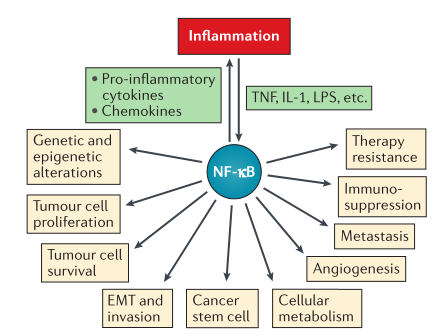
图1 NF-κB在癌症中的作用
NF-κB信号通路
NF-κB是代表一类结构上有相似之处的重要的转录因子家族(Rel蛋白质),这个家族由NF-κB1 (p50),NF-κB2 (p52),RelA (p65), RelB和c-Rel这5个成员组成(图2)。在肺癌中,NF-κB成员的翻译意义均有不同,例如,NF-κB1 (p105)与较长的生存期相关,p52相关基因的高表达与预后不良相关等。NF-κB蛋白通常以与κB家族抑制子(IκB)结合的非活性复合物的形式而存在于细胞质中。而NF-κB的激活主要通过典型(也叫经典型)和非典型(可替代型)两种信号通路发生(图3):典型通路由促炎细胞因子、PAMPs和DAMPs通过特定的受体和适配器分子,如TNF受体(TNFR)、IL1R受体和类toll受体与脂多糖和细菌DNA等配体以及抗原受体结合,通过磷酸化的IκB激酶β(IKKβ),迅速而短暂地激活。随后,磷酸化的IKKβ与异源二聚体p50/p65形成复合物的IκB,招募蛋白酶体,使IκB降解,导致释放效应物p50/ RelA,并使p50/ RelA易位结合到具有κB结合位点的核中来实现其转录活性(图3)。与之相比,依赖NF-κB诱导激酶从头合成的非典型通路的激活则要慢得多,该通路是由属于TNF家族的一小部分细胞因子激活,最后形成p52/RelB异质二聚体(图3)。在细胞内,NF-κB诱导激酶(NIK)在细胞信号转导和调节中起着关键作用。NIK激活导致IkB激酶α(IKKα)的激活,并介导了p100的磷酸化。磷酸化的p100介导泛素化,最后由蛋白酶体推动其降解,产生p52。然后,p52遵照同源二聚体或异源二聚体易位进核,复合物在这里作为一个转录因子。
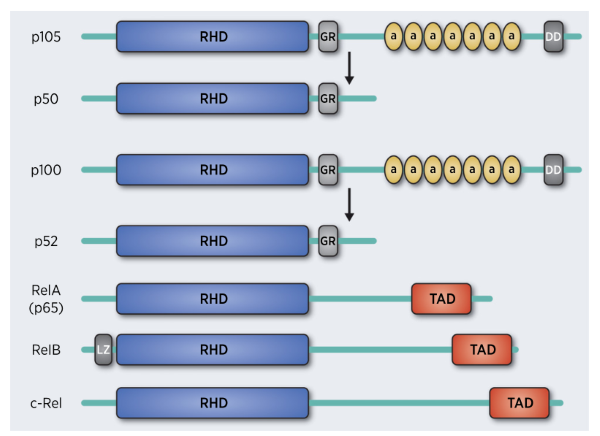
图2 NF-κB家族成员结构图
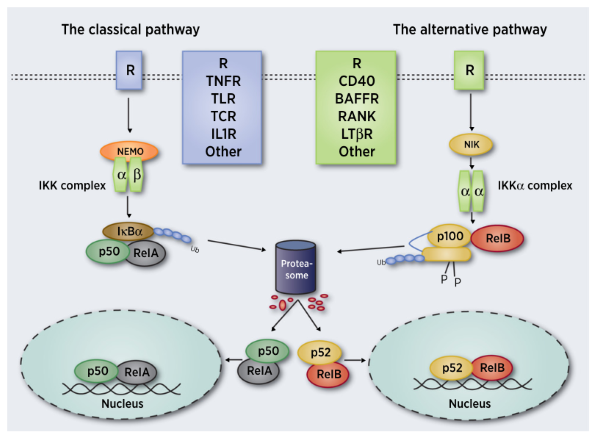
图3 典型和非典型NF-κB信号通路
利用基因敲除细胞系研究NF-κB的具体案例
1. 利用KO细胞系证明TRAF3在RNA和DNA通路中的作用
有相关研究表明肿瘤坏死因子(TNF)受体相关因子3 (TRAF3)在RNA途径中介导IFN的激活中发挥重要作用。从机制上讲,TRAF3与RNA通路中的适配器IPS-1有关,驱动信号激活到TBK1-IRF3信号轴。Kislay等从其他研究者那里获取到关键敲除细胞系(Traf2−/−、Sting−/−、Chuk−/−、Tbk1−/−、 Birc2−/−Birc3−/−的小鼠胚胎成纤维细胞系(MEF)),通过病毒感染、免疫分析、实时荧光定量、荧光素酶检测、免疫荧光等方法证明了TRAF3作为DNA病毒或DNA物种介导的IFN反应激活的负调节因子,在DNA通路中起着直接相反的作用。TRAF3通过抑制核因子(NF)-κB诱导激酶(NIK,又名MAP3K14),导致DNA通路中IFN活化受损,而RNA通路中IFN反应增强。NIK与DNA通路配体STING结合,通过另一种独立于NF-κB通路的机制增强其活化。总而言之,数据描述了一个独特的信号模块(TRAF3/ NIK),它以一种依赖于信号输入(核酸类型)的方式反向调节相同的信号输出(IFN),揭示了RNA和DNA通路之间的一种新的调控机制,为开发针对特定病毒感染的潜在治疗应用提供了一个概念框架。基因敲除细胞系对于研究细胞调控机制起到了重要作用,源井独家KO细胞库内拥有近2000种细胞现货,包括基因敲除的MEF细胞系和敲除Traf2、Sting、Chuk等基因的各类细胞系,如果您有这些KO细胞的需求,欢迎点此入库挑选>>
2. 利用KO细胞系证明IRF3、NF-κB和STAT通路之间的反馈相互作用对poly(I:C)的类开关反应
Maciej等也是利用MEFs(RelA–/–、Stat1–/–、)和PMEFs(Tlr3–/–)的敲除细胞系,证明了IRF3、NF-κB和STAT通路之间的反馈相互作用导致对病毒类似物poly(I:C)的类开关反应,而不是对细菌LPS的类脉冲反应。Poly(I:C)激活IRF3和NF-κB,这是诱导IFNβ表达的必要条件。自分泌因子IFNβ在第一反应细胞中启动JAK/STAT介导的正反馈稳定核IRF3和NF-κB。与之相反,旁分泌IFNβ通过JAK/STAT介导的正反馈通路上调正反馈成分RIG-I、PKR和OAS1A,进而使第二反应细胞敏感。在这些敏感细胞中,poly(I:C)暴露后的“生存还是死亡”决定期较短——它们迅速产生抗病毒反应并导致细胞凋亡。在细胞群限制病原体传播中,相互关联的正反馈和前馈信号是协调细胞命运决定的关键。
3. 利用KO hESCs研究RelA对人类血管疾病和衰老的调控机制
血管通过血液输送营养物质和氧气至全身,血管的紊乱则会损害血管细胞的功能,从而导致像心肌梗死、动脉粥样硬化和中风这类严重的心血管疾病。血管细胞中组成性NF-κB的激活会导致慢性血管炎症,从而导致多种心血管疾病的发生。为了破解NF-κB对人类血管细胞的调节机制,来指导心血管疾病的治疗,首都医科大学宣武医院国家老年疾病临床研究中心的研究团队,利用CRISPR/Cas9介导的基因编辑技术,获得了敲除RelA和IκBα的人胚胎干细胞(hESCs),并将其分化为各种类型的血管细胞。通过多维表型评估和转录组分析的结果表明,RelA的缺乏通过调节炎症、存活、血管生成、细胞分化和细胞外基质组织在基础条件下的细胞特异性方式来影响血管细胞,且RelA能保护血管细胞对抗凋亡,也调节血管炎症对肿瘤坏死因子α(TNFα)刺激的响应。最后,进一步评估了IκBα敲除的血管细胞中的基因表达模式,证明了IκBα的作用在很大程度上独立于RelA信号通路。
总体而言,NF-κB/RelA在调节人类血管稳态中具有保护作用。而目前,在血管炎症过程中,抑制NF-κB已经为各种心血管疾病的治疗提供了一个很有前途的靶点。且针NF-κB通路的各种抑制剂已经被开发出来,以扩展临床应用的选择。鉴于NF-κB的调控具有细胞类型特异性,证明了通过抑制NF-κB活性的高靶向治疗在血管性炎症疾病治疗中的重要性,同时人体血管转录组的建立对新的治疗靶点的发现具有重要意义。
在以上各项研究中,均离不开CRISPR-Cas9技术构建的KO细胞系。通过定向的KO细胞系不仅能快速验证信号通路中某个基因对疾病治疗的正负影响,还能更直观且深入地揭示信号通路在细胞中的作用机制,为疾病治疗提供指导作用。除此以外,结合二代测序,KO细胞系有利于疾病治疗中新的安全靶点的发现。因此敲除细胞系的快速获取能加快人们对包括NF-κB在内的信号通路的全面认识,从而进一步指导癌症治疗。
为了助力科研人员对各大信号通路的深入研究,源井针对8大热门信号通路包括NF-κB信号通路中的近800种关键基因构建了拥有近2000种KO细胞的基因敲除细胞库,如TRAF3、MAP3K14、RELA基因敲除细胞等,现货低至8000元,仅需一周到手!欢迎点击了解>>
参考文献:
[1]. Dimitrakopoulos, F.D., et al., The Fire Within: NF-κB Involvement in Non–Small Cell Lung Cancer. Cancer Research, 2020. 80(19): p. 4025-4036.
[2]. Parvatiyar, K., et al., A TRAF3-NIK module differentially regulates DNA vs RNA pathways in innate immune signaling. Nat Commun, 2018. 9(1): p. 2770.
[3]. Czerkies, M., et al., Cell fate in antiviral response arises in the crosstalk of IRF, NF-κB and JAK/STAT pathways. Nature Communications, 2018. 9(1).
[4]. Sun, S., The non-canonical NF-κB pathway in immunity and inflammation. Nature Reviews Immunology, 2017. 17(9): p. 545-558.
[5]. Taniguchi, K. and M. Karin, NF-kappaB, inflammation, immunity and cancer: coming of age. Nat Rev Immunol, 2018. 18(5): p. 309-324.
[6]. Wang, P., et al., CRISPR/Cas9-mediated gene knockout reveals a guardian role of NF-κB/RelA in maintaining the homeostasis of human vascular cells. Protein & Cell, 2018. 9(11): p. 945-965.










