293T细胞结合CRISPR技术为众多高难度研究另辟蹊径!

293T细胞结合CRISPR技术为众多高难度研究另辟蹊径!
背景介绍
作为公认的“工具型细胞”,293T细胞可以表达SV40大T抗原,并含有SV40复制起始点与启动子区。许多含有SV40病毒复制起始位点的真核表达载体如pcDNA3.1,可以在293T细胞中复制,因此293T细胞广泛应用于病毒包装。293T细胞也适用于研究外源基因的表达,首先它易被转染,用磷酸钙转染效率可高达50%;其次它的蛋白表达水平高,转染后2-3天用碱性磷酸酶分析可以比较容易地检测到表达的蛋白。另外瞬时转染293T细胞是过表达蛋白并获得细胞内及细胞外(分泌的或膜)蛋白的便捷方式之一。总而言之,我们的老朋友293T细胞已经为大量细胞与分子水平的相关研究提供了巨大帮助,如果你需要购买代次低,活力好的293T细胞,可点此购买 >>
293T细胞的应用
作为一个称职的“工具细胞”,293T细胞的应用十分广泛:慢病毒包装生产及滴度测定,外源基因表达研究,蛋白表达研究,信号通路研究,抗体验证,药物筛选,条件培养基制作等,可以说,293T细胞是许多细胞科研工作者的入门细胞。
CRISPR/Cas9技术在293T细胞中的应用
CRISPR/Cas9技术作为目前大热的基因编辑技术,已经在293T细胞上得到了很好的应用,通过精准的基因编辑构建各类工程细胞系从而用于研究细胞凋亡研究,功能基因组学,信号传导途径,药物研发,药物抗性机制,药物反应和细胞疗法等。源井生物基自主研发的CRISPR-U™具有比传统CRISPR/Cas9技术高出10-20倍的基因编辑效率,并能大幅提高同源重组效率,这为293T细胞的基因组编辑提供了一个有力工具。
目前,源井生物已成功构建了大量293T基因敲除细胞株,现货购买低至8000元;并且我们计划在293T细胞上构建仅900种基因敲除细胞,这些基因都来自8大热门信号通路,具有较高的研究价值,如果你对此感兴趣,欢迎点击了解更多 >>
CRISPR/Cas9技术在293T细胞中的具体案例
293T细胞助力研究PLAC8基因对KC细胞增殖和迁移的影响
癌基因胎盘特异性8(PLAC8)在细胞过程和人类疾病扮演着重要的角色,但对于PLAC8如何影响人肾癌(KC)细胞增殖和迁移的研究并不多。 因此Qin等人选择293T细胞作为研究对象,研究PLAC8对293T细胞增殖和迁移产生的影响。首先他们通过CRISPR/Cas9建立了两株PLAC8敲除(KO)293T细胞系,为了对293T细胞增殖和迁移过程中的PLAC8特征进行分类,他们通过细胞计数、集落形成实验(细胞增殖活性)、细胞周期,划痕实验和迁移试验等表型实验(源井生物可提供各类表型实验服务),以及Westernblot对其分子机制进行了研究。结果表明,敲除PLAC8可抑制293T细胞增殖。此外,PLAC8-KO对293T细胞增殖的抑制作用与细胞周期中的G2/M相关,同时PLAC8-KO显著抑制细胞周期蛋白B1和升高细胞周期蛋白a。这说明PLAC8在293T细胞增殖和迁移中起着重要的作用,并为进一步研究PLAC8对人KC细胞的作用提供了重要的研究依据[2]。
293T细胞助力构建重组蛋白生产量化模型
293T细胞表达外源基因的能力是有目共睹的,已被认为是生产表达特定蛋白质产物的强大工具,并被广泛用于生产多种重组蛋白。然而,构建的工程细胞系的重组蛋白产量往往不一致,并且难以量化。Lo等人使用 CRISPR/Cas9 将人核糖体蛋白 L13A ( RPL13A ) 敲入到特定位点(图3),这样转基因表达由内源性启动子驱动,以确保重组蛋白的一致和可预测的表达。还可通过从具有所需表达水平的基因中选择启动子来预先确定表达水平。为了量化重组蛋白的表达,蛋白质定量报告基因 (PQR) 被整合在内源基因和外源基因之间,PQR 等摩尔生产内源性蛋白质、重组蛋白质和荧光报告基因,这样就可用细胞的荧光强度量化目标蛋白的表达[3]。源井生物可提供成熟的报告基因敲入服务,限时大促低至3.88万元,还送5000元下游表型代金券,点击了解更多活动优惠 >>
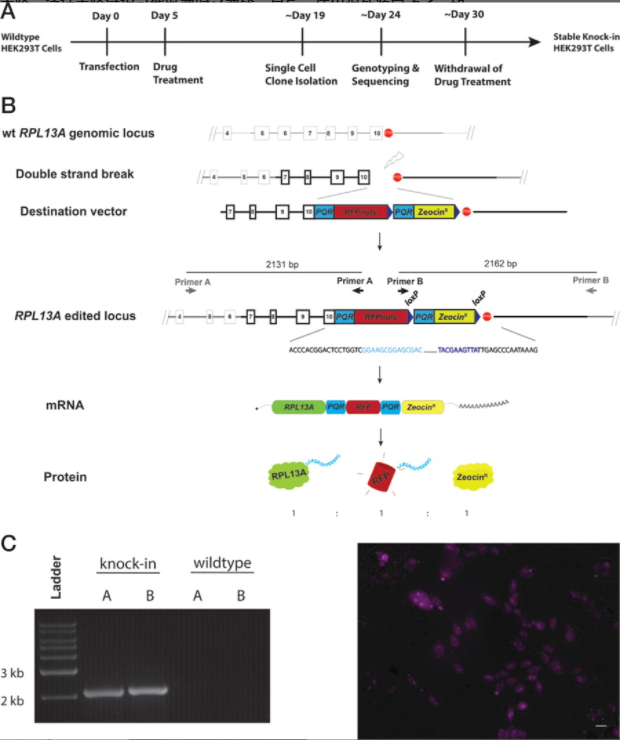
图1 构建RPL13A插入293T 细胞系
293T细胞助力端粒酶活性抑制机制研究
所有持续增殖的细胞,如干细胞和癌细胞,都有一种补偿持续分裂过程中端粒磨损的机制。大多数情况下,这种要求是由端粒酶满足的。体细胞由于缺乏端粒酶活性无法无限分裂,但当细胞中TERT转录的重新激活后就会使它们能够继续分裂,这是肿瘤发生过程中的关键步骤。因此,研究TERT表达对于了解端粒酶活性水平在生理和病理条件下的调节机制具有重要意义。人类TERT基因启动子区域的两个点突变(C-124T和C-146T)在各种癌症类型中高度复发,并且与较高的端粒酶水平相关。 Xi 等人使用 CRISPR/Cas9 修改内源性TERT基因,用定位标签标记内源性 TERT 蛋白或。通过这种方法,他们生成了表达 FLAG-SNAP 标记的 TERT 蛋白的 293T细胞系,从而实现了内源性 TERT 的有效免疫纯化 (IP) 和亚细胞定位。结果表明,端粒酶在任何给定时间内只定位于少数端粒。他们还生成了带有修饰的TERT启动子的HEK 293T 和 SCaBER 细胞,这表明去除C-124T突变足以降低端粒酶水平并缩短端粒。这种方法不仅为研究端粒酶生物学提供了有用的工具,而且还提供了一种通用方法来纯化和可视化低丰度蛋白质,以及在低编辑效率的基因组位点进行单碱基对修饰[4]。
源井生物具有超5000例基因编辑成功经验,能提供优质成熟的基因编辑细胞实验,包括基因敲除、点突变、敲入,以及过表达与干扰稳转株的构建,如有需要,欢迎点击在线咨询!
参考文献
[1] Mucha, Olga, et al. "Pharmacological versus genetic inhibition of heme oxygenase-1–the comparison of metalloporphyrins, shRNA and CRISPR/Cas9 system." Acta Biochimica Polonica 65.2 (2018): 277-286.
[2] Qin, Xu-Hui, et al. "Knockout of the placenta specific 8 gene affects the proliferation and migration of human embryonic kidney 293T cell." Cell biochemistry and biophysics 78.1 (2020): 55-64.
[3] Lo, Chiu-An, Alexander W. Greben, and Brian Edwin Chen. "Generating stable cell lines with quantifiable protein production using CRISPR/Cas9-mediated knock-in." BioTechniques 62.4 (2017): 165-174.
[4] Xi, Linghe, et al. "A novel two-step genome editing strategy with CRISPR-Cas9 provides new insights into telomerase action and TERT gene expression." Genome biology 16.1 (2015): 1-17.










