MC38细胞教你如何“用诺贝尔奖研究诺贝尔奖”


MC38细胞教你如何“用诺贝尔奖研究诺贝尔奖”
背景介绍
MC38 细胞是来自 C57BL/6 小鼠结肠腺癌细胞系,贴壁生长并具有成纤维细胞形态。将MC38 细胞植入C57BL/6 小鼠或免疫功能低下的小鼠后会形成肿瘤和转移,多用作结直肠癌发生及转移方向研究,并成为肿瘤药效验证的常用途径[1]。目前常用到的细胞模型是以慢病毒介导的稳转株模型,以及以CRISPR/Cas9介导的基因编辑模型。源井生物一直致力于稳转细胞株与基因编辑细胞模型的构建,并拥有包括MC38细胞在内的数百种细胞经验,我们已凭借独家技术专利CRISPR-U™向全球范围提供优质的服务,点击可了解更多服务详情与优惠 >>
MC38细胞结合CRISPR/Cas9助力肿瘤免疫治疗研究
作为2020年的诺贝尔奖得主,CRISPR/Cas9技术早已在多个生物与医学领域大放异彩了,而2018年的诺贝尔奖得主”肿瘤免疫疗法“也依旧风采依旧,两者强强联手,为肿瘤治疗带来了更多希望!
验证关键基因,有望发现结肠癌治疗新靶点
唾液酸的糖链结构以其免疫调节能力为肿瘤免疫治疗提供了巨大的帮助,然而异常唾液酸化对结直肠癌的影响仍需要研究。Cornelissen 等人利用CRISPR/Cas9技术敲除MC38细胞中的CMAS基因后发现,与对照MC38-MOCK细胞相比,完全敲除CMAS基因的小鼠结直肠癌MC38细胞(MC38-Sianull)明显地促进了体内肿瘤生长(图2)。MC38 Sianull细胞所导致的肿瘤生长增强可归因于肿瘤微环境中CD8+T细胞频率的降低,而MC38 Sianull细胞能够以非抗原依赖的方式诱导CD8+T细胞凋亡,但是肿瘤引流淋巴结中的免疫细胞频率未受影响。并且在人类结直肠癌细胞中,低CMAS基因表达与无复发生存率降低相关。总之,这些结果表明CMAS基因是唾液酸化途径的关键基因之一,为结肠癌的治疗研究提供了新的研究思路[2]。
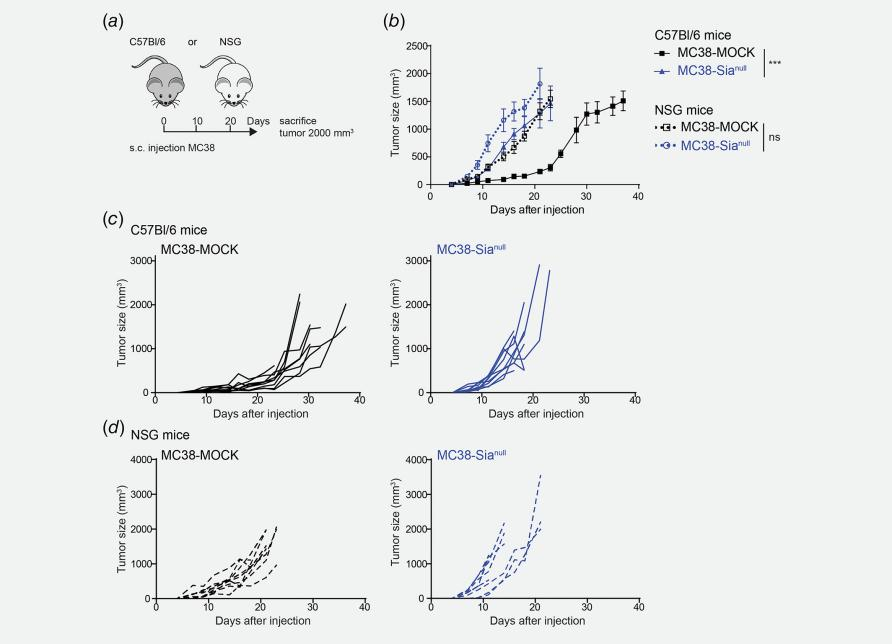
图1 CMAS基因敲除的MC 38细胞与对照MC 38细胞对体内肿瘤生长的不同影响
揭示Tn抗原与免疫抑制肿瘤微环境的关系
众多研究表明,肿瘤相关聚糖Tn抗原(αGalNAc-Ser/Thr)的表达与多种癌症类型的不良预后和转移相关。但关于Tn抗原对免疫抑制肿瘤微环境的作用很少有人研究,因此Lenneke等人探讨了Tn抗原如何影响结直肠癌(CRC)小鼠模型中的肿瘤免疫细胞形成。他们发现CRISPR/Cas9介导的C1galt1c1基因敲除会导致CRC细胞系MC38(MC38-Tnhigh)细胞表面Tn抗原水平升高,并利用RNA测序和Tnhigh糖变体进行的GO-term富集分析揭示了MAPK信号和细胞迁移的差异,以及抗原加工提呈、细胞毒性T细胞反应的差异。结果表明,MC38-Tnhigh肿瘤在体内显示出肿瘤生长增加,这与肿瘤免疫细胞浸润的改变有关,其特征是细胞毒性CD8+T细胞水平降低,髓系来源抑制细胞的积聚增强,但是他们没有观察到T细胞亚群的系统性差异[3]。
hCD47-MC38 HuCELL可以作为人类 SIRPα 抗体体内评估的模型
CD47是一种类Ig膜蛋白,能在所有正常细胞或组织上广泛表达,SIRPα(Signal regulatory proteinα)是SIRP家族中的一个典型的抑制性免疫受体,与 CD47结合后能避免细胞被巨噬细胞吞噬。而狡猾的肿瘤细胞中常出现CD47的高表达,从而躲过免疫系统的防御与清除。Daniel Xianfei等人通过CRISPR/Cas9 技术靶向建立了人CD47和SIRPα 双敲入小鼠模型 (CD47/SIRPα HuGEMM™),还设计了小鼠同基因 MC38 细胞来表达人CD47 (hCD47-MC38 HuCELL™)。他们将 hCD47-MC38 HuCELL 移植到 CD47/SIRPα HuGEMM 小鼠中,以评估抗人 CD47 抗体 Hu5F9 的功效。实验结果表明,hCD47/hSIRPα 双敲入模型以及 hCD47-MC38 HuCELL 提供了一个强大的临床前平台,不仅能有效评估人类特异性抗 CD47 抗体的作用模式和体内功效,还可以作为人类 SIRPα 抗体体内评估的模型,以及与其他免疫检查点抑制剂或免疫调节剂联合治疗的概念验证[4]。
源井生物目前已凭借独家技术CRISPR-U™更高效的切割效率,成功地在包括MC38细胞的数百种细胞中成功建立了各类细胞模型,并成功敲除了超5000种基因,为全球不同地区的科研人员提供了帮助。现在源井生物的细胞基因编辑服务正在进行活动大促,价格优惠,欢迎在线咨询!
参考文献
[1] Zhou, Xiu-Man, et al. "Intrinsic expression of immune checkpoint molecule TIGIT could help tumor growth in vivo by suppressing the function of NK and CD8+T-cells." Frontiers in immunology 9 (2018): 2821.
[2] Cornelissen, Lenneke AM, et al. "Disruption of sialic acid metabolism drives tumor growth by augmenting CD8+ T cell apoptosis." International journal of cancer 144.9 (2019): 2290-2302.
[3] Cornelissen, Lenneke AM, et al. "Tn antigen expression contributes to an immune suppressive microenvironment and drives tumor growth in colorectal cancer." Frontiers in oncology 10 (2020): 1622.
[4] He, Daniel Xianfei, et al. "Anti-human CD47 antibody Hu5F9 inhibits MC38 tumor growth in hCD47/hSIRPα double knock-in mice." (2020): 5615-5615.










