B16-F10细胞搭配基因魔剪——战胜“癌中之王”的终极武器


B16-F10细胞搭配基因魔剪——战胜“癌中之王”的终极武器

背景介绍
小鼠黑色素瘤细胞B16-F10是来源于C57BL/6J小鼠自发性肿瘤细胞,它在显微镜下呈成纤维细胞样,仅需接种少量细胞,便可在数天后形成克隆,由此可见B16-F10细胞的增殖能力很强。另外它还具有侵袭性强,成瘤率高等特点,被认为是 构建肿瘤模型理想的细胞,几乎所有科研人员建立肿瘤模型时会考虑使用B16-F10细胞。近年来,黑色素瘤发病率逐年上升,恶性黑色素瘤(malignant melanoma,MM)是皮肤黑色素细胞来源的恶性肿瘤,具有转移快、预后差、生存期短等特点,据统计晚期黑色素瘤患者平均生存期短于1年,5年生存率低于10%。因此常用于构建小鼠黑色素瘤细胞模型的B16-F10细胞,对黑色素瘤转移和治疗的研究具有重要意义[1]。
源井生物提供适用于各类基因编辑的野生型B16-F10细胞,能更好地构建小鼠黑色素瘤细胞模型,并且我们还提供能稳定表达Luciferase荧光蛋白的B16-F10-Luc细胞用于活体成像等。
B16-F10细胞的具体应用
1.体内追踪和转移
B16-F10 细胞起源于小鼠产生黑色素的上皮细胞,移植后很容易在体内追踪。因此B16-F10细胞成为研究转移途径的有效工具。目前许多项目利用B16-F10 细胞研究细胞对疫苗的免疫反应、miRNA 介导的转移特性,尤其是miR-21(肿瘤抑制因子和抗增殖因子的侵略者)。
2.重要的肿瘤模型
多年来,癌症研究人员通过开发适当且准确的动物疾病模型取得了重大进展,其中最重要的是可移植的啮齿动物肿瘤。在癌症研究中的肿瘤模型中,B16-F10成为了癌症研究的重要的研究模型。
CRISPR/Cas9技术在B16-F10细胞中的应用
CRISPR/Cas9已成为一种强大的工具来改造基因组并激活或抑制基因的表达。因此,在癌症研究中,CRISPR/Cas9 技术是剖析肿瘤发生机制和发现药物开发新靶点的有效工具。黑色素瘤是最具侵袭性的皮肤癌,尽管癌基因靶向药物和免疫检查点抑制剂在提高患者总体生存率方面取得了重大成功,但相关毒性和新出现的耐药性仍是持续的挑战。于是基因疗法成为了一种有吸引力的选择,可以提高目前可用的黑色素瘤疗法的疗效,从而改善患者的预后。研究发现,PTGS2 经常在恶性黑色素瘤中表达,其表达与患者的不良生存率显著相关,因此Ercolano等人采用 CRISPR/Cas9 技术研究前列腺素内过氧化物合酶2 (PTGS2) 在黑色素瘤发生和转移中的作用。他们利用CRISPR/Cas9 技术将B16-F10细胞中的PTGS2敲除,发现PTGS2在黑色素瘤细胞中的表达降低后不仅会抑制B16-F10细胞的增殖、迁移和侵袭,还能通过削弱髓源性抑制细胞分化来调节免疫反应,最终有效抑制了体内肿瘤的发生和转移。这些现象表明了PTGS2可以作为黑色素瘤的靶向治疗基因,对于新的高选择性黑色素瘤治疗药物的开发具有重要意义。[2]
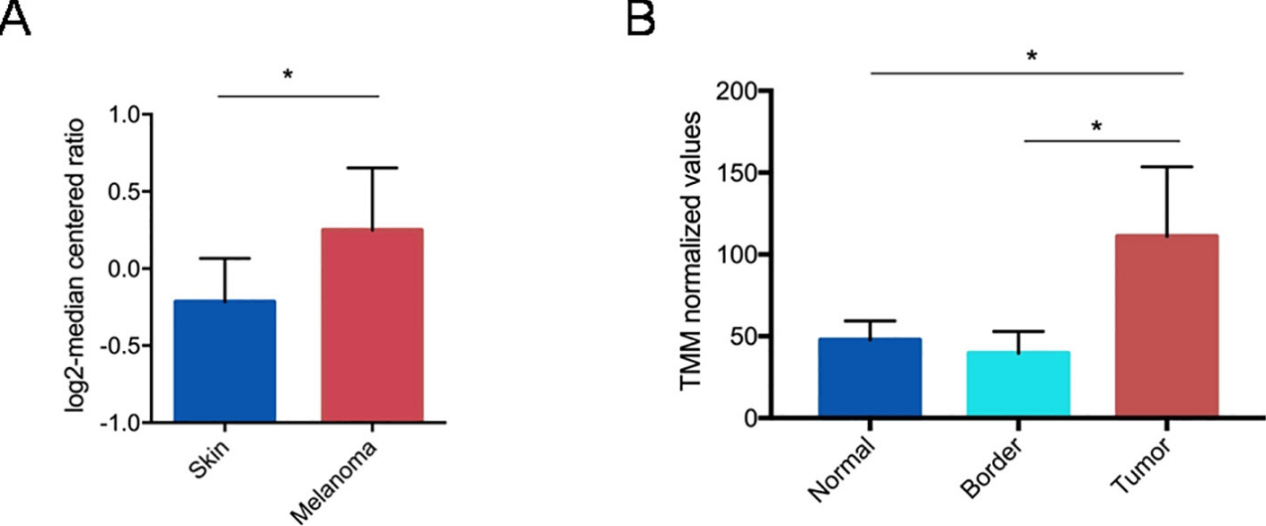
图 1 PTGS2基因的基因表达分析
CRISPR/Cas9技术在B16-F10细胞中的具体案例
1.敲除β2m基因后的B16-F10细胞为可移植肿瘤奠定了基础
适应性免疫系统的T淋巴细胞(T细胞)识别来自内源性细胞蛋白或细胞表面MHC I和MHC II分子呈现的外源性抗原的短肽。由于稳定MHC I/肽复合物的形成严重依赖于与β2m(轻链)的结合,利用CRISPR/Cas9系统敲除小鼠肿瘤细胞系中的β2m基因,β2m表达缺陷将导致其表面MHC分子表达不足。Das等人利用CRISPR/Cas9系统敲除小鼠肿瘤细胞系中的β2m基因,同时通过靶向该细胞系中的IAbβ链编码位点来产生MHC II阴性的B16-F10细胞。研究结果表明,通过CRISPR/Cas9技术产生的MHC I或者MHC II缺陷肿瘤细胞系可作为亲本系,用于在缺乏内源性MHC分子表达的HLA转基因小鼠株中建立MHC兼容的可移植肿瘤模型。[3]
图 2 不同肿瘤实体的稳定β2m-KO克隆的表型
2.缺失JAK1的B16-F10细胞对癌症免疫治疗起着至关重要的作用
癌症免疫疗法, 包括免疫检查点抗体和嵌合抗原受体T细胞疗法虽已在临床上取得了成功,但仍有一小部分患者表现出耐药性。科研人员认为,也许存在某一潜在机制能够有效克服这种耐药性并对于开发更有效的癌症治疗方法至关重要。Han等人通过CRISPR/Cas9技术建立了全基因组敲除B16-F10细胞系,通过体内过继性OT-I T细胞转移和体外OT-I T细胞杀伤试验,确定Janus激酶JAK1缺陷能够介导T细胞耐药性:JAK1的缺失减少了B16-F10细胞中JAK信号转导子和转录信号激活子,导致肿瘤对T细胞效应分子干扰素产生抵抗,并通过损害抗原呈递抑制T细胞活化。这些发现为探索肿瘤免疫治疗耐药性提供了一种新方法,并证明了JAK1是有效治疗黑色素瘤的潜在治疗靶点[4]。
3.点突变后的B16-F10细胞可以精准模拟人类病理
大多数人类遗传疾病源于 G:C>A:T 或 T:A>C:G 碱基变化的点突变,它们代表了近一半的致病性单核苷酸多态性 (SNP)。人类遗传疾病的动物模型在剖析致病机制、药物筛选和药效测试方面具有重要意义,而利用CRISPR/Cas9系统对B16-F10细胞进行基因敲除、点突变等基因编辑实验,能够构建可以精确模拟人类病理的人类疾病模型。
目前源井生物已成功利用独家CRISPR技术——CRISPR-UTM对B16-F10细胞进行了基因编辑,并且我们还成功构建了B16-F10-Luc细胞,能够用于活体成像等实验,如果您需要我们的帮助,欢迎 在线咨询我们!
源井生物,让基因编辑更简单!
参考文献
[1]Gerber SA, Sorensen EW, Sedlacek AL, et al. Local expression of interleukin-2 by B16 melanoma cells results in decreased tumour growth and long-term tumour dormancy [J]. Immunology, 2013, 138(3):280-292.
[2]Ercolano, Giuseppe, et al. "Knockdown of PTGS2 by CRISPR/CAS9 system designates a new potential gene target for melanoma treatment." Frontiers in pharmacology 10 (2019): 1456.
[3]Das, Krishna, et al. "Generation of murine tumor cell lines deficient in MHC molecule surface expression using the CRISPR/Cas9 system." PloS one 12.3 (2017): e0174077.
[4]Han, Ping, et al. "Genome-wide CRISPR screening identifies JAK1 deficiency as a mechanism of T-cell resistance." Frontiers in immunology 10 (2019): 251.
[5]Zheng, Yaowu, et al. "Efficient Single Base Editing in Mouse Using Cytosine Base Editor 4." Authorea Preprints (2019).










