“闪闪惹人爱”的Luc细胞株真的不是花瓶

“闪闪惹人爱”的Luc细胞株真的不是花瓶

荧光素酶细胞系是什么?
荧光素酶(luciferase, Luc)是生物体内催化荧光素(luciferin)或脂肪醛(firefly aldehyde)氧化发光的一类酶的统称,来自于自然界能够发光的生物。荧光素酶在基因表达研究中的应用主要是通过分子生物学克隆技术,通过慢病毒感染后进行药筛,获得稳定表达细胞株,并通过单克隆筛选获得高表达的细胞株。其发光原理为:荧光素酶与荧光素底物在氧、Mg2+存在的环境中消耗ATP发生氧化反应,将部分化学能转变为光能释放。由于没有激发光的非特异性干扰, 因此信噪比高且其组织穿透能力明显强于绿色荧光蛋白(GFP)。
荧光素酶的功能是什么?
1986年就有研究者将萤火虫荧光素酶基因作为测定基因表达的报告基因,由于该方法十分方便快捷、灵敏度强、成功率高,荧光素酶基因作为报告基因得到了广泛的应用,包括启动子活性研究、转录因子研究、哺乳动物细胞双杂交试验、以及活体动物成像实验等方面,对许多科研领域都产生了重要的影响。源井生物也能向科研人员提供Luc稳转细胞株,除了稳定表达荧光素酶基因外,源井生物的Luc稳转细胞株还具有特异性强且高度灵敏、成像质量高、发光强度可精确定量等优点,可以让研究人员十分精准地跟踪自己的细胞。
荧光素酶细胞系的具体应用
1.应用于活体动物体内光学成像实验[1]
例如:表达生物素酶的生物发光成像技术是研究活体动物体内成像的主要方法。通过活体成像技术可快速准确的筛选、鉴定阳性细胞株。阳性细胞克隆数量增多,发光量增强,进而探讨阳性细胞数与生物发光成像系统光通量之间的关系。采用分子克隆方法构建pMX-Luc2质粒,将其与pMD.G质粒共转染293T gag-pol细胞,获得表达Luc2的反转录病毒(见图1)。将该反转录病毒感染小鼠结肠癌CT26、人小细胞肺癌NCI-H446、人结肠癌HT-29、人卵巢癌SKOV3、人肝癌SMMC-7721细胞系,建立并筛选Luc2阳性表达的细胞株(见图2)。分别接种不同数量的细胞于培养皿中,在4只裸鼠的不同部位(背侧皮下或尾静脉)分别接种200μl不同浓度的SKOV3-Luc2细胞。采用生物发光成像系统检测体外、体内接种细胞的光通量值。实验结果表明,采用表达Luc2的反转录病毒感染肿瘤细胞系是快速建立Luc2阳性细胞株的一种可行方法。Luc2阳性细胞数与生物发光成像系统中光通量值具有显著的线性关系。
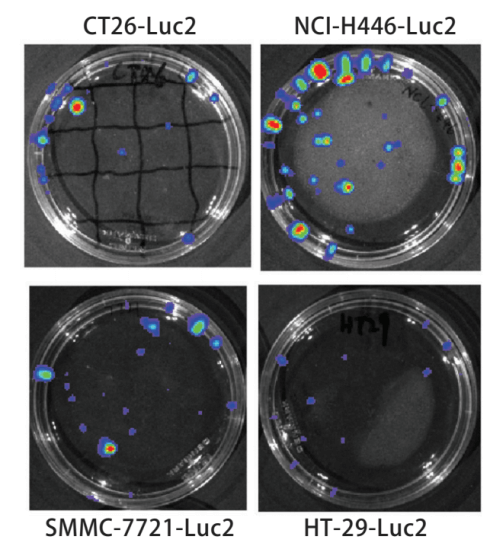
图 1 Luc2阳性细胞株的生物发光检测
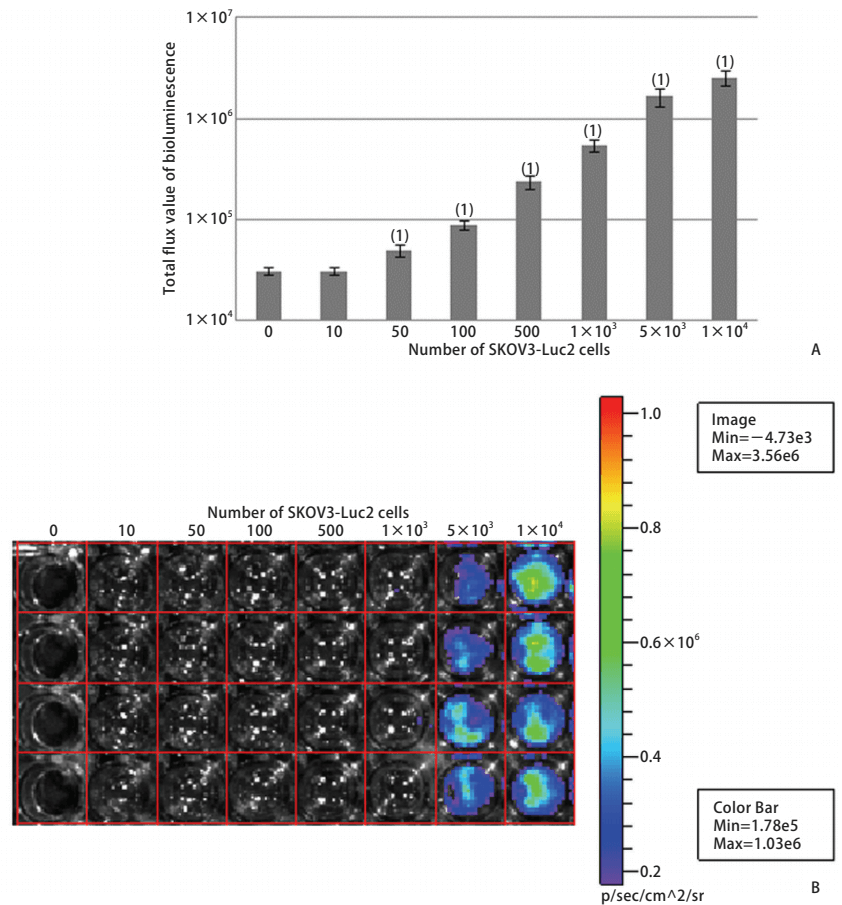
图 2 SKOV3-Luc2细胞中的生物发光光通量值(A)和光通量图(B)
2.验证目的基因与候选基因的关系[2]
例如:为验证FN1(目的基因)与MiR-96-5P(候选基因)的关系,将包含FN1与miR-96-5P结合位点序列克隆至荧光素酶报告载体质粒Psi-check2中。多重比较后发现:与NC组相比,转染100nM miR-96-SP inhibitor显著上调野生型载体转染的细胞的荧光素酶活性,而对于突变型载体,其荧光活性并没有显著变化(见图3)。分析荧光素酶实验结果发现FN1是MiR-96-5P的直接靶基因。
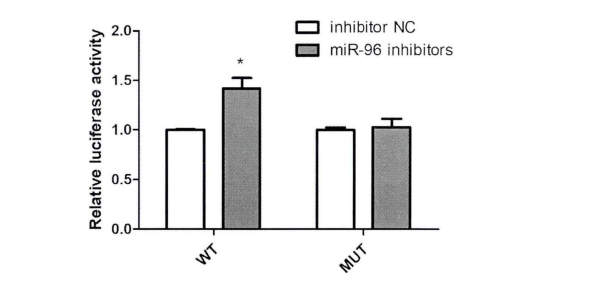
图 3 HK2细胞共转染miR-96-5P inhibitor和野生型/突变型载体后荧光活性的测定
3.应用于病理研究方面[3]
例如:用质粒PGL3-Basic作为载体,将胰岛素2启动子插入其中,构建带有荧光素酶报告基因的质粒,转染入胰岛β细胞MIN6中进行葡萄糖诱导实验,以利用双荧光素酶报告基因系统检测胰岛素分泌情况[见图4]。在应用PGI3-Basic空白质粒代替构建质粒作为空白对照的情况下,荧光素酶的检测值并没有随着不同浓度葡萄糖的诱导发生改变,而是均停留在较低的水平(图4A)说明质粒的转染对试验无影响。使用Renilla luciferase作为内参,以去除试验操作等造成的组间差异,结果表明(见图4 B、C)每组Renilla的表达值大体一致,去除内参值的影响后各试验组的变化趋势与之前相同。
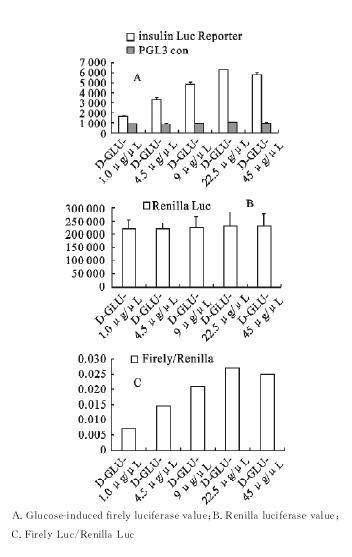
图 4 不同浓度葡萄糖对Luciferase表达情况
4.应用于启动子活性分析[4]
例如:开发并验证了一种单一的分泌性荧光素酶报告器(SSLR)分析方法用于启动子分析。该方法使用与测试启动子相关的分泌性荧光素酶的早期表达水平,作为同一启动子后续分析的内部标准化控制(见图5)。将SSLR分析与使用HMGCR(3-羟基-3-甲基谷糖酰辅酶A还原酶)和LDLR(低密度脂蛋白受体)启动子结构的双荧光素酶报告器(DLR)分析进行比较(见图6),两种方法都得到了相似的结果。比较HMGCR启动子在SSLR瞬态分析中的反应,与同一启动子在稳定细胞系中的反应相比非常有利。
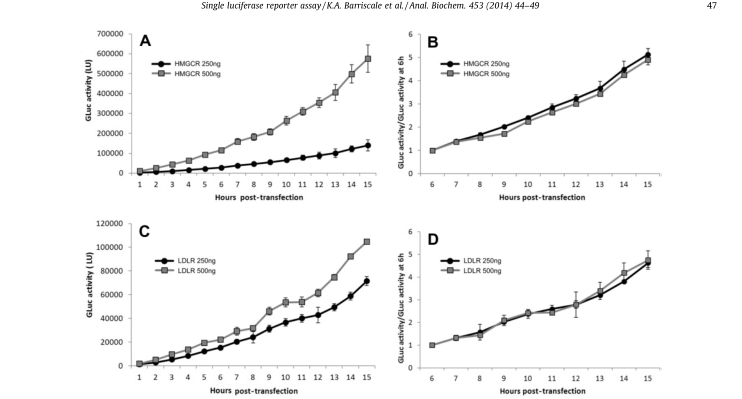
图 5 标准化后每小时荧光素酶活性
注:将分泌的GLuc数据标准化到初始分泌时间点,校正质粒转染效率的差异。用250或500ng的荧光素酶报告器结构将HeLa细胞转染6到9小时。除去转染剂后,每小时测量一次分泌性荧光素酶活性。(A)用250或500ng pGluc-promHMGCR转染后的荧光素酶活性。(B)pGluc-promHMGCR荧光素酶活性标准化至6小时时间点。(C)用250或500ng pGluc-promLDLR转染后的荧光素酶活性。(D)pGluc-promLDLR荧光素酶活性标准化为6小时时间点。
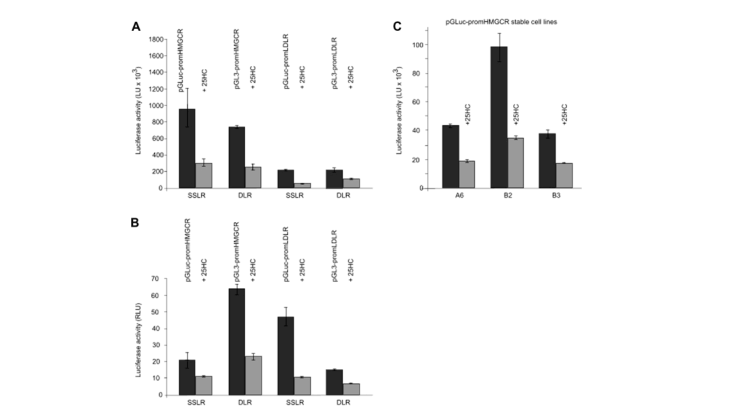
图 6 SSLR分析和DLR分析的比较
注:在±25-OHC的情况下,孵育转染pGLuc-promHMGCR、pGL3-promHMGCR/pRL-TK或pGL3-promLDLR/pRLTK或稳定的pGLuc-promHMGCRHeLa细胞株。对于SSLR分析样本,在25-OHC处理前6小时和25-OHC处理16小时后测量荧光素酶活性。(A)未标准化下,±25-OHC的HMGCR和LDLR启动子活性。(B)±25-OHC的HMGCR和LDLR启动子活性,在6h时标准化为分泌荧光素酶,在DLR试验中标准化为Renilla。(C)在稳定的pGLuc-promHMGCRHeLa细胞株A6、B2和B3中±25-OHC的HMGCR启动子活性。
结论
Luc细胞株在成瘤性实验应用的十分广泛,可以说它所发出的那点微弱的光芒真的能为癌症治愈的漫漫长路驱散一些黑暗。目前,源井生物能提供优质的Luciferase稳转细胞株,均稳定表达Luc荧光素酶,可直接应用于活体细胞注射以检测细胞的成瘤性,还具有特异性强且高度灵敏、成像质量高、发光强度可精确定量等优点,可以让研究人员十分精准地跟踪自己的细胞。
参考文献:
[1] 王海娟等,反转录病毒介导的Luciferase基因稳定转染细胞株的建立及其生物发光成像检测[J],解放军医学杂志,2012,37,2-3.
[2] 王薇等,LncRNA_GAS5吸附miR-96-5P加重糖尿病肾病肾小管间质纤维,[M],南方医科大学,2020.
[3] 康宇佳, 蒙明慧, 吕忠显. PGL3-insulin Luciferase质粒的构建与功能鉴定[J]. 动物医学进展, 2012, 33(004):10-15.
[4] Kathy A, et al.A single secreted luciferase-based gene reporter assay[J],Analytical Biochemistry,2014,453 (2014) 44–49.










