CRISPR技术使青春永驻成为可能


CRISPR技术使青春永驻成为可能
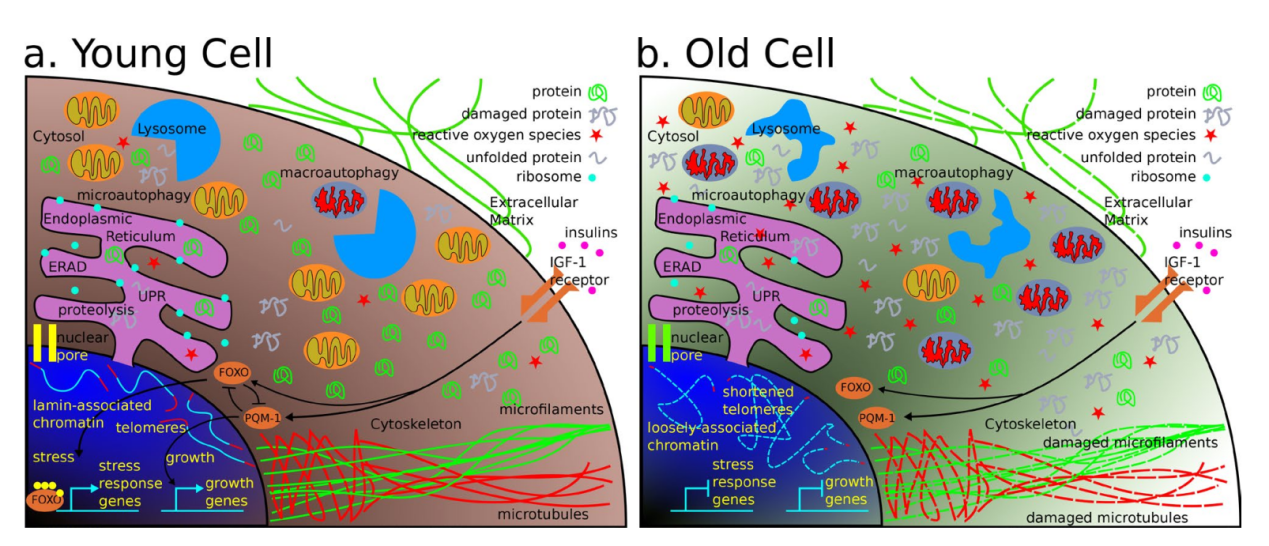
衰老被认为是“与时间有关的生存和生育所必需生理功能的恶化”。因此,科学家们必须找到有效的方法来研究驱使机体衰老的原因。生理衰老的分子本质依旧是十分复杂,目前研究人员无法完全解开其中涉及的过程和基因,也就是说,到目前为止,分子水平的衰老过程还没有得到充分的探索。但是,有九个特征被发现并被称为衰老的潜在标志:1)基因组不稳定,导致遗传损伤的内部和外部因素均可加速衰老;2)端粒磨损,端粒的保护性“帽”在每次细胞分裂时变短,并且随着时间的流逝,细胞失去其分裂能力,从而有引起疾病的可能;3)表观遗传的改变,通过个体的生活经历或影响衰老的环境因素改变基因表达(但不是DNA本身的变化);4)蛋白质稳态的丧失,随着年龄的增长,细胞蛋白质发生了错误的折叠,因此失去其稳态功能(通过衰老或与年龄有关的疾病观察受损的蛋白质);5)失调的营养素感应,特别是代谢调节途径的蛋白质(例如mTOR,sirtuins)会受营养水平和促进衰老的影响;6)线粒体功能障碍促使衰老;7)改变后的细胞间通讯功能障碍导致炎症和组织损伤;8)细胞衰老破坏细胞的清洁过程,“旧”细胞的沉积可能引起不利于健康的影响;最后,9)干细胞衰竭,减少组织细胞的再生,促成衰老。
衰老是身体衰弱的主要诱因,举几个例子,如心脏病,癌症和阿尔茨海默病。尽管仍有许多东西有待发现,但与衰老有关的模式和其联系已被逐渐挖掘出来,这使得针对与年龄相关的疾病的有效干预的抗衰老疗法的需求出现了。现如今,研究人员已经在哺乳动物中发现了几种能延长寿命的基因,将遗传学与衰老相关的损伤联系了起来。如果是涉及到了基因,那么我们就可以利用CRISPR技术进行基因编辑。然而,即使在体内每种细胞类型中编辑单个基因的可能性是存在的,在成人中也很难做到。因此,我们需要确定哪些细胞可以编辑,应该靶向哪些氧化损伤基因。同样,线粒体DNA和基因组DNA的不稳定性也是造成年龄相关损伤的主要原因。这表现为DNA中的小突变,而这些小突变会随着细胞类型的补充和更新,发生并在整个身体中积累。2019年,“自然医学杂志”重点介绍了一种新型CRISPR/Cas9基因组编辑疗法,该疗法可以抑制有Hutchinson-Gilford早衰综合征的小鼠衰老。Hutchinson-Gilford早衰综合征是一种罕见的遗传性疾病,同样也会发生在人类身上。这种治疗方法为衰老所涉及的分子途径以及如何通过基因治疗减少有毒蛋白质提供了重要见解。最近的研究表明,细胞衰老也是衰老和年龄相关病理的驱动因素。衰老细胞的特征不仅在于细胞周期停滞,还在于强效促炎表型,这被认为是驱动衰老和与年龄相关的疾病。消除小鼠中的衰老细胞的结果已经表明可以逆转与年龄相关的病理,表明靶向衰老细胞可以是促进健康衰老的有力策略。
CRISPR/Cas9系统可以显着改善人类的生理健康和寿命。基因组编辑可以为科学家对如何去针对人类衰老的分子驱动因素提供重要的新理解。我们用这种技术能达到效果始终是有限的,因为我们不能重新编辑整个身体,也不能让人们永远地活着。但是,如果我们能够修复身体的一些损耗的部位,这将使我们能够随着年龄的增长享受更优质的生活质量。新开发的CRISPR-Cas9技术不仅可以支持衰老和衰老相关疾病的遗传模型的发展,而且可以加强我们对癌症、帕金森病、亨廷顿舞蹈病等相关疾病发病机制的认识,这些疾病随着人类预期寿命的延长而变得越来越普遍地出现。基于CRISPR-Cas9系统的新型基因组编辑技术以及强大的数据输出可以有助于我们更好地理解衰老的逻辑,并在不久的将来揭开一些衰老的奥秘。
应用:
1. 遗传学和功能基因组学:影响寿命的突变;基因同源性;器官和细胞衰老;基因操作。
2. 信号传导和基因表达:将年龄相关变化与表型和生理学联系起来的机制;细胞内信号传导;细胞和组织之间的相互作用;激素,免疫和炎症系统。
3. 细胞增殖,衰老和死亡:复制衰老;细胞凋亡;端粒生物学和其他内在和外在影响;按时间顺序的细胞衰老;衰老细胞的表型。
4. 细胞应激和损伤:自由基对细胞和组织的外在和内在影响;自由基防御和损伤;自由基作为信号分子;压力和衰老。
5. 干细胞和衰老:年龄对干细胞生成的影响;细胞迁移和体内平衡;干细胞-生态位相互作用;调节机制。
6. 综合生理学:细胞,分子和生物水平老化过程的结果。
7. 潜在的临床应用:改善预防,治疗疾病,更好地了解衰老的病理过程。
8. 药物与衰老:药物发现,筛选,最佳药物治疗。
研究衰老相关的CRISPR-U™基因组编辑
据世界卫生组织称,在生物水平上,衰老是由于随着时间的推移各种分子和细胞损伤积累下来所造成的影响。其中有9个特征被称为衰老的潜在标志,如基因组不稳定,端粒磨损,表观遗传改变和蛋白质稳态丧失等。迄今为止,专门研究衰老的研究人员在哺乳动物中发现了几种延长寿命并将遗传学与衰老相关损伤联系起来的基因。CRISPR-Cas系统是一种革命性的基因组编辑工具,可用于精确的基因组编辑,并可通过用所需donor序列替换掉靶基因序列来进行基因敲除或敲入的基因组编辑操作。基因编辑工具能够纠正由基因介导的年龄相关病理,从而改善或消除疾病症状。使用CRISPR系统删除靶基因或校正基因突变可以改善在老龄化群体中检测到的许多不同的疾病。CRISPR系统靶向的癌细胞可促进癌细胞对化学治疗剂的敏感性增加,增殖降低和癌细胞死亡增加。源井生物开发的CRISPR-U™用于真核细胞系的基因编辑操作。因此,可以利用CRISPR/Cas9系统在许多真核细胞中实现基因组编辑。
案例分析:
通过CRISPR/Cas9研究影响端粒代谢的突变
人CTC1基因的错义突变会导致Coats plus(CP),一种罕见的常染色体隐性遗传疾病,其特征是视网膜毛细血管扩张,颅内钙化,骨质减少和胃肠道出血。人类疾病突变的表征通常会为基本生物学功能提供宝贵的见解。在这项研究中,研究人员调查了CTC1L1142H对端粒代谢的影响,并比较了这种CTC1突变在两种不同细胞类型中的作用,这两种细胞分别是HCT116结肠癌细胞系和端粒酶永生化的视网膜色素上皮(RPE)细胞。他们发现突变体CTC1L1142H与STN1的相互作用较弱,并且CTC1:STN1亚复合物足以抑制端粒酶介导的端粒延长。不能与DNA Pol-α相互作用的CP突变的表达表明,DNA Pol-α介导的C链维持还需要CTC1:STN1来促进这种维持。因此,CST复合物需要协调端粒酶介导的G链延伸和DNA Polα介导的C链合成以维持端粒长度稳态。
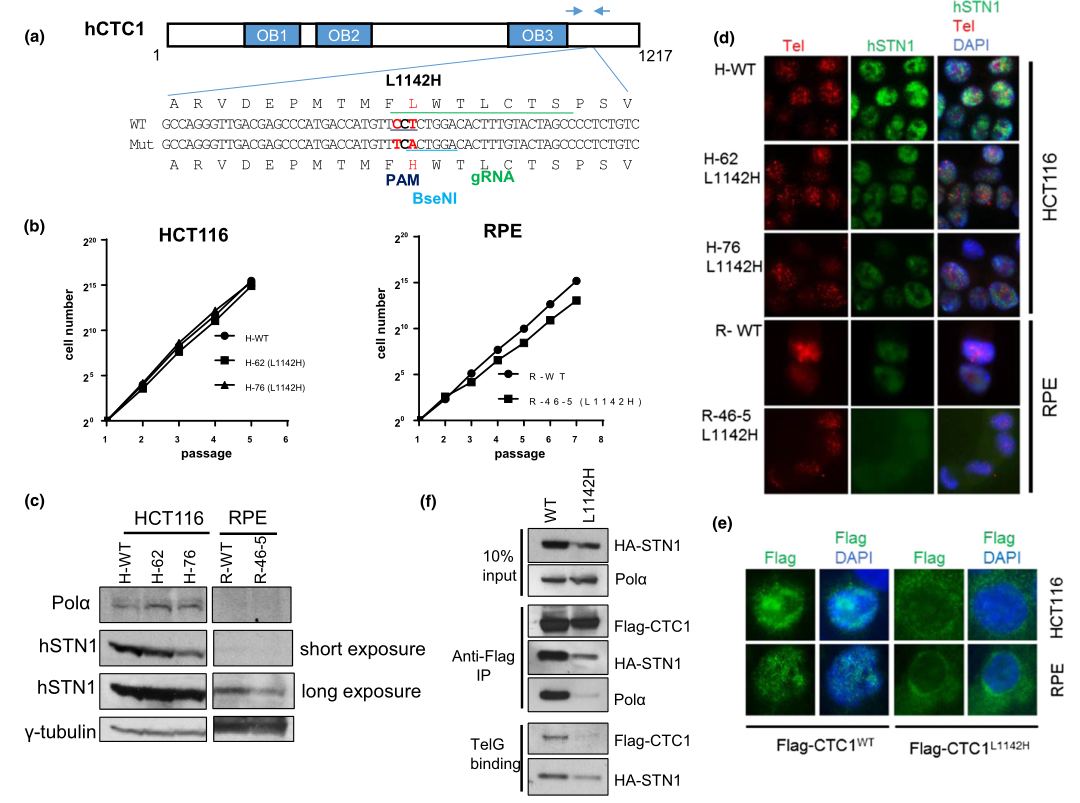
图1: 使用CRISPR/Cas9在HCT116和RPE细胞中产生CTC1 L1142H突变
为了从作用机制上理解CTC1 L1142H突变如何影响CP患者的端粒代谢,研究人员利用CRISPR/Cas9分别在HCT116细胞系和端粒酶永生化的RPE细胞中,将两个等位基因上的CTC1 Leu 1142突变为His 1142 。突变细胞系用于测量野生型或L1142H突变型HCT116或RPE细胞系中的增殖能力,内源性DNA Pol-a和STN1的表达模式,内源性STN1(绿色)和端粒(红色)的免疫FISH分析。他们发现CTC1与STN1复合,负调节端粒长度。尽管CTC1 L1142H突变导致RPE细胞中端粒长度在初期有所增加,但这种增长无法稳定地维持。
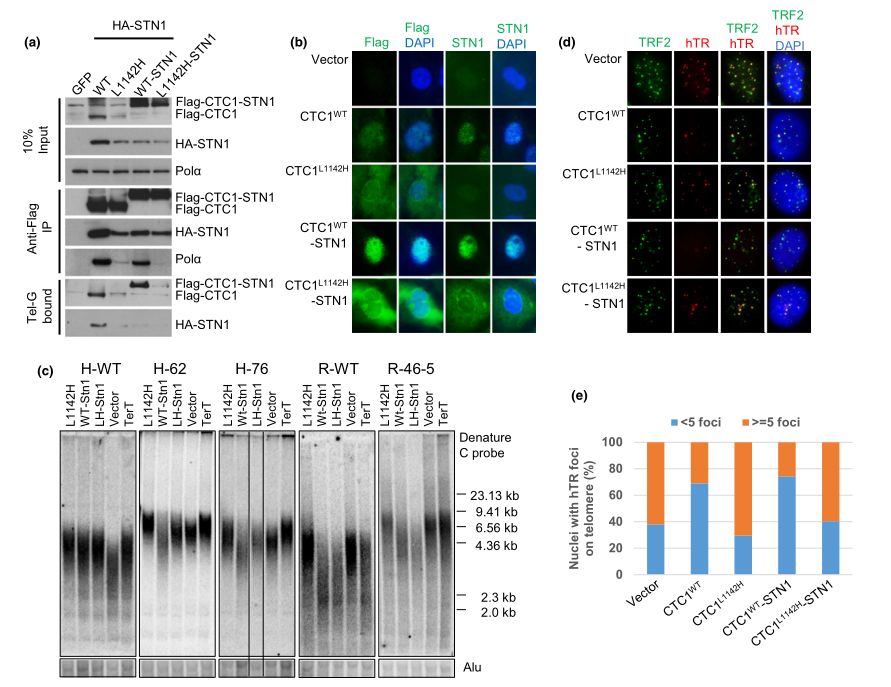
图2: CTC1:STN1复合物抑制端粒酶聚集到端粒
CTC1 L1142H突变体与STN1和DNA Pol-a的相互作用较弱,并且无法结合ss端粒DNA,这表明CTC1,STN1和DNA Pol-a之间的物理相互作用都需要与ss端粒DNA结合。为了验证这一假设,研究人员通过灵活的10个氨基酸的接头将突变体Flag-CTC1 L1142H人工接驳到STN1上以试验是否可以挽救CTC1 L1142H与DNA Pol-a和s s端粒DNA的相互作用。Flag-CTC1 WT-linker-STN1蛋白与DNA Pol-a和ss端粒DNA(图2a)相互作用都很强烈,完全定位在细胞核中(图2b),并在野生型和CTC1 L1142H HCT116和RPE细胞(图2c)中功能性地减少端粒长度。此外,如端粒酶FISH分析所示,Flag-CTC1 WT-liner-STN1构建体的表达减少了端粒酶在端粒上的积累(图2d和e)。他们发现CTC1需要直接与STN1相互作用才能形成CTC1:STN1(C:S)复合体。然后,C:S复合体与DNA Pol-a相互作用,使其能够与ss端粒DNA稳定结合,并且该C:S:DNA Pol-a复合物可抑制端粒酶介导的G链延伸。
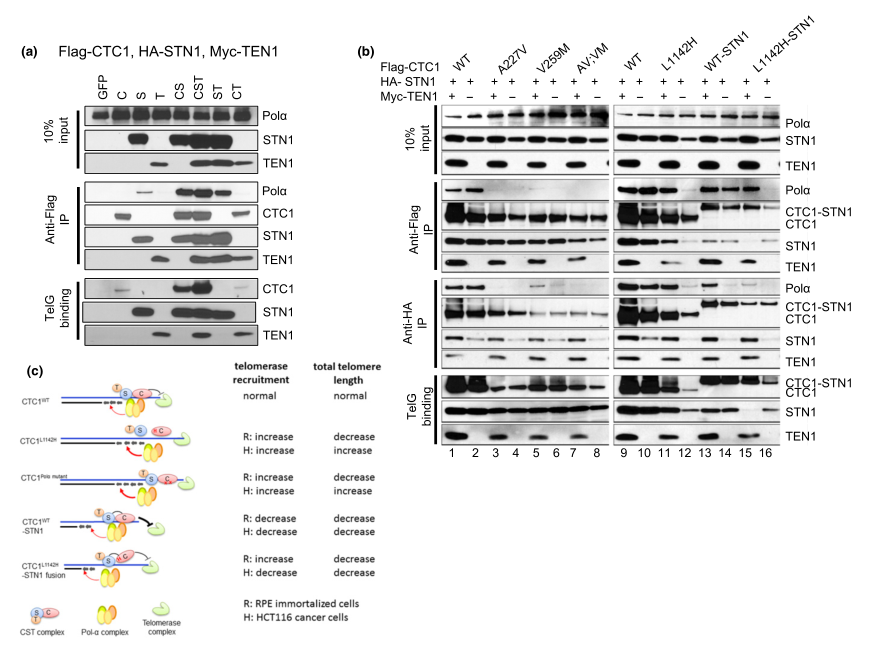
图3: TEN1增强CTC1:STN1的相互作用
为了检查TEN1对DNA Pol-a和ss端粒DNA合成的CST复合物的贡献,他们首先在HEK293T细胞中表达Flag-CTC1,HA-STN1和Myc-TEN1,并通过Co-IP检查它们的相互作用。HA-STN1本身与内源性DNA Pol-a相互作用较弱,但不包括与Flag-CTC1或Myc-TEN1(图3a)。尽管C:S和S:T与DNA Pol-a有着良好的相互作用,但三种C:S:T组分的共表达导致与DNA Pol-a更加强烈的结合。Myc-TEN1的存在增强了Flag-CTC1 L1142H和HA-STN1之间的相互作用,以及Flag-CTC1 L1142H,HA-STN1和DNA Pol-a之间的复合物形成(图3b)。因此,这些功能方面上的证据表明CTC1:STN1是体内抑制端粒酶活性必需的因素。CTC1 L1142H蛋白与STN1的相互作用较弱,部分定位于细胞质,导致了端粒酶介导的端粒延长(图2c)。
总而言之,CTC1 L1142H:STN1:TEN1复合物无法与端粒酶竞争进入3个主要的富含G的突出端。CTC1 L1142H:STN1和DNA Pol-a之间的相互作用减弱导致端粒酶聚集到端粒以及端粒延长,这些发现进一步表明C:S需要与DNA Pol-a结合才能完全抑制端粒酶活性。此外,C:S通过DNA Pol-a调节C链填充。这些发现证实了CST复合物是G链延伸和C链填充反应的主要调节剂。
源井生物开发的CRISPR-U™优化了真核细胞和动物基因编辑载体和过程。效率和准确度比传统方法高10倍。立即联系我们了解与您研究相关的基因编辑服务!
Reference:
A Tandem Guide RNA-Based Strategy for Efficient CRISPR Gene Editing of Cell Populations with Low Heterogeneity of Edited Alleles. CRISPR J.2020;3(2):123-134.










