H1299细胞——研究CRISPR基因治疗癌症突变的理想工具


H1299细胞——研究CRISPR基因治疗癌症突变的理想工具
肺癌是全球癌症相关死亡的主要原因,5年生存率约为6%。其中约80%为非小细胞肺癌(NSCLC)组织学类型,手术切除或根治性放化疗提供了最佳的治愈前景。但许多肺癌患者对目前的治疗手段还是存在抵抗心理的,包括化疗和放疗。然而,绝大多数病例是在晚期诊断出来的,患者的治疗选择是有限的。尽管在研究肺癌,靶向治疗和临床管理方面取得了一定的进展,但许多知识在一些层面上仍有待补充。由于肺癌的遗传多样性和表型多样性,使个体化治疗正在成为现实。因此,这种癌症有可能进一步触发未来精准医学的发展。
非小细胞肺癌(Non-small cell lung cancer, NSCLC)细胞系模型H1299,广泛用于各种基础细胞生物学和生物医学研究,涉及肺癌增殖,相应的抑制剂研究,肿瘤的形成和转移。研究人员使用H1299细胞系作为疾病模型来了解疾病的基本生物学,了解突变如何影响药物反应或耐药性,了解药物反应性、靶标识别、以及验证差异的机制,甚至对患者进行分层,以便进行更高效及有效的临床试验。基因编辑技术正在迅速发展,成为一种现实的治疗选择。有策略地编辑患者基因组的能力可以构成一场治疗革命。基因组编辑技术在肺癌治疗中具有巨大潜力,包括靶向癌基因和肿瘤抑制基因,化疗耐药性相关基因,靶向药物和抑制剂治疗相关基因,以促进针对肺癌的进一步临床前研究和临床治疗。
应用:
H1299细胞系(NCI-H1299或CRL-5803)是从一位43岁的白人男性、非小细胞肺癌患者的肺细胞中建立的,广泛应用于生物医学研究。H1299作为一种永生化细胞系,可以无限地分裂,该细胞系的独特特征是缺乏P53蛋白的表达,这也是它有增殖倾向的原因。据报道,该H1299细胞系分泌肽激素神经介素B(Neuromedin B, NMB),但不分泌胃泌素释放肽(Gastrin-releasing peptide, GRP),可用于研究人类肺癌。此前有研究表明,H1299细胞系可用于研究与肺癌化疗药物如紫杉醇的致敏性和耐药性相关的基因,为提高化疗对肺癌的治疗效果提供了理论依据。
以下是H1299细胞系的一些应用:
1. 靶向治疗:抗血管生成药物,靶向细胞信号传导的药物,生物学机制,毒性特征,其他生物制剂(凡德他尼,索拉非尼等);
2. 药物开发:PI3K抑制剂,MEK抑制剂,EGFR抑制剂等;
3. 分子遗传学:利用基因组畸变,体细胞遗传改变,特定酪氨酸激酶的致癌激活;
4. 表观遗传学:表观遗传调节因子突变,表观遗传治疗等。
利用CRISPR-U™基因编辑H1299细胞系
基因组编辑和细胞模型的建立可以推进功能基因组学、信号通路、细胞代谢、细胞死亡、药物研发、药物反应和癌症研究等领域的研究计划。CRISPR系统是一种精准的基因组编辑技术,它可以通过将目的基因序列替换为所需供体序列来进行基因敲除或敲入的基因组编辑操作。H1299是一种人肺腺癌细胞系模型,主要用于肺癌研究相关的药物发现,疾病机制、起始、进展和治疗。CRISPR系统介导的基因编辑H1299细胞系可以帮助研究人员研究癌症标志,药物抗性机制的公开,癌症治疗,细胞死亡研究,功能基因组学,信号传导途径,药物发现,药物应答和细胞疗法。
CRISPR/Cas9技术积极推动了肺癌相关的体内和体外基因编辑的进展,对分子医学产生了巨大影响。例如,结合紫杉醇的使用,敲除RSF1基因会导致细胞周期停滞在G1阶段,细胞凋亡增加,细胞迁移和增殖减少。此外,敲除H1299细胞中的巢蛋白可促进细胞凋亡,抑制增殖和集落形成,并通过抑制上皮到间质的转化(EMT)来抑制细胞侵袭。源井生物开发的CRISPR-U™可用于基因编辑H1299细胞系。因此,利用CRISPR/Cas9系统可以实现在细胞上进行基因组编辑。源井生物可以定制真核细胞中的基因编辑,也可以在动物模型中产生各种基因修饰。
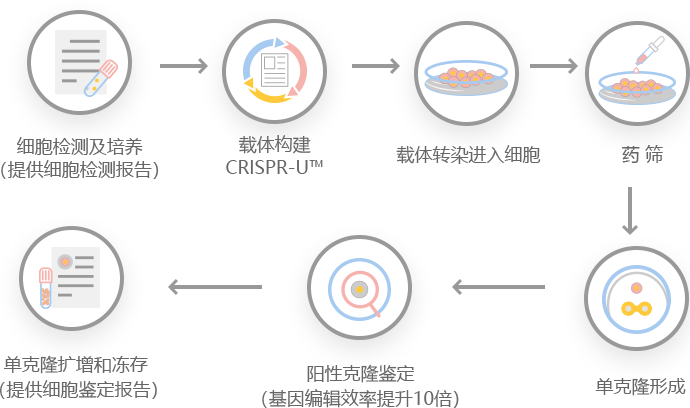
图: CRISPR-U™ 工程H1299细胞模型的工作流程
案例分析:
BCAR1基因敲除细胞系揭露BCAR1通过上调POLR2A促进肺腺癌的增殖和细胞生长
乳腺癌抗雌激素抗性蛋白1(Breast cancer antiestrogen resistance protein 1, BCAR1;Crk相关底物, Crk‐associated substrate, CAS;p130cas)直接与各种磷酸酶和激酶的多个蛋白基序相互作用,并通过FAK桥间接缔合调节Src。据报道,BCAR1可增强几种癌症(前列腺癌,子宫内膜腺癌,口腔鳞状细胞癌,乳腺癌和肺癌)的肿瘤增殖,侵袭和转移。它还能预测到肺腺癌病例的不良预后的情况。
在这项研究中,研究人员探讨了BCAR1在肺腺癌增殖和细胞生长中的作用以及与BCAR1相互作用以触发肺癌细胞增殖的蛋白质网络。研究人员利用CRISPR/Cas9技术在肺腺癌细胞系(NCl-H1975和NCl-H1299)上构建BCAR1基因敲除细胞系,并进行基因敲除细胞的增殖、集落形成、凋亡和细胞周期分析(图1)。他们发现敲除组的BCAR1的表达明显低于对照,及增殖被显着抑制(图1b,c)。H1975细胞的集落形成效率显着降低,但在H1299细胞中BCAR-KO和NC之间无显着差异(图1d)。细胞凋亡或细胞周期进程分析表明,BCAR被敲除后H1975和H1299细胞的凋亡和细胞周期没有差异(图1 e,f)。
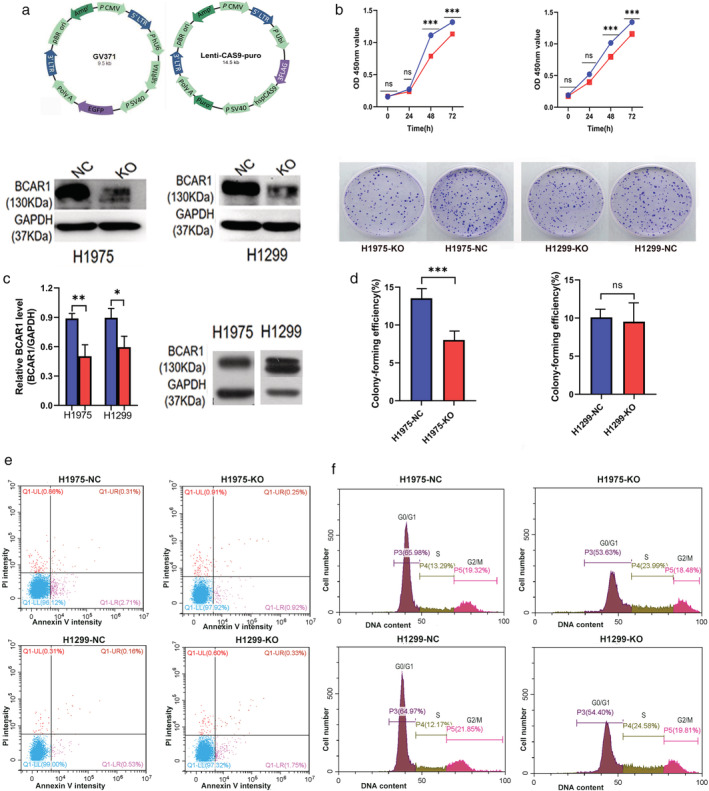
图1: BCAR1敲除后H1975和H1299细胞的细胞增殖,集落形成,凋亡和细胞周期
研究人员在293T细胞系中过表达BCAR1,并进行免疫沉淀-质谱(IP-MS)以及不同的下游分析。IP-MS和生物信息学的分析预测了与BCAR1的潜在相互作用(图2)。生物信息学分析揭示了潜在的BCAR1相互作用蛋白的催化活性和转移酶活性(图2a,b)。癌症基因组图谱(TCGA)数据库的验证证实了过表达BCAR1与癌症相关(图2c)。他们分析了与癌症相关的相互作用伴侣的PPI分析,发现POLR2A,MAPK3,MOV10和XAB2的高表达预示了肺腺癌的不良预后(图2d)。由于他们发现了POLR2A与更多的基因有着联系以及参与信号级联反应的可能性,研究人员认为需要进一步验证POLR2A。
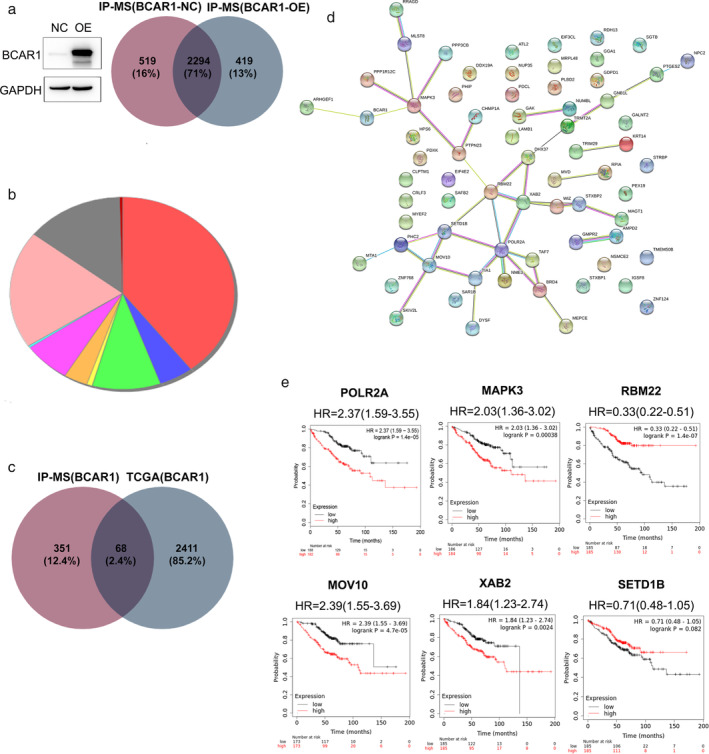
图2: 293细胞系中过表达BCAR1的生物信息学分析
与邻近的正常组织相比,肺腺癌组织中的POLR2A和BCAR1显着增加(图3a)。IHC染色的TMA如图3b所示,表明BCAR1在细胞核、细胞质或两个位置都有表达(图3c)。然而,POLR2A只在细胞核中高表达。POLR2A表达与BCAR1表达有着显着正相关关系(R=0.476,P<0.001),但BCAR1和POLR2A表达均与肿瘤大小无关。BCAR1或POLR2A的高表达预测了54例肺癌早期预后不良(图3d)。研究人员进一步验证了H1975中的POLR2A,并且H1299细胞的敲除克隆和蛋白质印迹分析证明了与NC细胞相比,BCAR1-KO中的POLR2A显着降低(图3e)。尽管CO-IP的结果为阴性,BCAR1调节H1975和H1299细胞中的POLR2A。(图3f)。
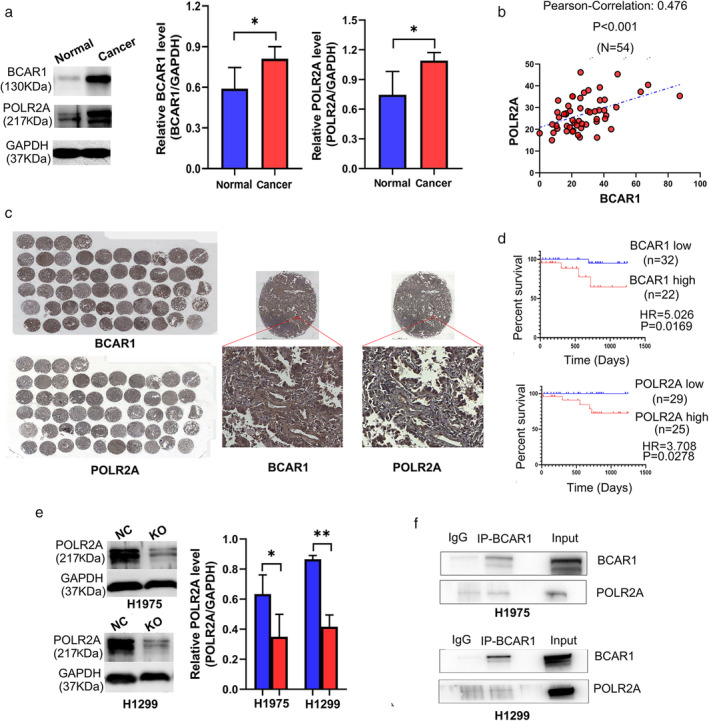
图3: BCAR1和POLR2A之间的关系以及它们在肺腺癌中的预后意义
总结以上发现,研究人员没有发现H1975和H1299细胞中BCAR1和POLR2A之间的直接相互作用。我们仍不清楚BCAR1和POLR2A是如何连接起来的的基本机制。此外,我们还需要协同分析来证明BCAR1和与其相关的蛋白之间相互作用在肺癌增殖和细胞生长中的作用,需要进一步的强有力的研究来解决上述有待思考的问题。
源井生物开发的CRISPR-U™优化了真核细胞和动物基因编辑载体和过程。效率和准确度比传统方法高10倍。立即联系我们了解与您研究相关的基因编辑服务!
Reference::
BCAR1 promotes proliferation and cell growth in lung adenocarcinoma via upregulation of POLR2A.Thorac Cancer. 2020; 11(11): 3326–3336.










