iPSC基因编辑全解析:概念、应用场景与技术优势


iPSC 是一种通过技术手段“改造”而来的特殊干细胞。科学家从人体获取皮肤细胞、血液细胞等普通体细胞,借助基因重编程技术,在特定转录因子(如 Oct4、Sox2、Klf4、c-Myc 等)的作用下,打破体细胞已有的分化程序,让这些高度分化、功能固定的细胞 “逆转时光”,回归到具备无限分化潜力的干细胞状态。通过CRISPR/Cas9的方法,将模拟疾病发生的突变引入iPSC,或修复iPSC疾病模型中的突变, 再分化得到所需要的细胞进行研究或治疗,是目前iPSC研究的大热门。
一、iPSC基因编辑是什么?
iPSC 基因编辑 是指将诱导多能干细胞(iPSC)技术与CRISPR/Cas9基因编辑技术相结合,通过精准修饰 iPSC 的基因组,实现基因敲除、敲入、点突变、修复等目的,再利用 iPSC“无限增殖 + 多向分化” 的特性,将修饰后的 iPSC 诱导分化为特定功能细胞(如神经元、心肌细胞、胰岛 β 细胞等),最终应用于科研、疾病治疗、药物研发等领域的技术体系。正是基于 iPSC 基因编辑 “以 iPSC 为载体、以基因编辑为工具” 的核心逻辑,其在基因编辑领域展现出从基础科研到临床转化的多元应用价值,成为推动生物医学突破的关键力量
二、iPSC基因编辑有哪些应用场景?
基础科研:基因功能研究的 “全能工具台”
1.突破细胞来源限制,实现长期稳定研究
iPSC 可从成人体细胞(如皮肤成纤维细胞、外周血单核细胞)重编程获得,无需依赖胚胎干细胞,伦理争议小且来源广泛。结合CRISPR/Cas9基因编辑技术,可精准实现基因敲除、敲入、点突变等修饰,且修饰后的 iPSC 能无限增殖传代,为基因功能的长期追踪研究提供稳定细胞模型。例如,通过编辑 iPSC 中的关键信号通路基因,可持续观察其对细胞分化、增殖、凋亡的影响,解决原代细胞难以长期培养的痛点。
![图1. p53的连续失活会导致诱导多能干细胞(iPSC)形成减少[3]](/uploads/allimg/260106/1.png)
图1. p53的连续失活会导致诱导多能干细胞(iPSC)形成减少[3]
2.多向分化特性,覆盖多组织器官研究场景
iPSC 可分化为神经元、心肌细胞、肝细胞、胰岛 β 细胞等多种功能细胞,结合基因编辑可构建 “特定基因修饰 + 特定组织细胞” 的精准模型。例如,编辑神经相关基因后分化为神经元,为阿尔茨海默病、帕金森病等神经退行性疾病的基因功能研究提供理想工具。
疾病建模:从 “体外模拟” 到 “精准预测”
1.患者特异性疾病模型构建,还原疾病本质
利用患者自身细胞重编程的 iPSC,通过基因编辑验证 “致病基因 - 疾病表型” 的因果关系,避免传统动物模型与人类疾病的差异。例如,针对遗传性心肌病患者,可从其体内获取细胞构建 iPSC,通过基因编辑修正致病突变,观察分化后的心肌细胞是否恢复正常功能,直接验证该基因的致病作用;对于罕见病,可通过编辑 iPSC 模拟致病突变,解决罕见病样本稀缺、研究难以开展的问题。
![图2. 恒河猴工程化心肌(EHM)的制备与表征[4]](/uploads/allimg/260106/2.png)
图2. 恒河猴工程化心肌(EHM)的制备与表征[4]
2.动态追踪疾病进展,揭示病理机制
iPSC 分化过程可模拟人体胚胎发育及疾病发生发展的动态过程,结合基因编辑技术可精准调控致病基因的表达时序,观察疾病从早期到晚期的病理变化。例如,在脊髓性肌萎缩症(SMA)研究中,通过编辑 iPSC 中的致病基因,追踪其分化为运动神经元的过程中,神经元凋亡、功能异常的时序规律,为揭示 SMA 的病理机制提供关键依据。
![图3. 编辑 iPSC 中的致病基因为揭示 SMA 的病理机制提供关键依据[5]](/uploads/allimg/260106/3.png)
图3. 编辑 iPSC 中的致病基因为揭示 SMA 的病理机制提供关键依据[5]
药物研发:提升筛选效率与临床转化成功率
1.高通量药物筛选的 “精准平台”
基因编辑修饰后的 iPSC 分化而来的功能细胞,可模拟疾病状态下的细胞表型,用于药物的高通量筛选与活性验证。相比传统细胞模型,iPSC 来源的疾病特异性细胞更贴近人体生理状态,筛选出的药物更具临床转化价值。例如,针对囊性纤维化,利用基因编辑构建的囊性纤维化相关基因修饰 iPSC,分化为气道上皮细胞后,可快速筛选能修复离子通道功能的潜在药物,大幅降低药物研发的时间成本与失败率。
2.药物毒性与安全性评估的 “替代模型”
iPSC 可分化为肝细胞、心肌细胞、肾小管细胞等药物代谢相关细胞,结合基因编辑可模拟不同人群的基因多态性(如药物代谢酶基因多态性),评估药物在不同遗传背景下的毒性反应。例如,通过编辑 iPSC 中的药物代谢关键基因,可预测不同患者对药物的代谢速率与毒性风险,实现 “个体化药物安全性评估”,为临床合理用药提供参考。
![图4. 建立并功能表征携带CFTR S308X无义突变的iPSC衍生气道类器官[7]](/uploads/allimg/260106/4.png)
图4. 建立并功能表征携带CFTR S308X无义突变的iPSC衍生气道类器官[7]
细胞治疗:基因编辑与干细胞治疗的 “强强联合”
1.遗传性疾病的根治性治疗探索
对于单基因遗传病,通过基因编辑技术修正 iPSC 中的致病突变,再将修饰后的 iPSC 分化为功能细胞移植回患者体内,实现 “基因修正 + 细胞替代” 的双重治疗效果。例如,针对镰状细胞贫血症,可从患者体内获取造血干细胞样细胞构建 iPSC,通过 CRISPR 技术修正 β- 珠蛋白基因的致病突变,再分化为造血干细胞移植回患者体内,重建正常的造血功能;目前,该类疗法已进入临床试验阶段,为遗传性疾病的根治提供了新方向。
2.解决细胞治疗的免疫排斥问题
利用基因编辑技术敲除 iPSC 中的人类白细胞抗原(HLA)相关基因,可构建 “通用型” iPSC 细胞库,其分化后的功能细胞移植时可避免宿主的免疫排斥反应,无需依赖患者自身 iPSC,大幅降低细胞治疗的制备成本与时间。例如,通用型 iPSC 来源的心肌细胞可用于心力衰竭患者的细胞移植,通用型神经元可用于神经损伤修复,为细胞治疗的规模化应用奠定基础。
3.复杂疾病的细胞替代治疗潜力
对于糖尿病、帕金森病、脊髓损伤等非遗传性疾病,可通过基因编辑优化 iPSC 的分化效率与功能稳定性,再分化为胰岛 β 细胞、多巴胺能神经元、神经干细胞等进行移植。例如,通过编辑 iPSC 中的分化相关基因,提升其分化为胰岛 β 细胞的比例与胰岛素分泌功能,移植后可替代受损的胰岛细胞,为 1 型糖尿病患者提供长期有效的治疗方案。
![图5. INS c.188-31G>A 突变在分化的人类类β细胞中产生胰岛素 mRNA 亚型,但不产生胰岛素[8]](/uploads/allimg/260106/5.png)
图5. INS c.188-31G>A 突变在分化的人类类β细胞中产生胰岛素 mRNA 亚型,但不产生胰岛素[8]
三、结语:iPSC 与基因编辑的 “协同效应”
iPSC 的 “全能性”与基因编辑的 “精准性”相结合,形成了强大的协同效应:不仅解决了传统科研模型 “不贴近人体生理状态”“难以长期稳定培养” 的痛点,更推动了疾病研究从 “表面现象观察” 向 “深层机制解析”、治疗模式从 “对症缓解症状” 向 “根治疾病根源” 的跨越。
在基因编辑技术持续迭代(如碱基编辑、引导编辑技术的出现)、iPSC 培养分化技术不断成熟的背景下,iPSC 的应用场景还将进一步拓展 —— 从基础科研中的基因功能验证,到疾病建模中的个体化模拟,再到药物研发中的高效筛选,以及细胞治疗中的临床转化,iPSC 正逐渐成为基因编辑领域的 “核心载体”,为生物医学的创新发展提供源源不断的动力,也为更多生命健康难题的破解,带来了可期的未来。
源井生物iPSC基因编辑
源井生物的iPSC基因编辑技术是通过基于CRISPR/Cas9体系的基因编辑技术,对iPSCs进行基因敲除、敲入、修复或点突变等编辑操作,可应用于疾病模型构建、基因治疗,以及病理学和发育生物学的机制研究。
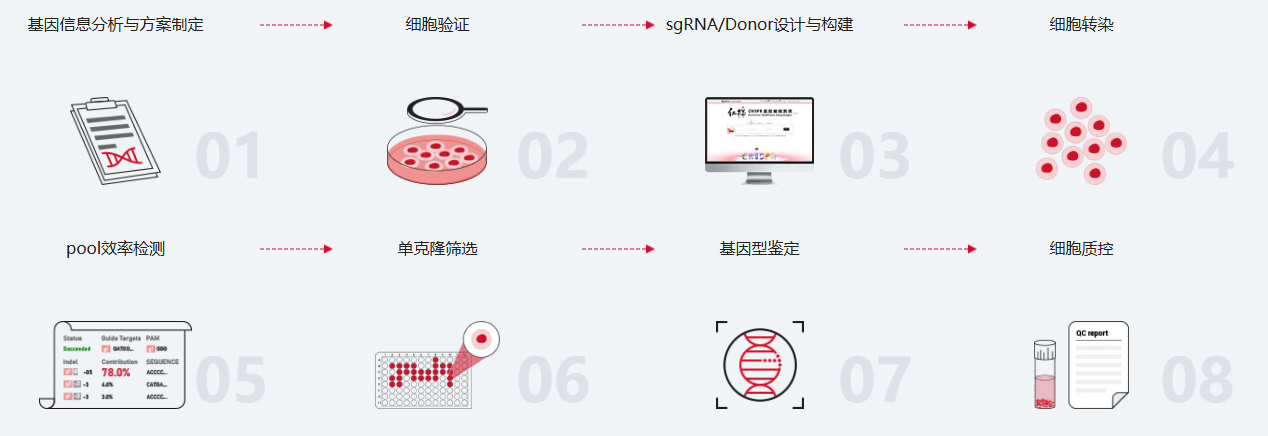
技术服务路线
源井独家优势
- 全方位服务:从细胞培养到基因编辑再到定向分化,全流程覆盖。
- 创新技术:具备自主研发的创新CRISPR技术、EZ-HRexTM基因编辑技术,确保编辑结果的准确性和稳定性。
- 优良品质:独家iPSC培养体系,优化细胞状态,确保细胞干性。
- 丰富案例:300+干细胞成功案例, 13000个项目成功案例。
- 技术支持:博士级别技术支持,您有问题随时解答。
更多iPSC技术服务
iPSCs具有多向分化的潜力,可以在体外定向分化为特定的细胞类型。我们提供高效且可靠的 定向分化 技术,帮助您快速获得目标细胞,用于疾病模型研究、药物筛选、再生医学等领域。
立即咨询 ,让干细胞实验少走弯路,加速成果产出!
参考文献
[1]McTague A, Rossignoli G, Ferrini A, Barral S, Kurian MA. Genome Editing in
iPSC-Based Neural Systems: From Disease Models to Future Therapeutic Strategies.
Front Genome Ed. 2021 Mar 15;3:630600. doi: 10.3389/fgeed.2021.630600. PMID:
34713254; PMCID: PMC8525405.
[2]Xu L, Wang J, Liu Y, Xie L, Su B, Mou D, Wang L, Liu T, Wang X, Zhang B, Zhao
L, Hu L, Ning H, Zhang Y, Deng K, Liu L, Lu X, Zhang T, Xu J, Li C, Wu H, Deng
H, Chen H. CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic
Leukemia. N Engl J Med. 2019 Sep 26;381(13):1240-1247. doi:
10.1056/NEJMoa1817426. Epub 2019 Sep 11. PMID: 31509667.
[3]Yi L, Lu C, Hu W, Sun Y, Levine AJ. Multiple roles of p53-related pathways in
somatic cell reprogramming and stem cell differentiation. Cancer Res. 2012 Nov
1;72(21):5635-45. doi: 10.1158/0008-5472.CAN-12-1451. Epub 2012 Sep 10. PMID:
22964580.
[4]Jebran AF, Seidler T, Tiburcy M, Daskalaki M, Kutschka I, Fujita B, Ensminger
S, Bremmer F, Moussavi A, Yang H, Qin X, Mißbach S, Drummer C, Baraki H,
Boretius S, Hasenauer C, Nette T, Kowallick J, Ritter CO, Lotz J, Didié M,
Mietsch M, Meyer T, Kensah G, Krüger D, Sakib MS, Kaurani L, Fischer A, Dressel
R, Rodriguez-Polo I, Stauske M, Diecke S, Maetz-Rensing K, Gruber-Dujardin E,
Bleyer M, Petersen B, Roos C, Zhang L, Walter L, Kaulfuß S, Yigit G, Wollnik B,
Levent E, Roshani B, Stahl-Henning C, Ströbel P, Legler T, Riggert J, Hellenkamp
K, Voigt JU, Hasenfuß G, Hinkel R, Wu JC, Behr R, Zimmermann WH. Engineered
heart muscle allografts for heart repair in primates and humans. Nature. 2025
Mar;639(8054):503-511. doi: 10.1038/s41586-024-08463-0. Epub 2025 Jan 29. PMID:
39880949; PMCID: PMC11903342.
[5]Grass T, Dokuzluoglu Z, Buchner F, Rosignol I, Thomas J, Caldarelli A,
Dalinskaya A, Becker J, Rost F, Marass M, Wirth B, Beyer M, Bonaguro L,
Rodriguez-Muela N. Isogenic patient-derived organoids reveal early
neurodevelopmental defects in spinal muscular atrophy initiation. Cell Rep Med.
2024 Aug 20;5(8):101659. doi: 10.1016/j.xcrm.2024.101659. Epub 2024 Jul 26.
PMID: 39067446; PMCID: PMC11384962.
[6]Tsai PH, Yang YP, Wang CH, Liang KH, Yeh CL, Huang TY, Hwang TC, Lo WL, Lan
YT, Ching LJ, Wang ML, Huo TI, Luo YH, Chiou SH, Chou SJ. Multimodal single-cell
transcriptomics with patient-specific iPSC-derived airway organoids as a drug
screening approach for cystic fibrosis with nonsense mutations. Biomed
Pharmacother. 2025 Oct;191:118476. doi: 10.1016/j.biopha.2025.118476. Epub 2025
Aug 18. PMID: 40829314.
[7]Sato M, Saitoh I, Inada E. Efficient CRISPR/Cas9-based gene correction in
induced pluripotent stem cells established from fibroblasts of patients with
sickle cell disease. Stem Cell Investig. 2016 Nov 14;3:78. doi:
10.21037/sci.2016.11.05. PMID: 28066780; PMCID: PMC5182212.
[8]Panova AV, Klementieva NV, Sycheva AV, Korobko EV, Sosnovtseva AO, Krasnova
TS, Karpova MR, Rubtsov PM, Tikhonovich YV, Tiulpakov AN, Kiselev SL. Aberrant
Splicing of INS Impairs Beta-Cell Differentiation and Proliferation by ER Stress
in the Isogenic iPSC Model of Neonatal Diabetes. Int J Mol Sci. 2022 Aug
8;23(15):8824. doi: 10.3390/ijms23158824. PMID: 35955956; PMCID: PMC9369396.










